Промежуточная контрольная работа по химии для 7 классов.
Спецификация промежуточной контрольной работы.
1.Назначение контрольной работы.
Оценить уровень общеобразовательной подготовки по химии учащихся 7 классов общеобразовательного учреждения за первое полугодие .
Предлагаемая работа предполагает включение заданий метапредметного плана, что позволяет отследить сформированность УУД у учащихся.
2.Цель промежуточной контрольной работы:
оценить уровень усвоения учащимися 7класса предметного содержания курса химии за первое полугодие по программе основной школы, и выявления элементов содержания, вызывающих наибольшие затруднения.
Основой разработки вариантов работы является Федеральный государственный стандарт основного общего образования и примерная программа курса «Химия. Вводный курс» для 7 класса общеобразовательных учреждений по химии, авторы О.С. Габриелян, И.Г. Остроумов, 2013 г
Материал промежуточной проверочной работы направлен на проверку усвоения семиклассниками важнейших знаний, предметных умений .Связь работы с ОГЭ и ЕГЭ проявляется в построении структуры КИМ.
3. Структура контрольной работы.
Работа состоит из 2-х вариантов, каждый из которых, включает 16 заданий и состоит из двух частей. Часть 1 (А) содержит 14 заданий с выбором одного варианта ответа из четырех предложенных. Все задания базового уровня сложности. Часть II(С)- содержит два задания повышенного уровня сложности с развернутым ответом
План работы:
| А1 | атомы химических элементов |
| А2 | атомы химических элементов |
| А3 | количественные соотношения |
| А4 | количественные соотношения |
| А5 | количественные соотношения |
| А6 | соединения химических элементов |
| А7 | соединения химических элементов |
| А8 | массовая доля вещества в растворе |
| А9 | массовая доля вещества в растворе |
| А10 | изменения, происходящие с веществами |
| А11 | изменения, происходящие с веществами |
| А12 | молекулярная масса веществ |
| А13 | химические символы |
| А14 | лабораторное оборудование |
| С1 | умение рассчитывать массовую долю элемента в сложном веществе |
| С2 | умение рассчитывать массовую долю вещества в растворе |
4. Распределение заданий по основным группам предметных действий.
Задания уровня А (тесты с одним правильным ответом), позволяют прежде всего определить уровень предметных УУД: знание важнейших химических понятий: химический элемент, атом, молекула, относительная атомная и молекулярная массы, агрегатное состояние вещества; знание лабораторного оборудования, ТБ умение объяснять отличия физических явлений от химических; называть некоторые химические элементы и соединения.
Задания уровня С. позволяют выявить уровень сформированности предметных УУД : вычислять массовую долю химического элемента по формуле соединения, объемную долю газа в смеси, массовую долю вещества в растворе, массовую долю примесей; проводить простейшие расчеты по химическим формулам и уравнениям реакций.
5. Система оценивания.
Верно выполненное задание базового уровня (задания части А) оценивается в 1 балл. Верно выполненное задание повышенного уровня оценивается (часть2 С1- С2) от 0 до 5 баллов. Максимальное количество баллов -24.
6.Продолжительность работы 40 минут.
7.Кодификатор контрольной работы
Часть 1
|
| Вариант 1 | Вариант 2 |
| А1 | 1 | 2 |
| А2 | 3 | 2 |
| А3 | 2 | 2 |
| А4 | 3 | 3 |
| А5 | 4 | 3 |
| А6 | 2 | 3 |
| А7 | 2 | 2 |
| А8 | 4 | 4 |
| А9 | 2 | 1 |
| А10 | 4 | 1 |
| А11 | 1 | 3 |
| А12 | 1 | 4 |
| А13 | 2 | 3 |
| А14 | 4 | 3 |
Часть 2
|
| Вариант 1 | Вариант 2 |
| С1 | 70 % | 72,4% |
| С2 | 8% | 16,6% |
Дорогой семиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 2 частей и включает 16 заданий.
Часть 1 включает 14 заданий базового уровня (А1-А14). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 содержит 2 наиболее сложных задания (С1-С2), которые требуют полного ответа. За выполнение задания ты можешь получить С1 –5 баллов.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 24 балла. Желаю успеха!
Система оценивания работы:
| 0-7 баллов – «2» | 8-12 баллов – «3» |
| 13-18 баллов – «4» | 19-24 баллов – «5» |
Система оценивания работы:
| 0-6 баллов – «2» | 7-11 баллов – «3» |
| 12-16 баллов – «4» | 17-20 баллов – «5» |
Контрольная работа
ВАРИАНТ-1
Часть 1
| При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа. |
А1. Элемент третьего периода главной подгруппы III группы ПСХЭ - это:
| 1) алюминий | 3) магний |
| 2) бериллий | 4) бор |
А2. Элемент третьего периода главной подгруппы V группы ПСХЭ - это:
| 1) азот | 3) фосфор |
| 2) алюминий | 4) углерод |
А3. Запись 3О2 означает:
| 1) 2 молекулы кислорода | 3) 5 атомов кислорода |
| 2) 3 молекулы кислорода | 4) 6 атомов кислорода |
А4. Запись 4N означает:
| 1) 4 молекулы азота | 3) 4 атома азота |
| 2) 2 молекулы азота | 4) 4 атома натрия |
А5. Масса 3 моль сероводорода Н2S равна:
| 1) 33г | 3) 34г |
| 2) 99г | 4) 102г |
А6. Смесью веществ в отличие от чистого вещества является:
| 1) алюминий | 3) магний |
| 2) водопроводная вода | 4) углекислый газ |
A7.Смесью веществ, в отличие от чистого вещества, является:
| 1) алюминий | 3) азот |
| 2) воздух | 4) золото |
А8. В 80г воды растворили 20г соли. Массовая доля соли в полученном растворе равна:
| 1) 40% | 3) 50% |
| 2) 25% | 4) 20% |
А9. В 450г воды растворили 50г соли. Массовая доля соли в полученном растворе равна:
| 1) 9% | 3) 14% |
| 2)10% | 4) 11% |
А10. Физическое явление - это:
| 1) ржавление железа | 3) скисание молока |
| 2) горение древесины | 4) плавление свинца |
А11. Химическое явление - это:
| 1) горение свечи | 3) испарение бензина |
| 2) плавление льда | 4) образование льда |
А12. Относительная молекулярная масса СО2
А13. Химический символ элемента купрум
А 14. Верны ли суждения о правилах работы в химических лабораториях:
А) Излишек раствора из пробирки можно перелить в емкость с исходным реактивом.
Б) Для фиксации пробирки во время нагревания можно использовать тигельные щипцы.
| 1) верно только А | 3) верны оба суждения |
| 2) верно только Б | 4) оба суждения неверны |
Часть 2
С1. Рассчитайте массовую долю железа в красном железняке, имеющем формулу Fe2O3.
С2. Рассчитайте массовую долю соли в растворе, полученном добавлением 50 г воды к 200 г 10%-ного раствора соли.
Дорогой семиклассник!
На выполнение контрольной работы отводится 40 минут. Работа состоит из 2 частей и включает 16 заданий.
Часть 1 включает 14 заданий базового уровня (А1-А14). К каждому заданию дается 4 варианта ответа, из которых только один правильный. За выполнение каждого задания - 1 балл.
Часть 2 содержит 2 наиболее сложных задания (С1-С2), которые требуют полного ответа. За выполнение задания ты можешь получить С1 –5 баллов.
Баллы, полученные за выполненные задания, суммируются. Максимально ты можешь набрать 24 балла. Желаю успеха!
Система оценивания работы:
| 0-7 баллов – «2» | 8-12 баллов – «3» |
| 13-18 баллов – «4» | 19-24 баллов – «5» |
ВАРИАНТ-2
Часть 1
| При выполнении заданий этой части под номером выполняемого вами задания поставьте знак «Х» в клеточку, номер которой соответствует номеру выбранного вами ответа. |
А1. Элемент второго периода главной подгруппы III группы ПСХЭ - это:
| 1) литий | 3) кальций |
| 2) бор | 4) магний |
А2. Элемент четвертого периода главной подгруппы II группы ПСХЭ - это:
| 1) натрий | 3) калий |
| 2) кальций | 4) углерод |
А3. Запись 5N2 означает:
| 1) 2 молекулы азота | 3) 7 атомов азота |
| 2) 5 молекул азота | 4) 10 атомов азота |
А4. Запись 6Н означает:
| 1) 6 молекул водорода | 3) 6 атомов водорода |
| 2) 3 молекулы водорода | 4) 6 атомов гелия |
А5. Масса 5 моль аммиака NН3равна:
| 1) 50г | 3) 75г |
| 2) 68г | 4) 85г |
А6. Чистое вещество в отличие от смеси - это:
| 1) морская вода | 3) кислород |
| 2) воздух | 4) молоко |
А7. Смесью веществ не является:
| 1) речная вода | 3) воздух |
| 2) дистиллированная вода | 4) почва |
А8. В 180г воды растворили 20г хлорида натрия. Массовая доля соли в полученном растворе равна:
| 1) 15% | 3) 30% |
| 2) 20% | 4) 10% |
A9. В 120г воды растворили 30г соли. Массовая доля соли в полученном растворе равна:
| 1) 20% | 3) 30% |
| 2) 25% | 4) 10% |
А10. Физическое явление - это:
| 1) испарение воды | 3) горение керосина |
| 2) скисание молока | 4) появление ржавчины |
А11. Химическое явление - это:
| 1) плавление олова | 3) горения магния |
| 2) замерзания воды | 4) образование тумана |
А12. Относительная молекулярная масса Na2O
А13. Химический символ элемента силициум
А14. Верны ли суждения о правилах работы с лабораторным оборудованием:
А) Мерный цилиндр используют для измерения объема жидкостей.
Б) Для прекращения горения спиртовки необходимо накрыть фитиль колпачком
| 1) верно только А | 3) верны оба суждения |
| 2) верно только Б | 4) оба суждения неверны |
Часть 2
С1.Рассчитайте массовую долю железа в магнитном железняке, имеющем формулу Fe3О4.
С2. Рассчитайте массовую долю соли в растворе, полученном при добавлении 50 г воды к 250 г 20%-ного раствора соли.
П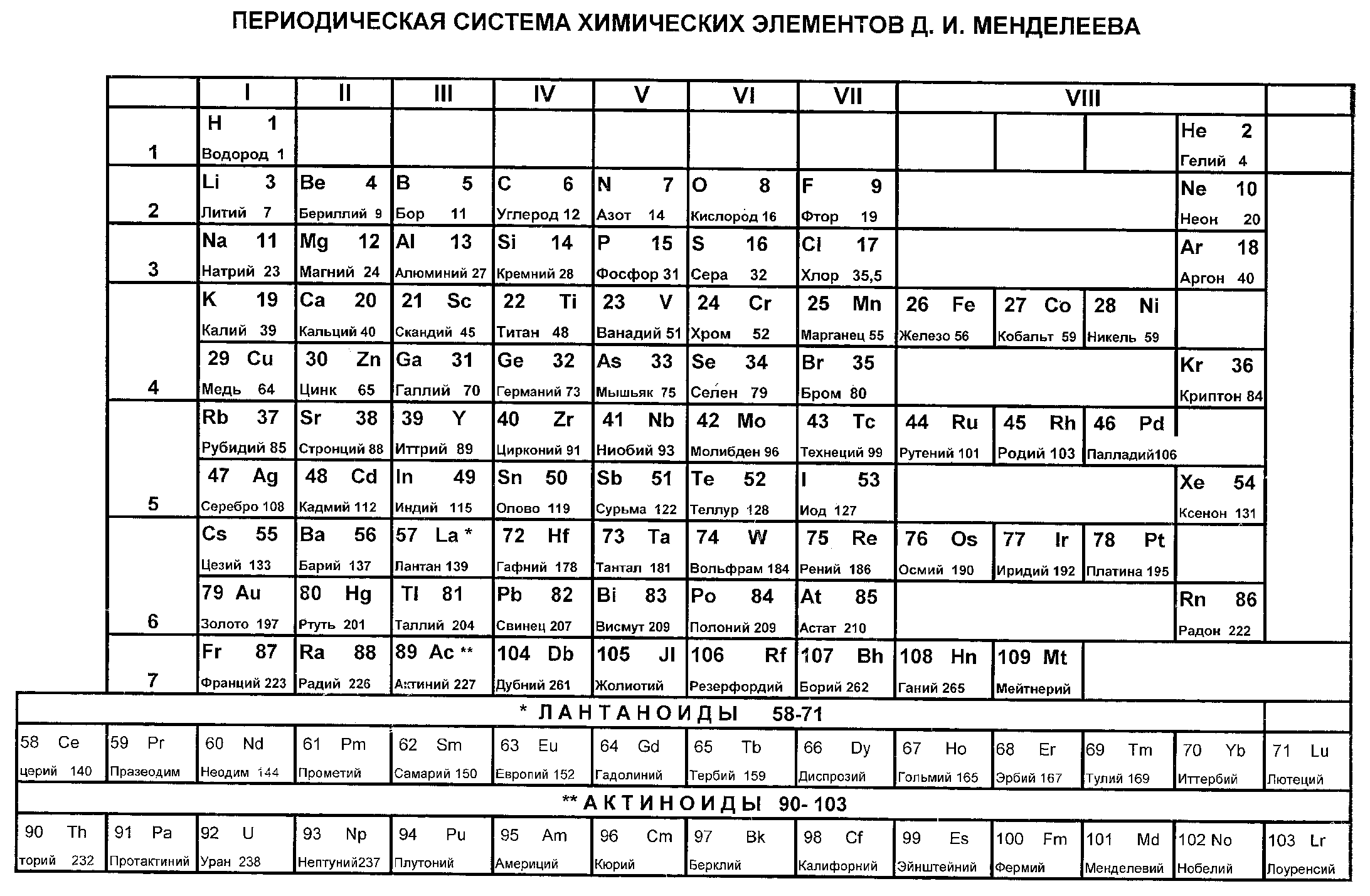 риложение 1
риложение 1
Приложение 2

Приложение 3


Часть С
Оценка «_____»
Учитель: ________________ / ________________
Ассистент: ________________ / ________________
6







 риложение 1
риложение 1













