Просмотр содержимого документа
«Общая характеристика неметаллов»
Общая характеристика неметаллов.
 Вещества
Вещества
Простые Сложные
вещества, которые состоят вещества, которые состоят
из атомов одного элемента из атомов разных элементов
| Простые вещества |
| Металлы - образованы атомами, которые содержат на внешнем энергетическом уровне чаще всего от 1е-до 3е- |
| Неметаллы - образованы атомами, которые содержат на внешнем энергетическом уровне чаще всего от 4е- до 7е- |
| Благородные газы (инертные газы) – образованы атомами, которые содержат завершенный внешний энергетический уровень. (VIIIА группы) |
Из 112 известных элементов 16 относятся к неметаллам.
Находятся только в главных подруппах.
Особые названия отдельных групп неметаллов
Галогены – неметаллы VIIА группы
Халькогены – неметаллы VIА группы
В периоде
 F (самый активный неметалл)
F (самый активный неметалл)
г неметаллические
р свойства
у усиливаются
п
п
е
Самые активные неметаллы – галогены, так как имеют на внешнем энергетическом уровне 7е-.
Неметаллы:
(все имеют ковалентную неполярную связь)
А) молекулярное строения – молекулы состоят из двух одинаковых атомов
«Великолепная семёрка» - H2; O2; N2; F2; CI2; Br2; J2
Б) Атомное строения – состоят из атомов, между которыми существуют ковалентные химические связи (С, Р, S и т.д.)
Запомните: Название простых веществ совпадают с названием
химических элементов.
Для неметаллов характерна аллотропия.
Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ.
Аллотропные модификации или аллотропные видоизменения – разные простые вещества, которые образуются одним и тем же химическим элементом.
Примеры аллотропии.
| химический элемент | Простые вещества (аллотропные модификации) |
| О | Озон - О3, (газ, который образует озоновый слой) кислород - О2 ( газ, которым мы дышим) ( причина аллотропия – разный состав) |
| С | алмаз, (вспомните бриллианты) графит, (вспомните простой карандаш) (разная кристаллическая решетка) |
| Р | красный, белый, черный (разная кристаллическая решетка) |
| S | ромбическая, моноклинная, пластическая (разная кристаллическая решетка) |
Сравнительная характеристика физических свойств
неметаллов и металлов
| Свойства | Металлы | Неметаллы |
| Агрегатное состояние | Твердые (кроме ртути Hg –жидкий) | Твердые Сера - S Фосфор- P Углерод- C Йод –– J2 и др. Жидкие Бром – Br2 Газообразные Водород – H2 Кислород – O2 Азот – N2 Фтор –F2 Хлор – CI2 и др. |
| Металлический блеск | Имеют | Не имеют, (кроме йода - J2 и графита- С) |
| Электро- и теплопроводность | Проводят электрический ток | Не проводят (кроме графита- С и кремния – Si) |
| Другие свойства | Ковкие, пластичные, тягучие | Хрупкие |
Соединения неметаллов.
неметалл → оксид → кислота
P → P2O5 → H3PO4
Оксиды – солеобразующие, кислотные, им соответствуют кислоты
(ИСК: NO, CO, SiO, N2O несолеобразующие)
Номенклатура бинарных соединений неметаллов
| Летучие водородные соединения неметаллов - соединения водорода с неметаллами.
| Бинарные соединения металлов, твердые, тугоплавкие вещества |
| СН4 –метан SiH4 - силан NH3 - аммиак PH3 - фосфин H2S - сероводород HF - фтороводород HCI - хлороводород HBr - бромоводород HJ – йодоводород
|
S -2 Сульфид CI -1 Хлорид O -2 Оксид N -3 Нитрид H -1 Гидрид Br -1 Бромид F -1 Фторид C - 4 Карбид  Р – 3 Фосфид Р – 3 Фосфид
|
→
Степени окисления некоторых неметаллов.
|
| Низшая вос-ль | Промежуточная может быть и ок-ль, и в-ль | Высшая ок-ль
|
| углерод | -4 | 0; +2; | +4 |
| кремний | -4 | 0; +2; | +4 |
| азот | -3 | 0; +1; +2; +3; +4 | +5 |
| фосфор | -3 | 0; +3 | +5 |
| сера | -2 | 0; +2; +4 | +6 |
| хлор | -1 | 0; +1; +3; +5; | +7 |
Химические свойства
| Окислители (с менее электроотрицательными) | Восстановители (с более электроотрицательными) |
с металлами 2Na + CI2 = 2NaCI | с кислородом S + O2 = SO2 |
с водородом H2 + CI2 = 2HCI | 2) с хлором S + CI2 = SCI2 |
Просмотр содержимого презентации
«неметаллы»
Неметаллы
Интернет-ресурсы :
шаблон создания тестов в PowerPoint
Результат теста
Верно: 15
Ошибки: 0
Отметка: 5
Повторить
тест
Время: 1 мин. 44 сек.

Иону S 2- соответствует электронная формула:
2 e - 8 e - 8 e - .
2 e - 8 e - 6 e - .
2e - 8e -
2e - 8e - 5e -

Формулы высшего оксида и летучего водородного соединения элемента Э с электронной формулой атома 2 e - 4 e - :
Э O 3 и Н 2 Э
Э 2 O 7 и НЭ.
Э O 2 и ЭН 4
Э 2 O 5 и ЭН 3
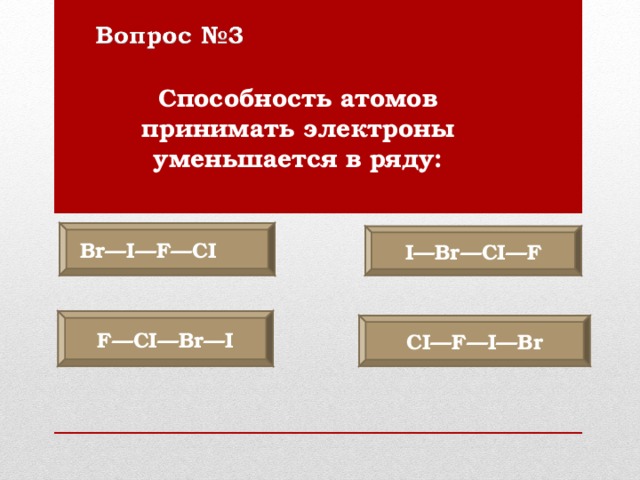
Способность атомов принимать электроны уменьшается в ряду:
Br — I — F — CI
I — Br — CI — F
F — CI — Br — I
CI—F—I—Br

Оксид серы ( VI ) не взаимодействует с веществом, формула которого:
С O 2
Н 2 O
MgO
КОН

Схеме превращения N +2 → N +4 соответствует химическое уравнение: :
2 NO + 0 2 = 2 N 0 2
N 2 + ЗН 2 = 2 NH 3
N 2 + 0 2 = 2 NO
N 2 + 3 Mg = Mg 3 N 2

Сера взаимодействует с каждым из веществ группы:
FeO, NaOH, CuO
S О 2 , H 2 , N 2 O
O 2 , Н 2 , С u
S О 2 , H 2 , N 2 O
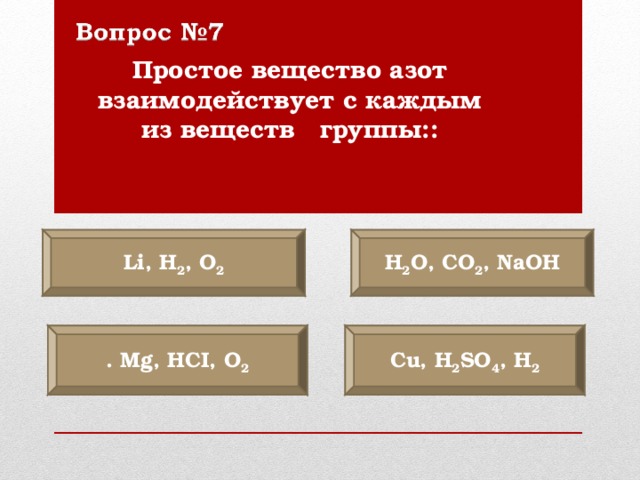
Простое вещество азот взаимодействует с каждым из веществ группы::
Li, H 2 , O 2
Н 2 O, С O 2 , NaOH
С u, H 2 SO 4 , H 2
. Mg, HCI, O 2

Простое вещество фосфор взаимодействует с каждым из веществ группы:
Н 2 O , Са, NaCI
O 2 , С I 2 , Са
NaOH , O 2 , Са
Н 2 О, С I 2 , Са
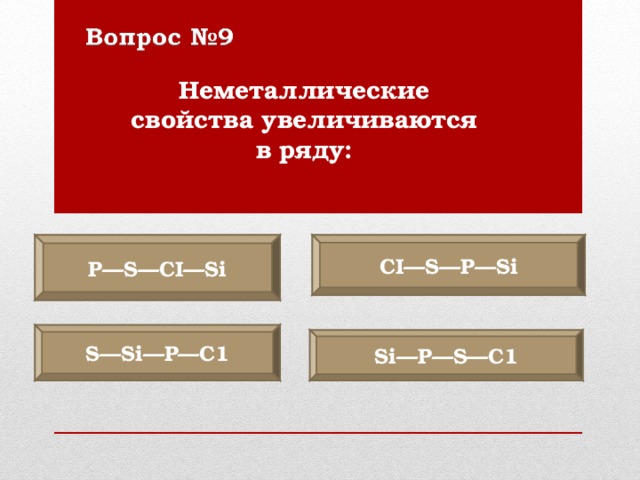
Неметаллические свойства увеличиваются в ряду:
Р —S—CI—Si
CI—S— Р —Si
S—Si—P—C1
Si— Р —S—C1

Какую связь образуют между собой атомы в молекуле Н 2 :
ковалентная полярная
ионная
ковалентная неполярная
металлическая

Число неспаренных электронов в атоме фосфора:
три
один
два
пять

Какая пара атомов связана ионной связью:
хлор и водород
углерод и водород
калий и сера
азот и водород

Ковалентная полярная связь
образуется:
между атомами
железа
в молекуле кислорода
в молекуле аммиака
в поваренной соли

Путем соединения атомов одного и того же химического элемента - неметалла образуется связь:
Ковалентная неполярная
Ковалентная полярная
Металлическая
Ионная

В молекуле сероводорода общие злектронные пары смещены в сторону:
серы
водорода
не смещены ни к водороду, ни к сере
нет правильного ответа





 Вещества
Вещества

 Р – 3 Фосфид
Р – 3 Фосфид


























