Проверочная работа по химии в формате ОГЭ, вариант 1.
-
Выберите два высказывания, в которых говорится о хлоре как о простом веществе.
-
Хлор содержится в составе многих органических растворителей.
-
Относительная атомная масса хлора равна 35,45.
-
Хлор чрезвычайно токсичен, поэтому при работе с ним следует соблюдать меры безопасности.
-
В природе встречаются два изотопа хлора.
-
Впервые хлор был получен Шееле в 1774 г.
-
На рисунке изображена модель строения ядра атома некоторого химического элемента.
Запишите в таблицу номер периода (X), в котором данный химический элемент расположен в Периодической системе Д. И. Менделеева, и величину заряда ядра (Y) его атома. (Для записи ответа используйте арабские цифры.)
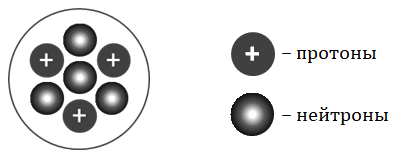
3. Расположите химические элементы
1) Магний
2) Кремний
3) Алюминий
в порядке увеличения их атомного радиуса.
Запишите указанные номера элементов в соответствующем порядке.
4. Установите соответствие между формулой соединения и степенью окисления железа в этом соединении: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| ФОРМУЛА СОЕДИНЕНИЯ | СТЕПЕНЬ ОКИСЛЕНИЯ ЖЕЛЕЗА |
| А) FeCO3 Б) Fe(NO3)2 В) Fe2O3 | 1) +6 2) +2 3) +3 4) +4 |
Запишите в таблицу выбранные цифры под соответствующими буквами.
5. Из предложенного перечня выберите два вещества с ковалентной неполярной связью.
-
Ca
-
BaCl2
-
H2О2
-
S8
-
Р2O3
6. Какие два утверждения верны для характеристики как кремния, так и кислорода?
-
Соответствующее простое вещество является неметаллом
-
На внешнем энергетическом уровне в атоме находится два электрона
-
Значение электроотрицательности больше, чем у магния
-
Электроны в атоме расположены на трёх энергетических уровнях
-
В соединениях элемент проявляет только положительную степень окисления
7. Из предложенного перечня веществ выберите однооснóвную кислоту и основание.
-
HNO3
-
ZnO
-
H2S
-
Al(OH)3
-
Fe(OH)2
Запишите в поле ответа сначала номер однооснóвной кислоты, а затем номер основания.
8. Какие два из перечисленных веществ вступают в реакцию с хлором?
-
H2SO4
-
SiO2
-
FeCl2
-
Cu
-
Na2O
9. Установите соответствие между формулой вещества и реагентами, с каждым из которых это вещество может взаимодействовать.
| ФОРМУЛА ВЕЩЕСТВА | РЕАГЕНТЫ |
| А) S Б) SO3 В) Ba(OH)2 | 1) HCl, CuCl2 2) H2SO4 (р-р), Mg 3) KOH, H2O 4) HNO3, O2 |
10. Из предложенного перечня выберите схемы двух реакций, которые относятся к реакциям разложения.
-
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
-
Mg(OH)2 + H2SO4 → MgSO4 + H2O
-
Fe(NO3)3 → Fe2O3 + NO2 + O2
-
BaCl2 + K2SO4 → KCl + BaSO4
-
NH4NO3 → H2O + N2
11. Установите соответствие между реагирующими веществами и признаком протекающей между ними реакции: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| РЕАГИРУЮЩИЕ ВЕЩЕСТВА | ПРИЗНАК РЕАКЦИИ |
| А) KI и AgNO3 Б) Al и NaOH (р-р) В) HCl и Na2SO3 | 1) Выделение газа без запаха 2) Выделение газа с запахом 3) Выпадение белого осадка 4) Выпадение жёлтого осадка |
Запишите в таблицу выбранные цифры под соответствующими буквами.
12. Из предложенного перечня веществ выберите два слабых электролита.
-
SO3
-
Н2S
-
HNO2
-
HCl
-
СаО
13. Выберите два исходных вещества, взаимодействию которых соответствует сокращённое ионное уравнение реакции
3Ba2+ + 2PO43– = Ba3(PO4)2
-
K3PO4
-
Ba(OH)2
-
H3PO4
-
BaCO3
-
BaO
-
BaSO4
14. Установите соответствие между схемой процесса, происходящего в окислительно-восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| СХЕМА ПРОЦЕССА | НАЗВАНИЕ ПРОЦЕССА |
| А) N+4 → N+3 Б) Al0 → Al+3 В) C–4 → C+4 | 1) Окисление 2) Восстановление |
Запишите в таблицу выбранные цифры под соответствующими буквами.
15. Установите соответствие между двумя веществами, взятыми в виде водных растворов, и реактивом, с помощью которого можно различить эти два вещества между собой: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| А) BaCl2 и LiCl Б) LiCl и HCl В) ZnSO4 и NH4Cl | 1) NaOH 2) Лакмус 3) HNO3 4) K2SO4 |
16. Используя метод электронного баланса, расставьте коэффициенты в уравнении реакции, схема которой
Cr + O2 + HCl → CrCl3 + H2O
Определите окислитель и восстановитель.
18. Дана схема превращений:
C → Х → Na2CO3 → CaCO3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения. Для третьего превращения составьте сокращённое ионное уравнение реакции.
19. К раствору с массовой долей гидроксида натрия 5% добавили избыток раствора сульфата меди (II). При этом образовался осадок массой 4,9 г. Определите массу исходного раствора щелочи. В ответе запишите уравнение реакции, о которой идет речь в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).

























