Просмотр содержимого документа
«Проверочная работа. Теория электролитический диссоциации»
Проверочная работа.
Теория электролитический диссоциации
1. Составьте формулы указанных веществ. Для сильных электролитов составьте уравнения диссоциации.
Вариант I Хлорид алюминия, оксид магния, магний, серная кислота, нитрат железа(III), гидроксид меди(II), гидроксид калия, оксид кремния.
Вариант II Гидроксид натрия, хлорид железа(II), оксид азота(IV), азотная кислота, оксид железа(III), сульфат алюминия, гидроксид цинка, фосфат серебра.
2. Допишите уравнения реакций в молекулярном виде. Составьте ионные уравнения этих реакций.
Вариант I а) MgCl2 + NaOH  … ;
… ;
б) К2CO3 + HNO3  … ;
… ;
в) Ba(OH)2 + HCl  … .
… .
Вариант II а) NaOH + H2SO4  … ;
… ;
б) ZnSO4 + KOH  … ;
… ;
в) Na2CO3 + HCl  … .
… .
3. Растворы каких электролитов взяли для получения следующих веществ?
Вариант I а) MgCO3;
б) H2O.
Вариант II а) H2O;
б) Cu(OH)2.
Запишите соответствующие молекулярные и ионные уравнения.
4. Запишите молекулярные и ионные уравнения, соответствующие данным кратким ионным уравнениям.
Вариант I а) Zn2+ + 2OH– = Zn(OH)2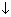 ;
;
б) S2– + 2H+ = H2S .
.
Вариант II а) 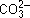 + 2H+= CO2
+ 2H+= CO2 + H2O;
+ H2O;
б) Ba2+ + 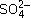 = BaSO4
= BaSO4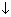 .
.
5. Какие из ионов не могут находиться в одном растворе? Почему? Ответ подтвердите ионными уравнениями.
Вариант I
Ba2+, Н+, Сl–, OH–, 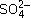 .
.
Вариант II
Н+, Сl–, OH–, Mg2+, 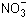 .
.

















