СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Рабочая тетрадь по химии с профессиональной направленностью
Просмотр содержимого документа
«Рабочая тетрадь по химии с профессиональной направленностью»
Министерство общего и профессионального образования Ростовской области
Государственное бюджетное профессиональное образовательное учреждение Ростовской области
образования Ростовской области
«Ростовский торгово-экономический колледж»
Рабочая тетрадь
для практических работ по дисциплине «Химия»
Преподаватель химии высшей квалификационной категории,
Член Всероссийской общественной организации учителей и преподавателей химии при МГУ имени М. В. Ломоносова
Юрий Григорьевич Мелкумян
Ростов-на-Дону
2025 г.
Пояснительная записка:
Рабочая тетрадь для практических работ по учебной дисциплине «Химия» с профессиональной направленностью.
Рабочая тетрадь предназначена для работы студентов I курса по выполнению практических работ. Содержит контрольные задания и методику выполнения практических работ, выполнение которых предусмотрено учебной программой дисциплины «Химия», разработанной в соответствии с «Рекомендациями по реализации образовательной программы среднего (полного) общего образования в образовательных учреждениях начального профессионального и среднего профессионального образования и составлена в соответствии с ФГОС СПО по специальности:
43.02.15 Поварское и кондитерское дело
Содержание
Техника безопасности при работе в лаборатории химии общие правила проведения работ ..............................................................................................4
Правила техники безопасности .......................................................................5 Правила противопожарной безопасности ......................................................7 Меры первой помощи при несчастных случаях ............................................8Практическая работа №1 Ознакомление со свойствами дисперсных систем …………………………………………........…..…………….….……9
Практическая работа №2 Приготовление раствора заданной концентрации. ……………………………………………………………….12
Практическая работа №3 Химические свойства кислот, оснований и солей. Гидролиз солей различного типа …………………………………17
Практическая работа №4 Решение экспериментальных задач на идентификацию неорганических соединений. ….………………….……20
Практическая работа №5 Факторы, влияющие на скорость химических реакций ………….………………………………………………...………..23
Практическая работа №6 Получение, собирание и распознавание газов. Решение экспериментальных задач………………………………..26
Практическая работа №7 Свойства соединений железа и хрома.........28
Практическая работа№8 Кислородсодержащие органические
соединения …………………………………………………………………30
Практическая работа №9 Химические свойства белков………………32
Практическая работа №10 Решение экспериментальных задач на идентификацию органических соединений. Распознавание пластмасс и волокон…………………………………………………………………..….35
Рекомендуемая литература ............................................................................42
Задания с профессиональной направленностью выделены знаком - *
Техника безопасности при работе в лаборатории химии общие правила проведения работ
Каждому студенту, работающему в лаборатории, предоставляется место, которое он должен содержать в порядке и чистоте. При выполнении работы не загромождайте рабочее место лишними предметами.
При выполнении лабораторных работ необходимо строго соблюдать следующие правила:
1. Перед занятиями студенту необходимо заранее познакомиться с ходом проведения опытов по учебному пособию, отчетливо уяснить цели и задачи работы, обдумывая каждое действие. Приступать к выполнению опытов можно только после того, как студент сдаст предварительный отчет (название, краткое описание хода опыта, реакции) и пройдет собеседование.
2. Работающий должен знать основные свойства используемых и получаемых веществ, их действие на организм, правила работы с ними и на основе этого принять все меры для безопасности проведения работ.
3. Запрещено проводить опыты в грязной посуде, а также пользоваться для проведения опытов веществами из склянок без этикеток или с неразборчивой надписью.
4. Нельзя выливать избыток реактива из пробирки обратно в реактивную склянку. Сухие соли набирают чистым шпателем или ложечкой.
5. Не следует путать пробки от разных склянок. Чтобы внутренняя сторона пробки оставалась чистой, пробку кладут на стол внешней поверхностью.
6. Нельзя уносить реактивы общего пользования на свое рабочее место.
7. После опытов остатки металлов в раковину не выбрасывают, а собирают в банку. Дорогостоящие реактивы (например, остатки солей серебра) собирают в специально отведенную посуду. Нельзя выливать в раковину остатки растворителей, горючих веществ, реакционные смеси, растворы кислот, щелочей и других вредных веществ. Они должны собираться в специальную посуду.
8. Запрещено засорять раковины и сливы в шкафах песком, бумагой, битой посудой и другими твердыми отходами, что приводит к выходу канализации из строя. Все твердые отходы следует выбрасывать в урну.
9. При выполнении работ бережно расходуйте реактивы, электричество и воду. Нельзя оставлять без надобности включенные электроприборы и горящие спиртовки. По окончании работ нужно немедленно отключить электроприборы и погасить спиртовки.
10. Выполнение лабораторной работы и каждого отдельного опыта требует строгого соблюдения всех указаний, содержащихся в описании работы. Опыт должен исполняться тщательно, аккуратно и без спешки.
11. Студентам категорически запрещается без разрешения преподавателя проводить какие-либо опыты, не относящиеся к данной работе, или изменять порядок проведения опыта. Следует помнить, что каждый, даже кажущийся внешне простым опыт может оказаться при необдуманном выполнении опасным.
12. Если работа не может быть закончена в течение одного занятия, то необходимо заранее обсудить с преподавателем, на каком этапе работа должна быть прервана и когда можно будет ее закончить.
13. Перед уходом из лаборатории рекомендуется тщательно мыть руки.
Правила техники безопасности1. В лаборатории категорически запрещается работать одному, т.к. даже небольшая незамеченная неисправность в оборудовании или ошибка в выполнении эксперимента может привести к тяжелым последствиям.
2. Избегайте лишних движений и разговоров в лаборатории.
3. Избегайте непосредственных контактов кожи, глаз и дыхательных путей с химическими реактивами. Кроме того, если у вас длинные волосы, их следует аккуратно прибрать, чтобы они не могли соприкасаться с нагревательными приборами, реактивами и т.д.
4. Все работы с ядовитыми и сильно пахнущими веществами, с концентрированными растворами кислот, щелочей, а также упаривание их растворов следует проводить только в вытяжном шкафу. Створки шкафа во время работы должны быть опущены до 18–20 см от его рабочей поверхности.
5. Измельчение твердых веществ, дающих едкую пыль (щелочей, извести, иода и др.), разбавление концентрированных кислот и щелочей, приготовление хромовой смеси и т.п. нужно проводить в фарфоровой посуде также в вытяжном шкафу, защитив глаза очками, а руки перчатками.
6. Разбавляя концентрированные кислоты, особенно серную, осторожно вливают кислоту в воду.
7. С легковоспламеняющимися жидкостями нельзя работать вблизи нагревательных приборов. Запрещается нагревать летучие легковоспламеняющиеся жидкости, вещества (эфиры, бензины, спирты, ацетон и т.д.) на открытом пламени. Для этого необходимо использовать водяную или масляную баню.
8. Обращение со спиртовкой. Перед использованием спиртовка должна быть заправлена этанолом (не более 2/3 объема спиртовки), диск плотно прикрывает отверстие резервуара спиртовки, фитиль в трубке должен входить не слишком плотно, но и не выпадать из трубки. Неиспользуемая спиртовка должна быть закрыта колпачком. Спиртовку зажигают только от горящей спички или лучинки. Нельзя зажигать ее от другой спиртовки или от зажигалки. Никогда не следует дуть на горящую спиртовку. Тушат ее, накрыв колпачком. Нагревание на спиртовке производят следующим образом: сначала прогревают пробирку с содержимым в течение 15–20 секунд, затем приступают непосредственно к нагреванию содержимого пробирки. При нагревании нельзя прикасаться дном пробирки к фитилю. На спиртовке можно нагревать только посуду из тонкого (химического) стекла.
9. Пробирки при нагревании закрепляют либо в штативной лапке, либо в пробиркодержателе ближе к отверстию. Отверстие пробирки необходимо направлять от себя и окружающих, во избежание выброса веществ из пробирки.
10. Знакомясь с запахом вещества, нельзя наклоняться над сосудом с жидкостью и вдыхать полной грудью. Для этого нужно направить рукой струю воздуха от отверстия сосуда к себе и сделать носом легкий вдох.
11. Запрещается набирать ртом при помощи пипетки или трубки любые вещества. Для этого следует пользоваться сифоном или резиновой грушей.
12. Особенно внимательно нужно проводить сборку установок из стекла. При этом нельзя зажимать стеклянные изделия в лапки штативов без соответствующей мягкой прокладки. Особенно осторожно обращайтесь с тонкостенной посудой, термометрами и холодильниками.
13. Нельзя нагревать любые закупоренные аппараты и сосуды, кроме тех, которые специально для этого предназначены. Нельзя нагревать жидкости в толстостенной и мерной посуде (она может лопнуть).
14. При приливании реактивов нельзя наклоняться над отверстием сосуда во избежание попадания брызг на лицо и одежду. При использовании пробиркодержателя необходимо зажимать пробирку ближе к открытому концу. Нельзя также наклоняться над нагреваемой жидкостью, так как ее может выбросить. Никогда не направляйте открытый конец пробирки к себе или в сторону вашего соседа.
15. В лаборатории запрещается пробовать на вкус реактивы, а также принимать пищу, пить и курить.
16. Щелочные металлы должны храниться под слоем керосина, толуола или ксилола, не содержащих следов воды. Нельзя работать с металлическим натрием поблизости от водопроводного крана. Приступая к работе, надо насухо вытереть стол и высушить посуду, в которой будет проводиться реакция с металлическим натрием. После окончания работы нельзя сразу мыть эту посуду водой, следует сначала уничтожить остатки натрия, растворяя их в спирте. Крупные остатки натрия или его обрезки следует поместить в отдельную банку с керосином (толуолом или ксилолом).
17. Категорически запрещается хранить бром в хрупкой посуде. Для этого применяют толстостенные склянки с притертыми пробками. Все работы с бромом следует проводить в хорошо вентилируемом вытяжном шкафу, в резиновых перчатках и защитных очках. При попадании брома на кожу необходимо немедленно протереть пораженный участок спиртом, а затем смазать глицерином.
18. Нельзя класть на лабораторные столы посторонние предметы (сумки, шапки и др.), а также вешать в лаборатории верхнюю одежду.
19. О любом происшествии в лаборатории, даже самом незначительном, необходимо сообщить преподавателю или лаборанту.
20. Не стесняйтесь спрашивать обо всем, в чем у вас есть сомнения!
Правила противопожарной безопасности1. Осторожно обращайтесь с нагревательными приборами. Запрещается работать с неисправным оборудованием и приборами. Категорически запрещается использовать для подключения электроприборы с оголенными проводами или с поврежденной изоляцией. При перегорании спирали электроплитки отключите плитку от электросети.
2. При проведении опытов, в которых может произойти самовозгорание, необходимо иметь под руками асбестовое одеяло, песок, совок и т.п.
3. В случае воспламенения горючих веществ быстро выключите вентиляцию вытяжного шкафа, погасите спиртовку, обесточьте электронагревательные приборы, уберите сосуды с огнеопасными веществами и тушите пожар: а) горящие жидкости прикройте асбестом, а затем, если нужно, засыпьте песком, но не заливайте водой;
б) загоревшийся фосфор гасите мокрым песком или водой;
в) в случае воспламенения щелочных металлов гасите пламя только сухим песком, но не водой;
г) в случае возгорания одежды на человеке необходимо накрыть его асбестовым одеялом;
д) небольшие локальные пожары тушить при помощи углекислотного огнетушителя; при большом задымлении использовать противогаз.
4. Во всех случаях пожара в лаборатории немедленно вызовите пожарную команду по городскому телефону «01» или 112 по мобильному телефону (за исключением воспламенения щелочных металлов), и, не ожидая прибытия пожарников, примите все меры к ликвидации пожара собственными силами и имеющимися средствами. Студенты должны покинуть лабораторию.
Меры первой помощи при несчастных случаяхВ лаборатории бывают случаи, требующие неотложной медицинской помощи – порезы рук стеклом, ожоги горячими предметами, кислотами, щелочами. Для оказания первой помощи в лаборатории имеется аптечка. В серьезных случаях необходимо пострадавшего сопроводить к врачу. Основные правила первой помощи сводятся к следующему:
1. При мелких порезах стеклом удалите осколки из раны, смойте кровь, продезинфицируйте раствором иода и перевяжите бинтом.
2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем в случае ожога щелочью − 1%-ным раствором уксусной кислотой, в случае ожога кислотой − 3%-ным раствором гидрокарбоната натрия, а затем опять водой. Одежду, соприкасавшуюся с реактивами, следует снять.
3. При ожоге горячей жидкостью или горячим предметом обожженное место промойте проточной холодной водой в течение 5–10 мин. Затем следует немедленно доставить в ближайшее лечебное учреждение.
4. При попадании химического вещества в глаза их необходимо обильно промыть в течение 10–15 мин. струей холодной воды (или используя глазную промывалку) так, чтобы она стекала от носа к виску. Веки пораженного глаза во время промывания должны быть осторожно развернуты. Контактные линзы перед промыванием следует снять. Затем в любом случае пострадавшего незамедлительно доставить в глазную клинику.
5. При попадании яда внутрь необходимо вызвать рвоту принятием теплого раствора поваренной соли (3–4 чайные ложки на стакан воды) и затем надавить пальцем на заднюю часть зева, давая пострадавшему пить большое количество теплой воды. Если пострадавший потерял сознание или же отравление вызвано проглатыванием растворителя, кислоты или щелочи, то рвоту вызывать нельзя. Пострадавшего перенести на свежий воздух и оставить в спокойном положении в тепле. Немедленно вызвать бригаду неотложной помощи.
6. При поражении электрическим током необходимо быстро освободить пострадавшего от действия тока путем отключения электроэнергии общим рубильником. Вынести пострадавшего на свежий воздух и при необходимости сделать ему искусственное дыхание и массаж сердца. Немедленно вызвать скорую помощь.
С правилами техники безопасности при проведении практических работ ознакомлен(а).
Обучающийся(аяся) 1 курса группы _______________ _________________________________________________(Ф.И.О.)
Дата ________________ Подпись ____________________
Практическая работа №1
Ознакомление со свойствами дисперсных систем.
Цель:
получить дисперсные системы и исследовать их свойства
практически познакомиться со свойствами различных видов дисперсных систем;
провести эксперимент, соблюдая правила техники безопасности.
Оборудование и реактивы:
дистиллированная вода;
вещества и растворы: карбонат кальция, масло, раствор глицерина, мука, желатин
фарфоровая чашка;
пробирки, штатив.
Правила безопасности при выполнении работы:
________________________________________________________________________________________________________________________________________
Дата ________________ Подпись ____________________
Теоретическая часть
Чистые вещества в природе встречаются очень редко, чаще всего встречаются смеси. Смеси разных веществ в различных агрегатных состояниях могут образовывать гомогенные(растворы) и гетерогенные(дисперсные ) системы.
Дисперсными- называют гетерогенные системы , в которых одно вещество - дисперсная фаза ( их может быть несколько) в виде очень мелких частиц равномерно распределено в объеме другого -дисперсионной среде.
Среда и фазы находятся в разных агрегатных состояниях – твердом, жидком и газообразном. По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся 2 группы :
Грубодисперсные (взвеси) с размерами частиц более 100 нм. Это непрозрачные системы, в которых фаза и среда легко разделяются отстаиванием или фильтрованием. Это- эмульсии , суспензии , аэрозоли.
Тонкодисперсные- с размерами частиц от 100 до 1 нм . Фаза и среда в таких системах отстаиванием разделяются с трудом. Это : золи (коллоидные растворы- "клееподобные" ) и гели (студни).
|
|
| |
| Коагуляция – явление слипания коллоидных частиц и выпадения их в осадок . При этом коллоидный раствор превращается в суспензию или гель. Гели или студни представляют собой студенистые осадки, образующиеся при коагуляции золей. Со временем структура гелей нарушается (отслаивается) – из них выделяется вода. Это явление синерезиса Г+Ж→аэрозоль (туман, облака, карбюраторная смесь бензина с воздухом в ДВС Г+ТВ→аэрозоль(дым, смог, пыль в воздухе) Ж+Г→пена (газированные напитки, взбитые сливки) Ж+Ж→эмульсия (молоко, майонез, плазма крови, лимфа, цитоплазма) Ж+ТВ→золь, суспензия (речной и морской ил, строительные растворы, пасты) ТВ+Г→твердая пена(керамика, пенопласт, поролон, полиуретан, пористый шоколад) ТВ+Ж→гель(желе, желатин, косметические и медицинские мази, помада) ТВ+ТВ→твердый золь (горные породы, цветные стекла)
|
| |
Ход работы:
Дисперсные системы являются одной из основных частей пищевой промышленности. Они представляют собой комбинацию двух или более составляющих, где один компонент равномерно распределен в другом. Например, жиры могут быть дисперсированы в воде для создания молочных продуктов. Такие системы могут быть жидкими, полужидкими или твердыми веществами. Дисперсные системы позволяют создавать различные продукты с улучшенными вкусом, текстурой и структурой.
* Опыт №1 Приготовление суспензии растительного масла и желтка (майонез).
В стеклянную пробирку влить 4-5мл яичного желтка и всыпать 1-2 ложечки растительного масла. Пробирку закрыть резиновой пробкой и встряхивать до появления однородной массы.
Наблюдения:
*Внешний вид и видимость частиц: __________________________________
__________________________________________________________________
*Способность осаждаться и способность к коагуляции:_________________
__________________________________________________________________
* Опыт №2 Приготовление эмульсии масла в воде и изучение ее свойств
В стеклянную пробирку влить 4-5мл воды и 1-2 мл масла, закрыть резиновой пробкой и встряхнуть несколько раз. Изучить свойства эмульсии. Добавить 2-3 капли глицерина.
Наблюдения:
*Внешний вид и видимость частиц: __________________________________
__________________________________________________________________
*Способность осаждаться и способность к коагуляции:_________________
__________________________________________________________________
*Внешний вид после добавления глицерина:_____________________________
__________________________________________________________________
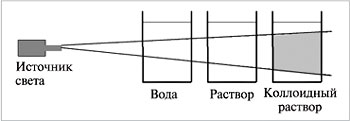
* Опыт №3 Приготовление коллоидного раствора и изучение его свойств
В стеклянный стакан с горячей водой внести 1-2 ложечки муки (или желатина), тщательно перемешать. Пропустить через раствор луч света фонарика на фоне темной бумаги
Наблюдения:
*Внешний вид и видимость частиц: __________________________________
__________________________________________________________________
*Способность осаждаться и способность к коагуляции:_________________
__________________________________________________________________
*Наблюдается ли эффект Тиндаля: ___________________________________
__________________________________________________________________
Контрольные вопросы
Что называют дисперсной системой
Из скольки фаз состоят дисперсные системы
Классификация дисперсных систем
В чём состоит эффект Тиндаля
В чём заключается явление коагуляции
Что такое суспензия
Что такое эмульсия
Привести примеры дисперсных систем с газообразной дисперсионной средой
Привести примеры дисперсных систем с жидкой дисперсной средой
Привести примеры дисперсных систем с твёрдой дисперсной средой
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Общий вывод: ________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____90_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Практическая работа №2
Приготовление раствора заданной концентрации.
Цель:
приготовить растворы солей определенной концентрации.
научиться готовить раствор заданной концентрации, используя весы и мерную посуду.
Оборудование:
стеклянная лопаточка;
стакан объемом 50 мл;
стеклянная палочка с резиновым наконечником;
мерный цилиндр;
весы;
холодная кипяченая вода.
соли.
Правила безопасности при выполнении работы:
________________________________________________________________________________________________________________________________________
Дата ________________ Подпись ____________________
Теоретическая часть
Раствор- это однородная система , состоящая из растворителя ,растворенных веществ и продуктов их взаимодействия. Растворителем чаще всего является то вещество, которое в чистом виде имеет тоже агрегатное состояние, что и раствор, либо присутствует в избытке.
По агрегатному состоянию различают растворы: жидкие, твердые, газообразные. По соотношению растворителя и растворенного вещества : разбавленные, концентрированные , насыщенные, ненасыщенные , перенасыщенные. Состав раствора обычно передается содержанием в нем растворимого вещества в виде массовой доли, процентной концентраций и молярности.
Массовая доля (безразмерная величина) – это отношение массы растворенного вещества к массе всего раствора:
(учебник О.С.Габриелян, И.Г.Остроумов Химия, М. «Академия» 2013, с 57)
Процентная концентрация ( %) – это величина показывающая сколько грамм растворенного вещества cодержится в 100 гр. раствора :
(учебник О.С.Габриелян, И.Г.Остроумов Химия, М. «Академия» 2013, с 57)
где ω – массовая доля растворенного вещества, выраженная в долях единицы;
m (вещества) – масса растворенного вещества, г;
m (раствора) – масса раствора , г.
m (раствора) = m (вещества) + m (Н2О) (или др. растворитель).
Используя процентной концентрации, можно определить m(вещества) и m (раствора):
Используя объём раствора (V) и плотность раствора (р), можно вычислить m(раствора)
m (раствора) = V p; Плотность воды (Н2О) = 1 г/мл.
Три способа изменения массовой доли (концентрации раствора):
1. Добавление растворителя, при этом увеличивается масса раствора, а масса вещества не изменяется.
В этом случае необходимо сначала рассчитать массу вещества в растворе 1 по формуле:
Затем рассчитать:
m (раствора 2) = m (раствора 1) + m (H2O).
Массовую долю растворенного вещества находим по формуле:
2. Упаривание раствора уменьшает массу раствора, а масса вещества не изменяется.
В этом случае необходимо сначала рассчитать массу вещества в 1 растворе по формуле:
Затем рассчитать:
m (раствора 2) = m (раствора 1) – m (H2O)
Рассчитываем массовую долю вещества во втором растворе.
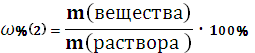
3. Добавление растворенного вещества, при этом увеличивается масса раствора и масса вещества, а масса растворителя не изменяется.
В этом случае необходимо сначала рассчитать массу вещества в 1 растворе по формуле:
Затем рассчитать:
m (раствора 2) = m (раствора 1) + m (вещества2)
m (вещества 2) = m (вещества 1) + m (вещества добавленного)
Массовую долю растворённого вещества находим по формуле:
Ход работы:
1. Приготовление раствора соли с определенной массовой долей вещества.
Задача: определите, какую массу соли и воды потребуется взять для приготовления определенной массы водного раствора поваренной соли с заданной массовой долей соли.
| Вариант | m (раствора) | ω (%) | Вариант | m (раствора) | ω (%) |
| 1 | 20 | 10 | 14 | 45 | 25 |
| 2 | 50 | 15 | 15 | 15 | 20 |
| 3 | 45 | 5 | 16 | 25 | 16 |
| 4 | 60 | 25 | 17 | 30 | 15 |
| 5 | 35 | 20 | 18 | 90 | 13 |
| 6 | 40 | 30 | 19 | 85 | 70 |
| 7 | 30 | 18 | 20 | 95 | 48 |
| 8 | 25 | 12 | 21 | 40 | 32 |
| 9 | 70 | 8 | 22 | 55 | 63 |
| 10 | 100 | 9 | 23 | 65 | 22 |
| 11 | 55 | 6 | 24 | 70 | 25 |
| 12 | 60 | 40 | 25 | 55 | 27 |
| 13 | 75 | 30 |
|
|
|
Произведите расчеты, воспользовавшись данными таблицы:
| Дано:
Найти: | Решение: |
|
|
Приготовьте раствор. Для этого:
Отвесьте соль и поместите ее в стакан.
Отмерьте измерительным цилиндром необходимый объем воды и вылейте в колбу с навеской соли.
Внимание! При отмеривании жидкости глаз наблюдателя должен находиться в одной плоскости с уровнем жидкости. Уровень жидкости прозрачных растворов устанавливают по нижнему мениску.
2. Разбавление раствора.
Задача: Вами был приготовлен раствор определенной концентрации. К этому раствору добавьте 50мл. воды и рассчитайте, какова массовая доля полученного раствора (2).
Произведите расчеты:
| Дано:
Найти: | Решение: |
|
|
Приготовьте раствор.
Дайте ответы на контрольные вопросы:
Что называется растворами?
Что такое массовая доля растворенного вещества?
По какой формуле можно рассчитать массовую долю вещества?
Как изменится масса растворителя и масса вещества при разбавлении и упаривании раствора?
На дачном участке семья собрала хороший урожай овощей. Для заготовки на зиму мама решила засолить огурцы. Для этого она попросила приготовить раствор для засолки огурцов. Рассчитайте массу соли и воды, которая потребуется для приготовления 1000 граммов 7 % раствора поваренной соли. Напишите формулу поваренной соли.
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____90_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Практическая работа №3
Химические свойства кислот, оснований и солей. Гидролиз солей различного типа.
Цель работы:
изучить свойства сложных неорганических веществ
Приборы и реактивы:
пробирки, штативы.
Растворы: HCl, NaOH, K2CO3, CH3COOH, CaO, Fe(OH)3, H2SO4, BaCl2, KOH, Ca(OH)2, Mg(OH)2, CuSO4, FeCl3, K2S, K3PO4, CaCl2, Na3PO4,
гранулы цинка,
индикаторы.
Правила безопасности при выполнении работы:
________________________________________________________________________________________________________________________________________
Дата ________________ Подпись ____________________
Теоретическая часть
Гидролиз –это процесс взаимодействия ионов соли с водой , приводящий к образованию слабого электролита . Все соли можно разделить на 4 группы:
Соль образована сильным основанием и сильной кислотой К2 SО4, Na NO3,)– гидролиз не идет , среда нейтральная рН = 7 .
Соль образована слабым основанием и слабой кислотой (MgСО3, Al 2S3, Zn(NO2)2) - гидролиз протекает практически в нейтральной среде рН ближе к 7 , гидролиз идет по катиону и аниону:
Соль образована сильным основанием и слабой кислотой (например : Na2СО3, К2S, Ва(NO2)2, СН3СОО Li ) -гидролиз протекает в щелочной среде рН 7 , гидролиз идет по аниону.
Соль образована слабым основанием и сильной кислотой (MgSО4, AlCL3, Zn(NO3)2, ..) - гидролиз протекает в кислой среде рН
Глубина гидролиза зависит от температуры (чаще всего ее приходится повышать) и концентрации раствора (при разбавлении раствора гидролиз усиливается)
Если продукты гидролиза летучи ,или нерастворимы , то он необратим.
Ход работы
Опыт 1. Испытание растворов индикаторами
В одну пробирку налейте 3-4 мл соляной кислоты, во вторую – столько же раствора гидроксида натрия, в третью – карбоната калия. При помощи кислотно-основных индикаторов определите состав каждой пробирки.
Наблюдения:
1 пробирка _________________ Цвет индикатора____________________
2 пробирка _________________ Цвет индикатора____________________
3 пробирка _________________ Цвет индикатора____________________
Опыт 2. Взаимодействие кислот с металлами.
Поместите в пробирку немного цинковых стружек, прилейте к ним соляной кислоты и нагрейте.
Наблюдается _____________________________________________________
Напишите уравнение реакции в молекулярном и ионном виде:
_______________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Взаимодействие кислот с оксидами металлов.
В пробирку поместить оксид железа (II), прибавить небольшое количество соляной кислоты.
Наблюдается _____________________________________________________
Напишите уравнение реакции в молекулярном и ионном виде:
_______________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Взаимодействие кислот с солями.
В пробирку прилить 1 мл раствора серной кислоты, к которой прилить по каплям хлорид бария.
Наблюдается _____________________________________________________
Напишите уравнение реакции в молекулярном и ионном виде:
_______________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 5. Взаимодействие щелочей с солями и кислот с основаниями.
В чистую пробирку поместить 1 мл раствора хлорида железа (III) и прилить столько же гидроксида натрия.
Наблюдается ____________________________________________________
Добавить к осадку небольшое количество раствора соляной кислоты до растворения его.
Напишите уравнение реакции обоих взаимодействий в молекулярном и ионном виде:
_______________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 6. Разложение нерастворимых оснований.
В пробирку поместить небольшое количество гидроксида магния и осторожно нагревать.
Наблюдается _________________________________________________________
Напишите уравнение реакции в молекулярном виде:
_____________________________________________________________________
Опыт 7. Взаимодействие солей с металлами.
Внесите гранулу цинка в пробирку с раствором сульфата меди (II).
Наблюдается _________________________________________________________
Напишите уравнение реакции в молекулярном виде:
_____________________________________________________________________
Опыт 8. Взаимодействие солей друг с другом.
В пробирку поместить 1мл раствора фосфата натрия и прилить столько же раствора хлорида кальция.
Наблюдается _________________________________________________________
Напишите уравнение реакции в молекулярном и ионном виде:
_______________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 8. Гидролиз солей различного типа.
В пробирки поместить по 0,5 мл раствора сульфида калия и сульфата калия затем добавить в каждую по 1 капле фенолфталеина.
Наблюдения:
1 пробирка _________________ Цвет индикатора____________________
2 пробирка _________________ Цвет индикатора____________________
Объясните изменение окраски фенолфталеина ________________________________________________________________
________________________________________________________________
Напишите уравнение реакции.
_______________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________
В пробирку поместить 0,5 мл раствора хлорида цинка и добавить 1 каплю метилоранжа.
Наблюдения: Цвет индикатора____________________
Объясните изменение окраски метилоранжа _____________________________________________________________________
_____________________________________________________________________
Общий вывод:__________________________________________________________
______________________________________________________________________________________________________________________________________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____90_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Лабораторная работа№4
Решение экспериментальных задач на идентификацию неорганических соединений.
Цель работы: научиться выполнять экспериментальные задачи.
Оборудование и реактивы:
| Штатив с пробирками Держатель для пробирок Спиртовка. хлорид бария BaCl2; серная кислота H2SO4 нитрат серебра AgNO3. | сульфат меди CuSO4; гидроксид натрия NaOH; алюминий (Al); хлорид алюминия (AlCl3); соляная кислота (HCl). сульфат железа (FeSO4); |
Правила безопасности при выполнении работы:
________________________________________________________________________________________________________________________________________
Дата ________________ Подпись ____________________
Краткие теоретические сведения
Для проведения химических реакций в исследуемый раствор вводится те или иные реактивы, образующие с определённым ионом характерный продукт взаимодействия. Такие реакции называются характерными реакциями данного иона. В химии используют реакции, в которых получают характерные осадки. Например, хлорид ион с ионом серебра образуют белый творожный осадок хлорида серебра.
AgNO3 + HCl AgCl + HNO3
Таблица для определения иона
| Определяемый ион | Ион, используемый для определения | Результаты качественной реакции |
| H+ | Индикаторы | Изменение окраски |
| Ag+ | Cl- | Белый осадок |
| Cu2+ | OH- | Голубой осадок |
| Cu2+ | S2- | Чёрный осадок |
| Fe2+ | OH- | Зеленоватый осадок, который с течением времени буреет |
| Fe3+ | OH- | Осадок бурого цвета |
| Al3+ | OH- | Белый желеобразный осадок, который при избытке OH- растворяется |
| Ba2+ | SO42- | Белый осадок, окрашивание пламени в жёлто-зелёный цвет |
| Cl- | Ag+ | Белый осадок |
| SO42- | Ba2+ | Белый осадок |
Гидроксид алюминия обладает амфотерными свойствами. Подобно всем основаниям, гидроксид алюминия реагирует с кислотами.
При сплавлении гидроксида алюминия со щелочами образуется метаалюминаты, а в воде гидраты метаалюминатов.
Al(OH)3+3HCl AlCl3+H2O
Al(OH)3+NaOH NaAlO2+2H2O
Al(OH)3+NaOHизб Na[Al(OH)4]
Катионы железа (II) Fe2+ легко окисляются кислородом воздуха и другими окислителями. Поэтому белый осадок гидроксида железа (II) Fe(OH)2 на воздухе сначала принимает зелёную окраску, а затем становится бурым, постепенно превращаясь в гидроксид железа (III) Fe(OH)3.
4Fe(OH)2+H2O+O2=4Fe(OH)3
Практически все продукты питания в своем составе содержат ионы тех или иных химических элементов, существуют требования к предельно-допустимым нормам содержания ионов в овощах, фруктах, мясе и т. д., в вашей будущей профессиональной деятельности вы столкнетесь с этими нормами, а в данной работе научитесь их определять!!!
Ход работы.
* Опыт 1. Обнаружение хлорид ионов Cl- и ионов бария Ba2+
В 2 пробирки налейте по 1-2 мл хлорида бария BaCl2. Затем, с помощью таблицы найти ион, который используют для определения иона Ba2+ и иона Cl-. В первую пробирку прилейте реактив, с помощью которого будете определять ион Ba2+. Во вторую пробирку прилейте реактив, с помощью которого будете определять ион Cl-.
Наблюдения:
1 пробирка ____________________________________________
2 пробирка ____________________________________________
Напишите уравнение реакции обоих взаимодействий в молекулярном и ионном виде:
_______________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________
* Опыт 2. Обнаружение ионов Cu2+ и SO42-.
С помощью характерных реакций докажите, что выданное вам вещество сульфат меди. для этого в 2 пробирки прилейте по 1 мл сульфата меди. В первую пробирку прилейте реактив, с помощью которого будете определять ион меди. Во вторую пробирку прилейте реактив, с помощью которого будете определять сульфат-ион.
Наблюдения:
1 пробирка ____________________________________________
2 пробирка ____________________________________________
Напишите уравнение реакции обоих взаимодействий в молекулярном и ионном виде:
_______________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Получение гидроксида алюминия и изучение его свойств.
Налейте в пробирку 5-6 мл раствора хлорида алюминия и добавьте к нему по каплям раствор гидроксида натрия, до образования светло-серого осадка Al(OH)3. Полученный осадок разделите на 2 части, разлив в 2 пробирки. В одну пробирку с полученным осадком гидроксида алюминия прилейте немного соляной кислоты. Осадок растворяется. В другую пробирку с полученным осадком гидроксида алюминия прилейте немного гидрокида натрия. Осадок растворяется.
Напишите уравнение реакции в молекулярном и ионном виде:
_______________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Практическое осуществление превращений.
С помощью имеющихся реактивов практически осуществите следующие превращения
Al Al2(SO4)3 Al(OH)3 NaAlO2
Составьте соответствующие уравнения реакций, запишите наблюдения.
_______________________________________________________________________________________________________________________________________________________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________
Общий вывод:_________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____90_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Практическая работа №5
Факторы влияющие на скорость химической реакции.
Цель работы:
изучить факторы, влияющие на скорость химических реакций.
Приборы и реактивы:
растворы: медного купороса (CuSO4 · 5 H2O), BaCl2, H2SO4, NaOH, HCl, NaHCO3 (хлебная сода), скрепка или кнопка, фенолфталеин, раствор азотной кислоты; раствор уксусной кислоты; раствор карбоната натрия; раствор нитрата серебра, раствор медного купороса, CuO (II) (порошок);
пробирки, пипетки, спиртовка, штатив
Правила безопасности при выполнении работы:
_________________________________________________________________________________________________________________________________________
Дата ________________ Подпись ____________________
Краткие теоретические сведения
Скорость химической реакции - это изменение концентрации прореагировавшего или образующегося вещества в единицу времени.
Концентрация вещества часто определяется как число молей в литре.
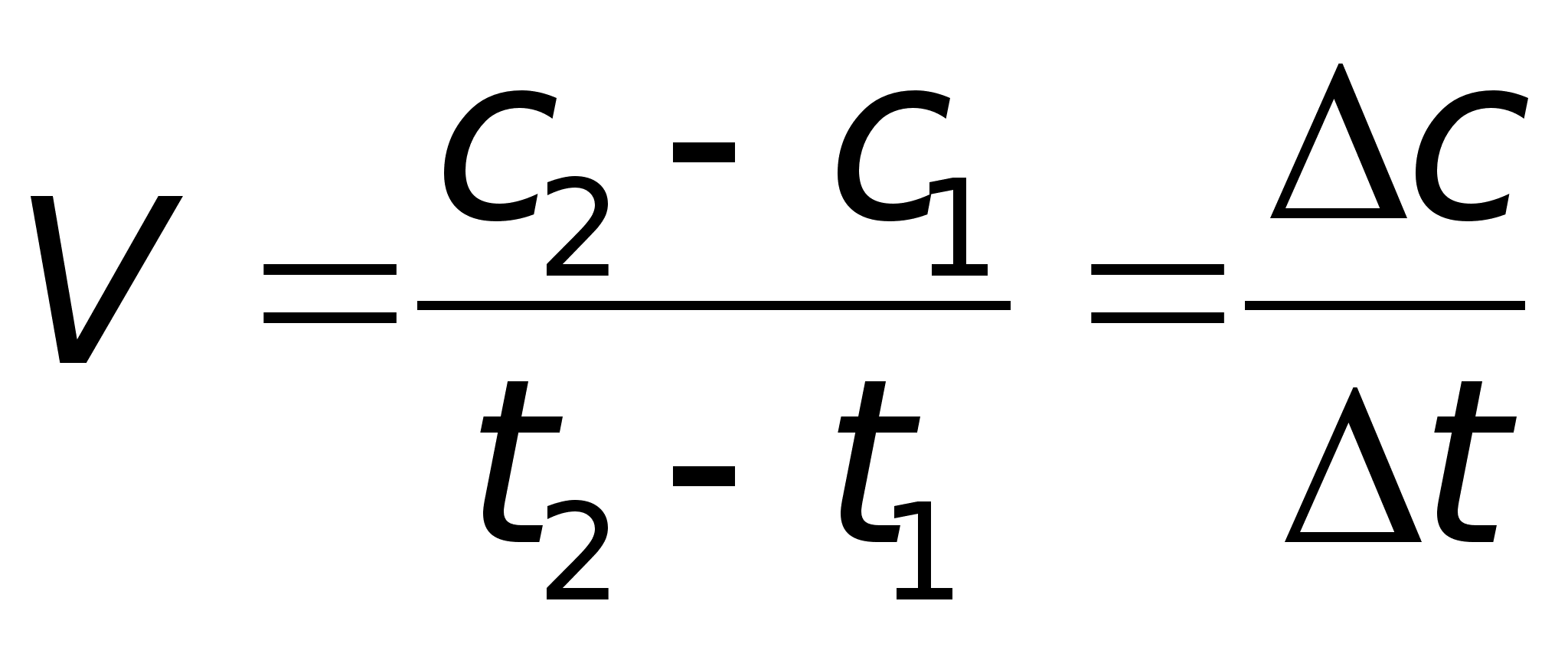
С1-первоначальная концентрация
С2-концентрация через некоторое время
Факторы, влияющие на скорость химических реакций:
природа реагирующих веществ;
концентрация реагирующих вещества;
площадь соприкосновения реагирующих веществ;
температура;
катализатор.
Ход работы
Опыт 1. Зависимость скорости взаимодействия цинка с соляной кислотой от ее концентрации.
В две пробирки поместите по одной грануле цинка. В одну прилейте 1 мл соляной кислоты (1:3), в другую – столько же этой кислоты другой концентрации (1:10).
Укажите, в какой из пробирок реакция протекает более интенсивно. _____________________________________________________________________
Запишите уравнение реакции в молекулярном и ионном виде.
__________________________________________________________________________________________________________________________________________
__________________________________________________________________________________________________________________________________________
Опыт 2. Зависимость скорости взаимодействия соляной кислоты с металлами от их природы.
В 3 пробирки (подписанные, под номерами) прилить по 3 мл раствора НCl и внести в каждую из пробирок навески опилок одинаковой массы: в первую - Mg, во вторую - Zn, в третью – Fe.
В какой пробирке реакция протекает быстрее? (или вообще не протекает)?
_____________________________________________________________________
Напишите уравнения реакций. Какой фактор влияет на скорость реакции? _______________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Зависимость скорости взаимодействия оксида меди с серной кислотой от температуры.
В 3 пробирки (под номерами) налить по 3 мл раствора Н2SO4 (одинаковой концентрации). В каждую поместить навеску CuO (II) (порошок). Первую пробирку оставить в штативе; вторую - опустить в стакан с горячей водой; третью - нагреть в пламени спиртовки.
В какой пробирке цвет раствора меняется быстрее (голубой цвет)? _____________________________________________________________________
Что влияет на интенсивность реакции?_________________________________
Напишите уравнение реакции.
_______________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 4. Зависимость скорости взаимодействия соляной кислоты с цинком от степени измельчения цинка
В две пробирки прилейте по 1 мл соляной кислоты поместите в одной гранулу цинка, а в другую порошок цинка.
Укажите, в какой из пробирок реакция протекает более интенсивно. _____________________________________________________________________
Запишите уравнение реакции в молекулярном виде. Рассмотрите ее с точки зрения ОВР.
_____________________________________________________________________
__________________________________________________________________________________________________________________________________________
Общий вывод:_________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________ Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____90_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Практическая работа №6
Получение, собирание и распознавание газов. Решение экспериментальных задач.
Цель: получит экспериментально некоторые газы.
Оборудование:
гранулы цинка,
соляная кислота,
пероксид волорода
оксид марганца (IV)
кусочек мрамора
уксусная кислота
известковая вода
лучина
хлорид аммония
щелочь
Теоретическая часть
Углекислый газ или оксид углерода (IV) СО2 – бесцветный, не имеющий запах газ.
Он примерно в полтора раза тяжелее воздуха. Растворим в воде.
Водород (Н2) – самый легкий, бесцветный газ, не имеет запаха.
Кислород (О2) - без запаха и цвета, тяжелее воздуха, мало растворим в воде.
Аммиак (NН3) имеет резкий характерный запах, без цвета, хорошо растворим в воде, легче воздуха.
Правила безопасности при выполнении работы:
__________________________________________________________________________________________________________________________________________
Дата ________________ Подпись ____________________
Ход работы:
Опыт 1. Получение, собирание и распознавание водорода.
1. В пробирку поместить две гранулы цинка.
2. Прилить 2 мл раствора соляной кислоты.
Наблюдается _________________________________________________________
Составьте уравнение реакции и рассмотрите его с точки зрения ОВР, укажите окислитель и восстановитель. _______________________________________________________________________
_______________________________________________________________________
_______________________________________________________________________
3. Накрыть пробирку-реактор пробиркой большего диаметра.
4. Через 1 – 2 минуты поднимите большую пробирку и, не переворачивая, поднесите её к пламени спиртовки.
Наблюдается _________________________________________________________
Почему водород собирают в пробирку перевернутую вверх дном?
_______________________________________________________________________
_______________________________________________________________________
* Опыт 2. Получение, собирание и распознавание кислорода
Кислород в пищевой промышленности классифицируют как добавку Е948 - применяется как упаковочный газ в процессе упаковки свежих продуктов.
1. В пробирку прилить 5 мл раствора пероксида водорода.
2. Подготовьте тлеющую лучину (подожгите ее и, когда она загорится, взмахами руки погасите).
3. Добавьте в пробирку несколько крупинок оксида марганца (IV).
Что наблюдаете при добавлении оксида марганца? Какую роль в данной реакции выплоняет оксид марганца? ______________________________________________
_______________________________________________________________________
4. Внесите тлеющую лучину в пробирку с раствором пероксида водорода.
Что наблюдаете после внесения тлеющей лучины? _______________________________________________________________________
Составьте уравнение реакции и рассмотрите его с точки зрения ОВР, укажите окислитель и восстановитель. ___________________________________________
______________________________________________________________________
______________________________________________________________________
* Опыт3. Получение, собирание и распознавание углекислого газа
Углекислый газ, пищевая маркировка — Е290 в пищевом производстве используется в роли разрыхлителя, при консервировании продуктов питания и в процессе газирования.
1. В пробирку поместить кусочек мрамора.
2. Прилить к мрамору 4 мл раствора уксусной кислоты.
Наблюдается _________________________________________________________
Запишите уравнение реакции в молекулярном и ионном виде.
____________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Приготовьте тлеющую лучину.
4. Внесите тлеющую лучину в пробирку-реактор.
Наблюдается _________________________________________________________
5. В пробирку налейте 2 мл раствора известковой воды.
6. Используя чистую стеклянную трубку, осторожно продувайте через неё выдыхаемый воздух
Наблюдается _________________________________________________________
Запишите уравнение реакции в молекулярном и ионном виде.
____________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт4. Получение, собирание и распознавание аммиака.
1. В пробирку прилейте 1-2 мл хлорида аммония.
2. Прилейте 1 – 2 мл щелочи.
3. Закрепите пробирку в держателе и осторожно нагрейте в пламени спиртовки.
Наблюдается _________________________________________________________
Запишите уравнение реакции в молекулярном и ионном виде.
____________________________________________________________________________________________________________________________________________________________________________________________________________________
4. Поднесите к отверстию пробирки влажную красную лакмусовую бумажку.
Наблюдается _________________________________________________________
Осторожно понюхайте выделяющийся газ. Что ощущаете?
Наблюдается _________________________________________________________
Общий вывод:__________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____90_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Практическая работа №7
Свойства соединений железа и хрома
Цель работы: на практике изучить свойства соединений железа и хрома
Оборудование и реактивы: растворы солей железа (ɪɪ) и (ɪɪɪ), растворы солей хрома, кислот, щелочей, перманганата калия, пробирки.
Правила безопасности при выполнении работы:
________________________________________________________________________________________________________________________________________Дата ________________ Подпись ____________________
Ход работы
Опыт1. Взаимодействие железа с кислотами.
В одну пробирку налейте 2 мл 20%-го раствора соляной кислоты,
в другую — серной кислоты той же концентрации,
в третью — концентрированного раствора азотной кислоты,
в четвертую концентрированного раствора серной кислоты. Опустите в каждую из пробирок по канцелярской кнопке.
Наблюдается _________________________________________________________
_______________________________________________________________________
Запишите уравнение реакции в молекулярном и ионном виде.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
Почему в двух последних случаях не происходит химической реакции?
_______________________________________________________________________
_______________________________________________________________________
Опыт 2. Получение гидроксида железа(П) и взаимодействие его с кислотами.
Налейте в пробирку 2 — 3 мл свежеприготовленного раствора сульфата железа (П) и добавьте в нее немного раствора гидроксида натрия.
Что наблюдаете в начале реакции_________________________________________
______________________________________________________________________
и через 2 — 3 мин после начала реакции? _________________________________
______________________________________________________________________
Запишите уравнение реакции в молекулярном и ионном виде.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
К полученному осадку, добавьте раствор соляной кислоты.
Запишите уравнение реакции в молекулярном и ионном виде.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
Опыт 3. Получение гидроксида хрома(Ш) и исследование его свойств
В две чистые пробирки прилейте по 2 мл раствора сульфата хрома(Ш) и с помощью пипетки добавьте по 5 —6 капель раствора щелочи.
Наблюдается _________________________________________________________
_______________________________________________________________________
Запишите уравнение реакции в молекулярном и ионном виде.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
В первую пробирку добавьте избыток раствора щелочи, а во вторую прилейте раствор соляной кислоты.
Наблюдается _________________________________________________________
Запишите уравнение реакции в молекулярном виде.
______________________________________________________________________________________________________________________________________________
Общий вывод:_________________________________________________________
_____________________________________________________________________________________________________________________________________________________________________________________________________________________ Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____90_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Практическая работа №8
Кислородсодержащие органические соединения.
Цель работы:
изучить свойства глицерина, уксусной кислоты, жидкого жира, глюкозы, сахарозы и крахмала.
Приборы и реактивы:
штативы, пробирки, пробиркодержатель, спиртовки.
Растворы веществ: глицерин, гидроксид натрия, раствор сульфата меди (II), подсолнечное масло, твердый животный жир, бромная вода, глюкоза, крахмальный клейстер.
Правила безопасности при выполнении работы:
___________________________________________________________________________________________________________________________________
Дата ________________ Подпись ____________________
Ход работы:
* Опыт 1.Растворение глицерина в воде и взаимодействие с гидроксидом меди (II)
В пищевых продуктах и напитках глицерин служит в качестве увлажнителя, растворителя и подсластителя, применяют его как заменитель жира для низкокалорийных продуктов, заменителя сахара, обозначен как Е422.
Налейте в пробирку 1 см3 глицерина, добавьте столько же воды и встряхните. Затем добавьте в 2-3 раза больше воды. Перемешайте содержимое пробирки.
Сделайте вывод о растворимости глицерина в воде. __________________________
_______________________________________________________________________
В другую пробирку налейте 1-2 см3 раствора сульфата меди (II) и добавьте несколько капель раствора гидроксида натрия.
Запишите уравнение реакции в молекулярном и ионном виде.
_____________________________________________________________________________________________________________________________________________________________________________________________________________________
К образовавшемуся осадку добавьте немного глицерина и перемешайте смесь стеклянной палочкой.
Отметьте, какие изменения произошли. ___________________________________
_______________________________________________________________________
* Опыт2.Свойства уксусной кислоты, общие со свойствами минеральных кислот
Разбавьте уксусную кислоту наполовину водой и разлейте в четыре пробирки. В первую пробирку внесите 1-2 капли раствора лакмуса, затем по каплям добавьте раствор щелочи.
Отметьте изменение цвета индикатора в 1-ой пробирке до и после добавления щелочи: ________________________________________________________________
_______________________________________________________________________
Во вторую пробирку добавьте немного порошка магния, в третью — оксида меди (П), а в четвертую — карбоната натрия.
Запишите уравнение реакции в молекулярном и ионном виде.
1пробирка: _____________________________________________________________
______________________________________________________________________________________________________________________________________________
2пробирка: _____________________________________________________________
______________________________________________________________________________________________________________________________________________
3пробирка: _____________________________________________________________
______________________________________________________________________________________________________________________________________________
4пробирка: _____________________________________________________________
______________________________________________________________________________________________________________________________________________
Опыт 3. Доказательства непредельного характера жидкого жира
В одну пробирку налейте 1-2 см3 подсолнечного масла, во вторую поместите кусочек твердого животного жира и нагрейте ее до расплавления жира. К содержимому каждой пробирки добавьте немного бромной воды и встряхните смеси.
Отметьте, в какой из пробирок бромная вода обесцветилась. О чем это свидетельствует? _______________________________________________________
_______________________________________________________________________
Составьте уравнение реакции. __________________________________________
_______________________________________________________________________
* Опыт 4.Взаимодействие глюкозы с гидроксидом меди (II)
Глюкоза ферментированная является продуктом природного происхождения и не содержит в составе компонентов с кодом «Е», что позволяет сохранить этикетку «чистой» и вынести на неё надпись «Без консервантов». Добавки являются полностью безопасными, поскольку не содержат токсинов и канцерогенов. Альтернатива известным химическим консервантам: сорбату, бензоату, пропионатам и другим.
Налейте в пробирку 2 см3 раствора гидроксида натрия и прибавьте не более трех капель раствора сульфата меди (II). К свежеприготовленному гидроксиду меди (II) добавьте 1 см3 раствора глюкозы. Встряхните смесь.
Нагрейте содержимое пробирки.
Что вы наблюдаете? _________________________________________________
Что доказывает данный опыт? _________________________________________
______________________________________________________________________
Какие соединения вступают в аналогичную реакцию? ______________________________________________________________________
______________________________________________________________________
Какие вещества при нагревании с гидроксидом меди (II) ведут себя аналогичным образом? _____________________________________________________________
Составьте уравнение реакции глюкозы с гидроксидом меди (II) при нагревании.
______________________________________________________________________
______________________________________________________________________
____________________________________________________________________* Опыт 5.Качественная реакция на крахмал
В кулинарном и кондитерском деле применяют чаще всего картофельный, пшеничный и кукурузный крахмал. Используется для загущения киселей, фруктовых каш (кисель, в котором сок заваривается вместе с фруктами), а также как добавка в лапшу (треть или четверть по отношению к пшеничной муке), кондитерские изделия – печенье, торты, рахат-лукум.
К 0,5-1 см3 крахмального клейстера в пробирке добавьте каплю спиртового раствора йода.
Наблюдается _________________________________________________________
Нагрейте полученную смесь крахмального клейстера с
йодом.
Наблюдается _________________________________________________________
Нанесите несколько капель спиртового раствора йода на кусочек хлеба и на срез клубня картофеля.
Наблюдается _________________________________________________________
_______________________________________________________________________
Общий вывод:_________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____90_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Практическая работа №9
Химические свойства белков
Существует множество различных видов белков, которые могут использоваться в пищевой промышленности. Некоторые из них включают:
Сывороточный протеин: получаемый из молока, сывороточный протеин используется для создания белковых порошков и напитков, а также в качестве добавки в белковые батончики и другие продукты.
Казеин: еще один белок, получаемый из молока. Казеин используется в производстве сыров, а также в некоторых напитках и спортивных добавках.
Соевый белок: получаемый из сои, соевый белок используется в качестве заменителя мяса во многих вегетарианских и веганских продуктах, таких как сосиски и бургеры.
Гидролизат коллагена: получаемый из животных костей и кожи, гидролизат коллагена используется в качестве добавки к продуктам для улучшения вкуса и текстуры.
Цель: изучить свойства белков.
Оборудование и реактивы:
- раствор белка;
- раствор медного купороса;
- раствор ацетата свинца;
- пробирки
- дистиллированная вода;
- раствор хлористого калия;
- кератин (шерсти или волос).
-раствор белка;
- этанол,
-1% раствор уксусной кислоты;
- 10% раствор уксусной кислоты ;
- 10% раствор гидроксида натрия;
-4 пробирки, держатель, спиртовка.
Правила безопасности при выполнении работы:
_____________________________________________________________________________________________________________________________________________
Дата ________________ Подпись ____________________
Ход работы:
* Опыт 1. Денатурация раствора белка куриного яйца солями тяжелых металлов.
В 2 пробирки налейте по 1-2 мл раствора белка и медленно, при встряхивании, по каплям добавьте в одну пробирку насыщенный раствор медного купороса, а в другую – раствор ацетата свинца.
Наблюдается __________________________________________________________
_______________________________________________________________________
Данный опыт иллюстрирует применение белка как противоядия при отравлении тяжелыми металлами.
* Опыт 2. Растворение белков
Многие белки растворяются в воде, что обусловлено наличием на поверхности белковой молекулы свободных гидрофильных групп. Растворимость белка в воде зависит от структуры белка, реакции среды, присутствия электролитов. В кислой среде лучше растворяются белки, обладающие кислыми свойствами, а в щелочной - белки, обладающие основными свойствами.
Альбумины хорошо растворяются в дистиллированной воде, а глобулины растворимы в воде только в присутствии электролитов.
Не растворяются в воде белки опорных тканей (коллаген, кератин, эластин и др.)
К 2 каплям неразведенного яичного белка прибавляют 1 мл дистиллированной воды и перемешивают. При этом яичный альбумин растворяется, а яичный глобулин выпадает в виде небольшого осадка.
Проверяют растворимость в воде и 5% растворе хлористого калия белка кератина, содержащегося в шерсти и волосах.
Результаты работы оформить в виде таблицы:
| Название белка | в Н2О | в 5% КСl |
| | | |
| | | |
| | | |
* Опыт 3. Осаждение белков при нагревании.
Белки являются термолабильными соединениями и при нагревании свыше 50-60°С наступает денатурация. Сущность тепловой денатурации заключается в развертывании специфической структуры полипептидной цепи и разрушении гидратной оболочки белковых молекул, что проявляется заметным уменьшением их растворимости. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке, т.е. при таком значении рН среды, когда суммарный заряд белковой молекулы равен нулю, поскольку при этом частицы белка наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами – в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, так как частицы его перезаряжаются и несут в первом случае положительный, а во втором отрицательный заряд, что повышает их устойчивость в растворе.
В четыре пронумерованные пробирки приливают по 10 капель 1% раствора яичного белка.
а) первую пробирку нагревают до кипения.
б) во вторую пробирку добавляют 1 каплю 1% раствора уксусной кислоты и нагревают до кипения.
в) в третью пробирку добавляют 1 каплю 10% раствора уксусной кислоты и нагревают до кипения.
г) в четвертую пробирку добавляют 1 каплю 10% раствора гидроокиси натрия и нагревают до кипения.
Запишите наблюдения:
1пробирка: _____________________________________________________________
_______________________________________________________________________
2пробирка: _____________________________________________________________
_______________________________________________________________________
3пробирка: _____________________________________________________________
_______________________________________________________________________
4пробирка: _____________________________________________________________
_______________________________________________________________________
Сделайте вывод: ______________________________________________________________________________________________________________________________________________
Общий вывод:_________________________________________________________________
_______________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____90_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
Практическая работа №10
Решение экспериментальных задач на идентификацию органических соединений.
Цель:
опытным путем провести идентификацию предложенных органических веществ;
составить уравнения химических реакций в молекулярном виде;
провести эксперимент, соблюдая правила техники безопасности.
Правила безопасности при выполнении работы:
__________________________________________________________________________________________________________________________________________
Дата ________________ Подпись ____________________
Теоретическая часть
Идентификация химических веществ – это опознавание их по совокупности общих или частных признаков (свойств).
Реакции, которые используют для идентификации различных веществ, называются качественными.
Специфические химические свойства органических веществ обусловлены структурным строением: типом углеродного скелета, наличием кратных связей ( C=CC C- тройных), наличием функциональных групп.
Для распознавания трех веществ (глицерина, альдегида, глюкозы) проводят качественные реакции на наличие функциональных групп.
Функциональными группами называются группы атомов, которые обусловливают характерные химические свойства данного класса веществ.
Общим для этих классов веществ является взаимодействие с гидроксидом меди.
Гидроксильная группа – ОН является функциональной группой для спиртов.
К многоатомным спиртам относятся органические соединения, в молекулах которых содержится несколько гидроксильных групп, соединенных с углеводородным радикалом, трехатомный спирт - глицерин C3H5(OH)3.
Если к свежеприготовленному осадку гидроксида меди (II) в присутствии щелочи прилить глицерин и встряхнуть, то осадок растворяется и образуется раствор ярко-синего цвета – глицерат меди (II). Это качественная реакция на многоатомные спирты.
Карбонильная группа –CHO является функциональной группой для альдегидов. Для альдегидов наиболее характерны реакции окисления и присоединения. Реакции окисления являются качественными реакциями на альдегиды.
Если к голубому осадку гидроксида меди (II) прилить раствор уксусного альдегида и смесь нагреть, то сначала появляется желтый осадок гидроксида меди(I), который при дальнейшем нагревании превращается в красный осадок оксида меди(I).
Глюкоза по своим химическим свойствам является альдегидоспиртом т.е. она проявляет свойства как альдегидов, так и многоатомных спиртов. Поэтому для глюкозы также характерна реакция с Сu(ОН)2. Результат реакции будет зависеть от условий ее проведения.
а)Качественная реакция на глюкозу как многоатомный спирт: взаимодействие с Сu(ОН)2 на холоде с образованием темно-синего раствора глюконата меди (II).
б) Качественная реакция на глюкозу как альдегид: взаимодействие с Си(ОН)2 при нагревании с образованием в начале желтого, затем красного осадков.
Для распознавания глюкозы, сахарозы, крахмала сначала проводят качественную реакцию на крахмал.
Характерной реакцией крахмала (С6Н10О5)n является его взаимодействие с йодом. Если к охлажденному крахмальному клейстеру добавить раствор йода, то появляется синее окрашивание.
Для распознавания глюкозы и сахарозы проводят качественные реакции на многоатомные спирты и на наличие свободной альдегидной группы.
Сахароза С12Н22О11 – дисахарид. Для нее характерна реакция многоатомных спиртов: при взаимодействии с Cu(OН)2 образуется растворимый в воде раствор сахарата меди (ярко-синий раствор).
Сахароза не содержит свободную альдегидную группу, относится к невосстанавливающим углеводам, поэтому при нагревании с Cu(OН)2 не образует красного осадка оксида меди(I).
Для распознавания смазочного и растительного масла проводят качественные реакции на двойную связь. Смазочные масла состоят в основном из смеси предельных углеводородов. Значит, бромную воду не обесцвечивают, не окисляются перманганатом калия, т. к. не содержат кратные связи.
Растительное масло состоит, в основном, из жиров, содержащих остатки непредельных кислот, в которых имеются двойные связи. Поэтому растительное масло будет обесцвечивать бромную воду и раствор перманганата калия.
3. Перечень оборудования
3.1 Спиртовка.
3.2 Штатив с пробирками.
3.3 Держатель для пробирок.
4. Ход рработы
*Опыт № 1. Распознавание глицерина, альдегида, глюкозы, гидроксидом меди
Реактивы: раствор сульфата меди CuSO4;
раствор гидроксида натрия NaOH;
глицерин С3Н5(ОН)3;
уксусный альдегид СН3СОН;
раствор глюкозы С6 Н12О6;
В начале получают гидроксид меди Сu(ОН)2. Для этого помещают в пробирку 10-12 капель раствора сульфата меди, затем 7-9 мл раствора гидроксида натрия и перемешивают – образуется голубой студенистый осадок гидроксида меди.
Приготовьте три пробирки. В первую из них поместите несколько капель вещества из склянки №1, во вторую – несколько капель вещества из склянки № 2, в третью несколько капель вещества из склянки № 3.
В каждую пробирку с веществами добавьте примерно 1/3 часть полученного раствора гидроксида меди и тщательно взболтайте содержимое пробирок.
В двух пробирках образуется яркий синий раствор – качественная реакция на многоатомные спирты (значит в этих пробирках глицерин и глюкоза). В третьей пробирке внешних признаков реакции не наблюдаем, значит в ней альдегид.
После этого поочередно нагрейте каждую пробирку, предварительно закрепив на ней держатель для пробирок. В двух пробирках произойдут изменения: выпадет красный осадок Cu2O. Значит, в этих пробирках находится альдегид и глюкоза. В третьей пробирке признаков реакции не наблюдаем.
*Опыт 2. Распознавание крахмала, сахарозы, глюкозы.
Реактивы: йод, водный раствор;
раствор сульфата меди CuSO4;
раствор гидроксида натрия NaOH;
раствор глюкозы C6H12O6;
раствор сахарозы C12H10O11;
крахмальный клейстер (C6H10O5)n.
Приготовьте три пробирки. В первую из них поместите 2 капли вещества из склянки № 4, во вторую – 2 капли вещества из склянки № 5, в третью – 2 капли вещества из склянки № 6. Добавьте в каждую пробирку по 1 капле раствора йода. В одной пробирке образуется синее окрашивание, это значит, что в ней крахмал. В двух других внешних признаков реакции не наблюдаем.
Для распознавания глюкозы и сахарозы нужно провести реакции с гидроксидом меди (II).
По описанной методике, в первом опыте получите гидроксид меди (II).
В две чистые пробирки поместите по 2-3 капли содержимого двух нумерованных склянок, исключить крахмал, добавьте 2-3 мл гидроксида меди (II).
В обеих пробирках образуется синий раствор – качественная реакция на многоатомные спирты, характерная для глюкозы и сахарозы.
После этого нагрейте поочередно обе пробирки. В одной пробирке произойдут изменения: выпадет красный осадок Cu2O – качественная реакция на альдегиды, значит в этой пробирке глюкоза. В другой пробирке внешних признаков реакции не наблюдаем, что указывает на отсутствие в молекуле свободной альдегидной группы. Значит в этой пробирке сахароза.
Опыт 3. Распознавание смазочного и растительного масла.
Реактивы: растительное масло;
смазочное масло;
бромная вода, насыщенный раствор, Br2 – водный;
этиловый эфир (или хлороформ);
раствор перманганата калия KMnO4;
раствор карбоната натрия Na2CO3;
Приготовьте четыре пробирки. В первую и вторую поместите по 5-6 капель вещества из склянки № 7, в третью и в четвертую – по 5-6 капель вещества из склянки № 8.
В каждую пробирку прибавьте по 3-5 капель этилового эфира, хорошо встряхните до растворения масла.
В первую пробирку прилейте 2-3 капли бромной воды, во вторую – 2-3 капли раствора перманганата калия, тщательно взболтайте содержимое пробирок.
Затем возьмите третью и четвертую пробирку. В одну пробирку прилейте 2-3 капли бромной воды, а в другую – 2-3 капли раствора перманганата калия, тщательно взболтайте содержимое пробирок. В одной пробирке появляется желтая окраска, при добавлении бромной воды она становится устойчивой, что указывает на наличие двойной связи, в другой пробирке малиновая окраска перманганата калия исчезает, что указывает на окисление глицеридов непредельных высших кислот, значит в этих пробирках растительное масло.
В двух других пробирках признаков реакций не наблюдаем, значит в них смазочное масло.
Результаты всех опытов внесите в таблицу:
| № п/п | Формулы и названия реактивов | Название опыта. Уравнение реакций | Наблюдения и выводы |
|
| |||||||||
| 1
| Раствор сульфата меди CuSO4; Раствор гидроксида натрия NaOH; Глицерин C3H5(OH)3; Уксусный альдегид CH3COH; Раствор глюкозы C6H12O6;
| Опыт №1.Распознавание глицерина,альдегида,глюкозы.
CH2OH HO на холоду | + Cu CHOH HO | CH2OH на холоду CH3COH+ Cu(OH)2
O C | H CHOH HO на холоду | + Cu CHOH HO | (CHOH)2 | CH2OH t0 C3H5(OH)3 + Cu(OH)2 O t0 CH3 – C + Cu (OH)2 H | Вещество | Cu(OH)2Идентифицированное вещество |
|
| ||||||||
|
| На холодуПри нагревании |
|
|
| ||||||||||
| №1
|
|
|
|
| ||||||||||
| №2
|
|
|
|
| ||||||||||
| №3 |
|
|
|
| ||||||||||
|
|
|
| ||||||||||||
| 2
| Йод водный раствор Раствор сульфата меди CuSO4; Раствор гидроксида натрия NaOH; Раствор глюкозы C6H12O6; Раствор сахарозы C12H10O11; Крахмальный клестер (C6H10O5)n. | Опыт №2.Распознавание глюкозы,сахарозы,крахмала.
(C6H10O5)n + I2 C6H12O6 + I2 C12H22O11 + I2
O C | H CHOH HO на холоду | + Cu CHOH HO | (CHOH)2 | CH2OH на холоду C12H22O11+ Cu(OH)2
O C | H t0 (CHOH)4 + Cu(OH)2 | CH2OH
t0 C12H22O11 + Cu(OH)2 | Вещество | I2Cu(OH)2 | Идентифицированное вещество |
|
| |||||||
| На холоду | При нагревании |
| ||||||||||||
|
№4
|
|
|
| |||||||||||
| №5
|
|
|
| |||||||||||
| №6 |
|
|
| |||||||||||
|
|
|
| ||||||||||||
5. Дайте ответы на контрольные вопросы:
6.1 Что называется функциональной группой?
6.2 Какую функциональную группу имеют спирты?
6.3 Какие внешние признаки протекания реакции взаимодействия глицерина с гидроксидом меди (II) на холоде?
6.4 Какую функциональную группу имеют альдегиды?
6.5 Какие внешние признаки протекания реакции взаимодействия уксусного альдегида с гидроксидом меди (II) при нагревании?
6.6 Какие функциональные группы имеет глюкоза?
6.7 От чего зависит результат реакции взаимодействия глюкозы с гидроксидом меди (II)?
6.8 Какая реакция является характерной для крахмала?
6.9 Почему при нагревании сахарозы с гидроксидом меди не образуется красного осадка?
6.10 Какими реакциями можно распознать растительные масла, почему?
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Условия выполнения задания
1. Место (время) выполнения задания: задание выполняется на занятие в аудиторное время
2. Максимальное время выполнения задания: ____90_______ мин.
3. Вы можете воспользоваться учебником, конспектом лекций
Шкала оценки образовательных достижений:
Критерии оценки: Выполнение работы более 90% –оценка «5»,
70-90% - оценка «4»,
50 -70% - оценка «3»,
Менее 50% - оценка «2».
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Основная литература:
Габриелян О.С., Остроумов И.Г. Химия: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017
Габриелян О.С., Остроумов И.Г. Химия для профессий и специальностей естественно-научного профиля: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017
Габриелян О.С. и др. Химия. Практикум: учеб. пособие для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. –М., 2017
Габриелян О.С.и др. Химия: пособие для подготовки к ЕГЭ: учеб. пособие для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017
Габриелян О.С., Лысова Г.Г. Химия. Тесты, задачи и упражнения: учеб. пособие для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО. – М., 2017
Ерохин Ю.М., Ковалева И.Б. Химия для профессий и специальностей технического и естественно-научного профилей: учебник для студентов профессиональных образовательных организаций, осваивающих профессии и специальности СПО.– М., 2017
Габриелян О.С. Химия: пособие для подготовки к ЕГЭ: учеб. пособие / О.С. Габриелян, И.Г. Остроумов, С.А. Сладков. - М.: 2014
Габриелян О.С. и др. Химия для профессий и специальностей техниче-ского профиля (электронное приложение)
Габриелян О.С. и др. Химия для профессий и специальностей техниче-ского профиля (электронное приложение)
Дополнительная литература:
Ерохин Ю.М. , Ковалева И. Б. Химия для профессий и специальностей технического и естественно научного профилей. - М.: 2014
Ерохин Ю.М. Химия: Задачи и упражнения. - М.: 2014
Ерохин Ю.М. Сборник тестовых заданий по химии. - М.: Академия, 2014
Интернет-ресурсы:
pvg.mk.ru - олимпиада «Покори Воробьёвы горы»
hemi.wallst.ru - «Химия. Образовательный сайт для школьников» www.alhimikov.net - Образовательный сайт для школьников
chem.msu.su - Электронная библиотека по химии
www.enauki.ru - интернет-издание для учителей «Естественные науки»
1september.ru - методическая газета "Первое сентября"
hvsh.ru - журнал «Химия в школе»
www.hij.ru/ -«Химия и жизнь» chemistry-chemists.com/index.html - электронный журнал «Химики и химия»