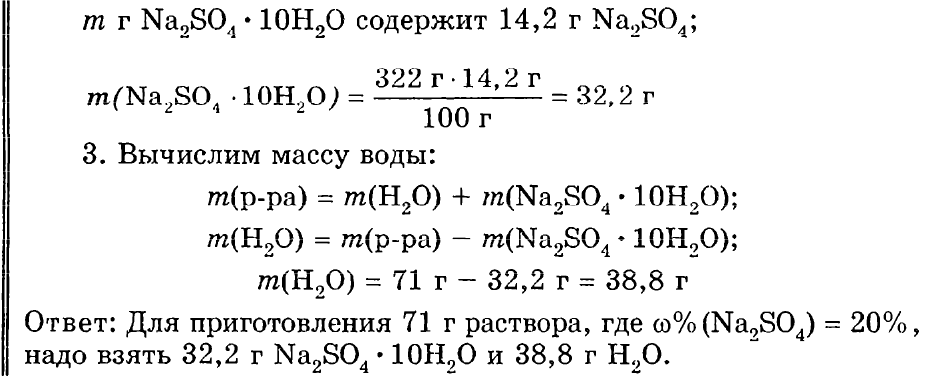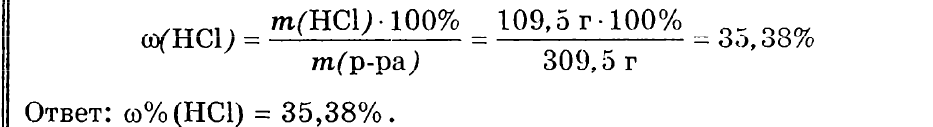Рассчитайте массовую долю нитрата калия в растворе, полученном при смешивании 15 г соли и 85 г воды.
Вычислите массу гидроксида калия, необходимую для приготовления 300 г раствора с массовой долей щелочи 0,3.
Рассчитайте массу воды, необходимой для приготовления 200 г раствора с массовой долей серной кислоты 0,15.
Рассчитайте массу физиологического раствора, содержащего 396,6 г воды. Массовая доля поваренной соли равна 0,0085.
Какие массы йода и спирта необходимы для приготовления 300 г раствора с массовой долей йода 5%?
Сахар массой 1 кг растворили в воде объемом 5 л. Найти массовую долю (%) сахара в этом растворе.
Найти молярную концентрацию раствора хлороводородной кислоты (ρ = 1,19 г/мл) с массовой долей НСl 36%.
Какую массу серной кислоты надо взять для приготовления раствора объемом 2,5 л, если C(H2SO4) = 0,1 моль/л?
К 120 г раствора фруктозы с массовой долей 14% прилили 180 мл воды. Какова массовая доля (%) фруктозы в полученном растворе?
В 200 мл воды растворили 50 л хлороводорода НСl (н. у.). Какова массовая доля (%) НСl в этом растворе?
Сколько молекул растворенного вещества содержат 10 мл раствора, молярная концентрация которого 0,01 моль/л?
Какую массу кристаллической соды Na2CO3•10Н2O надо взять, чтобы приготовить 500 г раствора с массовой долей Na2CO320%?
Вычислить массу железного купороса FeSO4•7Н2O, который содержится в растворе объемом 2 л, если C(FeSO4•7Н2O) = 1 моль/л.
Какая масса хлорида железа (III) содержится в 20 мл раствора с массовой долей FeCl3 40%? Плотность раствора 1,13 г/мл. Какова молярная концентрация этого раствора?
Насыщенный при 40 °С раствор массой 200 г содержит сульфат калия массой 26 г. Вычислить массовую долю (%) и растворимость K2SO4.
Какие массы воды и нитрата аммония NH4NO3 необходимо взять для приготовления 3 л раствора с массовой долей NH4NO3 8%? Плотность раствора 1,06 г/мл.
Какая масса хлорида меди (II) СuСl2 содержится в растворе объемом 15 л, если его молярная концентрация 0,3 моль/л?
Вычислить молярную концентрацию раствора, содержащего в 200 мл 12,6 г азотной кислоты.
Определить массовую долю (%) нитрита железа (II) Fe(NO2)2, если 4 кг 15%-го раствора выпарили до 1 кг.
Плотность раствора уксусной кислоты СН3СООН 1,02 г/мл, ее массовая доля 16%. Найти молярную концентрацию этого раствора.
Молярность раствора серной кислоты равна 4,5 моль/л, его плотность 1,26 г/мл. Определить процентную концентрацию раствора.
Определить массовую долю (%) хлорида меди (II) СuСl2 в растворе, если на 2 моля соли приходится 15 молей воды.
К 40 г раствора фосфата натрия Na3PO4 с массовой долей 8% прилили 20 г раствора с массовой долей Na3PO4 5%. Какова массовая доля (%) Na3PO4 в полученном растворе?
К 300 мл 20% раствора серной кислоты (ρ = 1,14 г/мл) прилили 250 мл воды. Определить процентную и молярную концентрации полученного раствора.







 =
=  = 0,1
= 0,1

 =
=  = 0,1
= 0,1





 =
=  = 40 (г)
= 40 (г)