
Девиз урока :
«Только из союза двух работающих вместе и при помощи друг друга рождаются великие вещи» Антуан де Сент- Экзюпери

Растворы на нашей кухне и в домашней аптечке
- Уксусная кислота ( СН3СООН)
- Пероксид водорода ( Н2О2 )
- Нашатырный спирт (аммиак)
- Бриллиантовый зеленый
- Отбеливающие и дезинфицирующие
растворы
Уксусная кислота
марганцовка
Нашатырный спирт-это раствор аммиака 10%-ный
Перекись водорода
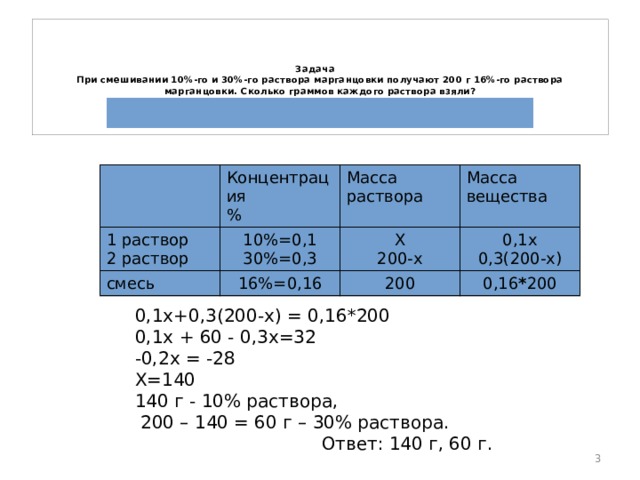
Задача При смешивании 10%-го и 30%-го раствора марганцовки получают 200 г 16%-го раствора марганцовки. Сколько граммов каждого раствора взяли? Решение:
Концентрация
1 раствор
2 раствор
%
10%=0,1
смесь
Масса раствора
30%=0,3
Масса вещества
Х
16%=0,16
200-х
0,1х
200
0,3(200-х)
0,16 * 200
0,1х+0,3(200-х) = 0,16*200
0,1х + 60 - 0,3х=32
-0,2х = -28
Х=140
140 г - 10% раствора,
200 – 140 = 60 г – 30% раствора.
Ответ: 140 г, 60 г.

Задача . Какое количество воды и 80-го раствора уксусной кислоты следует взять для того, чтобы приготовить 200 г столового уксуса (8%-й раствор уксусной кислоты.)
80%=0,8
0%=0
0,8х
х
0
200-х
0,08*200
200
8%=0,08
Решение:
0,8х = 0,08*200
0,8х = 16
х =16 :0,8
х =20
20 (г) – уксусной кислоты
200 – 20 = 180 (г) – воды.
Ответ: 20 г, 180 г.

Проверочная работа
Вариант2
При смешивании 15%-го и 60% -го раствора соли получают 90 г 40%-го раствора соли. Сколько граммов 15%-го раствора взяли?
Вариант 1
При смешивании 15%-го и 8% -го раствора кислоты получают 70 г 10%-го раствора кислоты. Сколько граммов 15%-го раствора взяли?

Решение
0,15х+0,08(70-х)=0,1*70
0,15х+5,6-0,08х=7
0,07х=7-5,6
0,07х=1,4
х=1,4:0,07
х=20
20(г)-15% раствора.
Ответ:20г.
0,15х+0,6(90-х)=0,4*90
0,15х+54-0,6х=36
-0,45х=36-54
-0,45х=-18
1р
1р
х=-18:(-0,45)
2р
15%=0,15
2р
15%=0,15
х=40
60%=0,6
8%=0,08
см
х
см
х
40(г) – 15% раствора.
0,15х
70-х
10%=0,1
40%=0,4
90-х
0,15х
Ответ:40г.
0,6(90-х)
0,08(70-х)
90
70
0,1*70
0,4*90

Домашнее задание
- Какую массу молока 10%-й жирности и пломбира 30%-й жирности необходимо взять для приготовления 100 г 20%-го новогоднего коктейля?
- Для засола огурцов используют 7% водный раствор поваренной соли (хлорида натрия NaCl). Именно такой раствор в достаточной мере подавляет жизнедеятельность болезнетворных микроорганизмов и плесневого грибка, и в то же время не препятствует процессам молочнокислого брожения. Рассчитайте массу соли и массу воды для приготовления 1 кг такого раствора?

Урок понравился и тема понята:
Урок не понравился и тема не понятна:
Урок понравился, но не всё ещё понятно:

Спасибо за работу! Всего доброго!

Задача №1 (на смешивание растворов)
Смешали 150 г раствора нитрата калия с массовой долей 12% и 300 г раствора этой же соли с массовой долей 7%. Массовая доля нитрата калия в полученном растворе равна __________ %. (Запишите число с точностью до целых.) I II III
m(в-ва)
m(р-ра)
ω
150
300
0,12
0,07
X
*Массовую долю соли в полученном при смешивании растворе обозначаем за X

Ход решения
- Находим массы веществ в I и II растворах и массу вещества в получившемся растворе.
- Находим массу получившегося раствора.
- Вычисляем «Х» (массовую долю вещества в полученном растворе)
или 9%
I
m(в-ва)
II
m(р-ра)
ω
III
150
300
0,12
0,07
X
18
21
18+21
150+300

Задача №2 (на разбавление раствора)
Вычислите массу воды, которую нужно добавить в 1 кг раствора сульфата меди (II) с массовой долей 30 % для получения 5% - ного раствора
I
II
m(в-ва)
m(р-ра)
1000
ω
1000+X
0,3
0,05
*Массу добавленной воды обозначаем за X

Ход решения
- Находим массу вещества в исходном растворе
- Масса вещества в образовавшемся растворе такая же как и в исходном
- Выражаем массу образовавшегося раствора и находим величину Х (массу добавленной воды)
m(в-ва)
m(р-ра)
ω
1000
1000+X
0,3
0,05
II
I
300
300

Задача №3 (на «концентрирование» – добавление вещества)
К 150 г 20%-ного раствора гидроксида калия добавили кристаллический гидроксид калия и получили 40%-ный раствор. Масса добавленного гидроксида калия равна ______г.
I
II
m(в-ва)
m(р-ра)
+X
150
ω
150+X
0,2
0,4
*Массу добавленного вещества (гидроксида калия) обозначим за X

Ход решения
- Находим массу вещества в исходном растворе
- Масса вещества в полученном растворе увеличится на Х
- Масса полученного раствора увеличится также на Х
- Находим выражение для массы вещества в полученном растворе и вычисляем величину Х
m(в-ва)
m(р-ра)
ω
150
150+X
0,2
0,4
I
II
+X
30
30

Рефлексия
Синквей н – это стихотворение, состоящее из пяти строк, в которых человек высказывает свое отношение к проблеме
Одно слово, определяющее содержание синквейна
Степень окисления
Два прилагательных, характеризующих данное слово
Положительная, отрицательная
Три глагола , показывающие действия понятия
Таит секреты, объединяет, помогает
Короткое предложение- высказывание своего отношение
Важная характеристика состояния атома в молекуле
Одно существительное- ассоциации связанные с понятием
Формула



































