8 класс. Тема: Закон Авогадро. Молярный объем газа. Дата____
Цель:
1.Образовательная: изучить закон Авогадро, научить определять молярный объем,
относительную плотность газов, научить решать задачи, применяя закон Авогадро.
2. Развивающая: развитие познавательной активности, мышление, речи, формирование умений выделять главное, устанавливать единые, общие признаки и свойства целого.
3.Воспитательная: воспитание мотивов учения, положительного отношения к знаниям, умения работать в группах, здоровый образ жизни.
Тип урока: комбинированный
Вид урока: усвоение новых знаний
Прогнозируемый результат: знают закон Авогадро и его следствие, используя формулы, умеют самостоятельно решать задачи.
Оборудование: учебник «Химия 8» Рудзитис Г.Е 2010 год, компьюбтер. проектор, рабочие тетради, таблицы, схемы, лист самооценки, конверты с заданиями.
Межпредметные связи с физикой, математикой, историей.
Структура урока:
Ход урока:
1.Организационный момент.Приветствие!
Проверьте готовность, все в порядке?
Готов ли учебник, дневник и тетрадка?
Своим одноклассникам ты улыбнись,
И к знаниям стойким, дружочек, стремись!
2.Проверка домашнего задания
Вспомним что такое Молярная масса и количество вещества. Дайте определение и формулы для расчёта.
Задание № 1 расчитайте молярную массу для 1 вариант СО2 2 вариант.NH3
Задание №2 .вычислите массу СО2, если п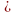 2 моль NH3 n- 3 моль
2 моль NH3 n- 3 моль
Ответы. 88 г 51г.
Взаимопроверка.
Учитель. Ребята! У вас на партах в файлах лежать листы самооценки. Познамьтесь с правилами их заполнения.
Выберите лишнее. СI2,H2, AI. Na, O2, N2.
3.Актуализация опорных знаний Беседа
— Как влияет на физическое состояние газов изменение температуры?
Мотивация. Ребята! Постарайтесь в конце урока. ответить на 3 вопроса. Что? Зачем?Почему?
При решении задач мы часто находим количество вещества или массу газообразных веществ (кислорода, водорода, углекислого газа). Пересчитать количество молекул практически невозможно, но и взвесить газы на практике очень трудно. Для измерения газов принято использовать объемы. Итак, необходимо выяснить, как связаны между собой количество вещества и объем.
Сообщаю тему урока и прошу учеников сформулировать цель урока.
4. Изучение нового материала Закон Авогадро. Давайте послушаем небольшое сообщение. Кем был А.Авогадро и в чём его заслуга?
Сообщение ( Калеева Д)
Работа с учебником стр 153-154
Итак, нас интересует, как связаны между собой объем газов и количество молекул, содержащихся в этом объеме? Этим вопросом заинтересовался в начале XIX столетия итальянской ученый Амедео Авогадро. После многочисленных экспериментов с газообразными веществами он в 1814 году сформулировал свой закон, который со временем получил название закона Авогадро:
В равных объемах любых газов, которые находятся в одинаковых условиях (температура и давление), содержится одинаковое число молекул.
С современной точки зрения это утверждение довольно легко объясняется. Как и большинство твёрдых и жидких веществ, газы состоят из отдельных молекул. Но в отличие от твердых и жидких веществ, в которых молекулы расположены очень плотно друг к другу, в газах молекулы расположены на больших расстояниях друг от друга. Эти расстояния значительно больше собственных размеров молекул. И хотя молекулы разных газов отличаются друг от друга размерами, формой и объемом, этими отличиями можно пренебречь, и рассматривать их как жесткие крошечные шарики.
Молекулы газа постоянно находятся в состоянии беспорядочного (хаотичного) движения и сталкиваются друг с другом с определенной частотой. Но при этом среднее расстояние между молекулами газа постоянно и зависит только от условий, в которых находится газ. Если разные газы находятся в одинаковых условиях (температура и давление), то расстояния между молекулами приблизительно одинаковы, и потому в одинаковых объемах должно содержаться одинаковое число молекул.
Внимание !Закон справедлив только для идеальных газов и не применяется для жидкостей.
Коллективно обсуждаем
Согласно закону Авогадро, в равных объемах разных газов при одинаковых условиях содержится равное число молекул. Какая еще величина характеризуется равным числом частичек? (Ответ: моль.)
Необходимо прийти к выводу о том, что 1 моль любого газа при одинаковых условиях занимает одинаковый объем. Это первое следствие, которое вытекает из закона Авогадро.
Как можно назвать объем 1 моль газа по аналогии с молярной массой?
Каким будет молярный объем любого газа при одинаковых условиях?
Молярный объем — это физическая величина, которая равняется отношению объема вещества к его количеству.
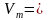
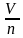
При нормальных условиях молярный объем любого газа составляет приблизительно 22,4л/моль.
Зная молярный объем газа, можно определить количество вещества л, которое содержится в объеме V при нормальных условиях:
п 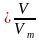 Vт = 22,4 л/моль.
Vт = 22,4 л/моль.
Если мы знаем, что в одном моле вещества содержится такое количество молекул, которое равняется числу Авогадро, то можем вычислить число молекул газа в определенном объеме при нормальных условиях:
 ; N
; N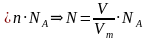
5.Первичное закрепление изученного
Работа удоски .Решение задач с использованием закона Авогадро.
Задача 1. Вычислите объем, который занимает при нормальных условиях газ количеством вещества 1,2 моль.
Дано:
n(газа) = 1,2 моль
V (газа) —?
Решение:
V=п Vт=1,2 моль*22,4 л/моль = 26,88 л.
Vт=1,2 моль*22,4 л/моль = 26,88 л.
Ответ: V(газа) = 26,88 л.
Задача2.Вычислите количество вещества, которое содержится при нормальных условиях в 5,6 л газа.
Решение:
Дано: V(газа) = 5 л.
n(газа) —? n= 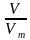 =
= 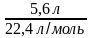 = 0,25 моль.
= 0,25 моль.
Ответ: п(газа) = 0,25 моль
6. Физминутка.
Слушайте меня внимательно! Если я называю металл, то вы приседаете. Называю неметалл, поворачиваетесь влево, вправо. Называю газ, подпрыгиваете.
7. Выполнение самостоятельной работы.
1.Вычислите какой объём при н.у займет аммиак кол- ва 0,5 моль.
2. Вычислите , какой объём займёт при н.у азот массой 560гр.
Запасной вариант ( сборник задач и упражнений Гольдфарб) стр 42 задание 6-51.
Дополнительная задача. Задача. Вычислите массу одного литра углекислого газа (н.у.).
Дано: Решение
V(С02) = 1 л.
Вычислим количество вещества углекислого газа,
содержащегося в 1 литре:
n(CO2) = 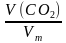 =
= 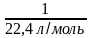 = 0,0446 моль
= 0,0446 моль
Масса такого количества углекислого газа будет
равняться:
M(CO2) = 12 + 2  16 = 44 г/моль
16 = 44 г/моль
m(CO2) = n(CO2)  M(CO2) = 0,046 моль
M(CO2) = 0,046 моль  44 г/моль = 1,96 г.
44 г/моль = 1,96 г.
Ответ: m(CO2) = 1,96 г.
8. Взаимопроверка. Заполнение листов самооценки. Критерии прописаны.
Учитель . Обратите внимание. что такие задания есть и Кимах по химии в 9 класс и В ЕГЭ 11 класса.
9.Домашнее задание: Разноуровневое.
Для всех .
Выучить конспект. Формулировку закона и следствие закона. §44 учебника Г.Е. Рудзитиса, Ф.Г. Фельдмана . Сделать и выучить карточки с формулами.
Для сильных решить задачу. №2 стр 156 учебник Рудзитис Г.Е.
10. Подведение итогов урока
Определите важнейшие понятия, которые изучались на уроке и проанализируте результаты своей деятельности на уроке и оценить свои умения решать задачи с использованием понятия «молярный объем газов».
Оценки.
11. Рефлексия. Ребята по кругу высказываются одним предложением, выбирая начало фразы из рефлексивного экрана на доске:
-
сегодня я узнал…
-
было интересно…
-
было трудно…
-
я выполнял задания…
-
я понял, что…
-
теперь я могу…
-
я почувствовал, что…
-
я приобрел…
-
я научился…
-
у меня получилось …
-
я смог…
-
я попробую…
-
меня удивило…
-
урок дал мне для жизни…
мне захотелось…
Ребята, с каким настроением вы уходите с урока? Дорисуйте его на доске.
Урок закончен. Спасибо за урок!
Лист самооценки.
|
№ | ФИО ученика | Устный ответ | Решение задач при изучении новой темы | Самостоятельная работа |
Средний бал |
| 1 |
|
|
|
|
|
| 2 |
|
|
|
|
|
| 3 |
|
|
|
|
|
| 4 |
|
|
|
|
|
| 5 |
|
|
|
|
|
| 6 |
|
|
|
|
|
| 7 |
|
|
|
|
|
| 8 |
|
|
|
|
|
| 9 |
|
|
|
|
|
| 10 |
|
|
|
|
|
| 11 |
|
|
|
|
|
Критерии оценивания устного ответа
Отметка «5» :
- ответ полный и правильный на основании изученных теорий;
- материал изложен в определенной логической последовательности, литературным языком;
- ответ самостоятельный.
Ответ «4» ;
- ответ полный и правильный на сновании изученных теорий;
- материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «З» :
- ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2» :
- при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя, отсутствие ответа.
Оценка умений решать расчетные задачи.
Отметка «5»:
- в логическом рассуждении и решении нет ошибок, задача решена рациональным способом;
Отметка «4»:
- в логическом рассуждении и решения нет существенных ошибок, но задача решена нерациональным способом, или допущено не более двух несущественных ошибок.
Отметка «3»:
- в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
- имеется существенные ошибки в логическом рассуждении и в решении.
- отсутствие ответа на задание.







 2 моль NH3 n- 3 моль
2 моль NH3 n- 3 моль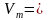
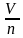
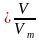 Vт = 22,4 л/моль.
Vт = 22,4 л/моль. ; N
; N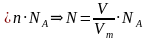
 Vт=1,2 моль*22,4 л/моль = 26,88 л.
Vт=1,2 моль*22,4 л/моль = 26,88 л. 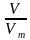 =
= 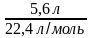 = 0,25 моль.
= 0,25 моль.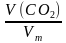 =
= 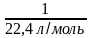 = 0,0446 моль
= 0,0446 моль

















