Газимагомедова М.Б.
«Соли, их классификация и свойства»
Цели и задачи:
Образовательные:
Сформировать знания учащихся о солях как классе неорганических соединений;
Привести в систему знания учащихся о классификации солей;
Познакомить со свойствами и применением солей.
Развивающие:
Развить умения и навыки работы с лабораторным оборудованием и химическими реактивами;
Правильно оформлять результаты опытов, составлять уравнения реакций;
Развивать умения наблюдать и делать выводы.
Воспитательные:
Формирование всесторонне развитой личности;
Воспитывать любовь к родному краю;
Воспитание трудолюбия, взаимовыручки, умение работать в парах.
Методы: рассказ, беседа, демонстрация презентации “Соли, их классификация и свойства”, выполнение лабораторной работы в парах с реактивами, работа с цифровыми лабораториями.
Оборудование: компьютер, проектор, интерактивная доска SmartBoard, документ-камера Gaoke, ноутбуки (по 1 на двоих учеников), цифровая лаборатория VernierLabPro. Презентация Power Point “Соли, их классификация и свойства” (http:rusedu.ru/detail_3216.html); (CD-диски: «Интерактивное оборудование и интернет-ресурсы в школе. Химия 8», «Неорганическая химия. Интерактивные дидактические материалы. 8 класс», «Наглядная химия. Химия 8-9 класс», «Наглядная химия. Инструктивные таблицы», «Неорганическая химия. Мультимедийное сопровождение уроков», «Химия 11 класс. Видеодемонстрации». Раздаточный материал – карточки; образцы солей и минеральной воды; транспаранты для магнитной доски; этикетки от минеральной воды; пробирки, колбы, растворы солей.
Тип урока: комбинированный.
Ход урока
Оргмомент. Проверка домашнего задания:
Упражнение №1 с.221
Химические свойства оксида калия
Химические свойства оксида серы (VI).
реакция нейтрализации – это …
кислоты – это …
оксиды – это …
классификация оксидов …
2 этап. Работа по теме урока
На демонстрационном столе образцы:
мел (карбонат кальция)
сода техническая (карбонат натрия)
медный купорос (сульфат меди)
поваренная соль (хлорид натрия)
О чем мы будем говорить сегодня на уроке? (О солях)
Соли – самый многочисленный класс веществ. (Презентация «Соли»)

Задание. Составить формулы, описать свойства солей. (Наглядная химия. Химия 8-9 класс).
СаСО3 – твердое вещество, белого цвета, нерастворимо в воде.
Na2CO3 – твердое вещество, белого цвета, хорошо растворимо.
CuSO4 – твердое вещество, синего цвета, хорошо растворимо.
NaCl – твердое вещество, белого цвета, хорошо растворимо.
Вывод: соли - твердые вещества, отличаются цветом, растворимостью в воде.
Получение солей. (Видеодемонстрации. Химия. 11 класс).

2 Классификация солей. (Наглядная химия. Химия 8-9 класс).

Учащиеся в парах работают с ноутбуками (электронное приложение к учебнику 8 класса издательства «Дрофа»).

Выбрать знакомое, понятное и сгруппировать новые формулы. В итоге получается три группы формул.
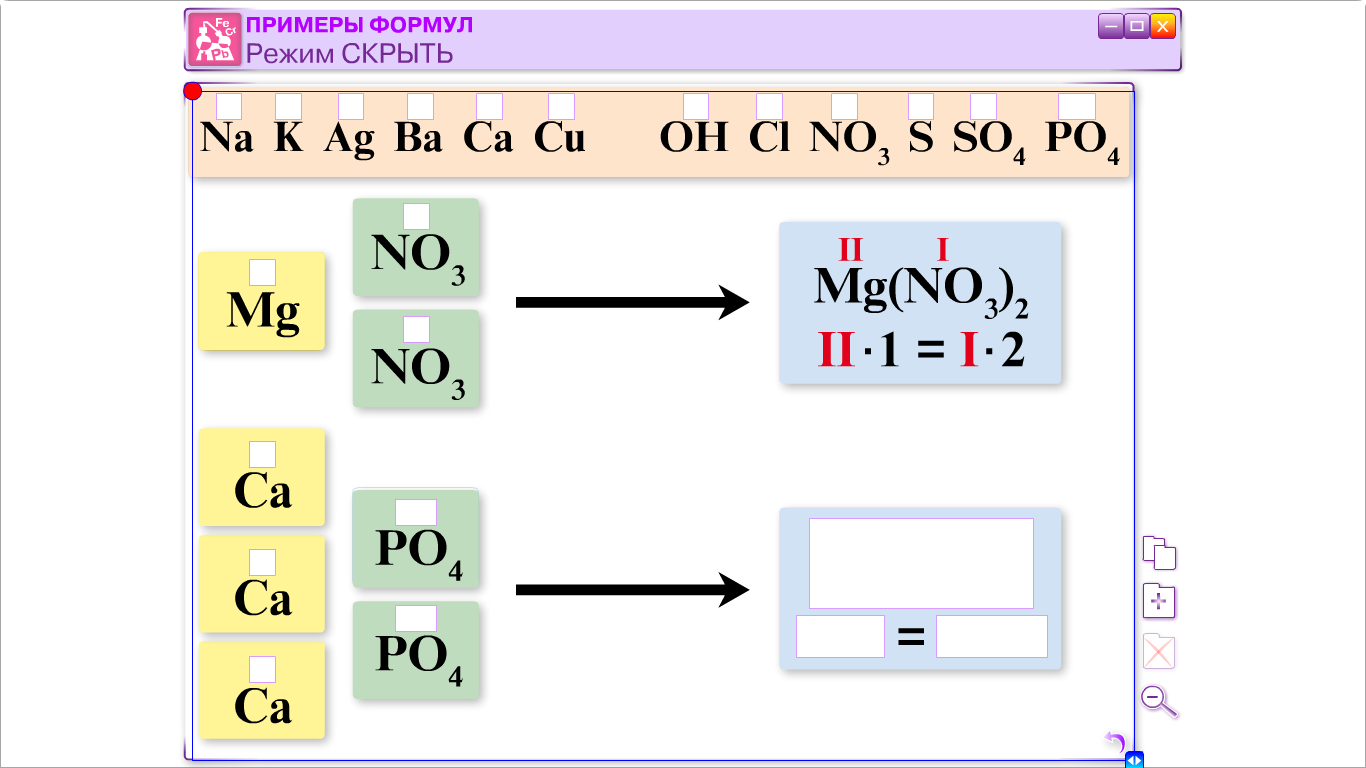
а) Соли средние (нормальные): Na2CO3, CuSO4 на доске (магнитной) начинаем формировать схему. Записываем уравнение образования средней соли:
2NaOH + H2SO4 = Na2SO4 + 2H2O реакция обмена, нейтрализации.
Na2SO4 2Na+ + SO42- (1 cтупень)
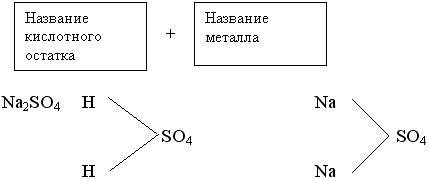
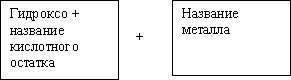
б) Соли кислые: NaHСO3, NaHSO4 - результат неполного замещения атомов водорода в кислоте на атом металла.
NaOH + H2SO4 = NaHSO4 + H2O
NaHSO4  Na+ + HSO4- (1 степень)
Na+ + HSO4- (1 степень)
HSO4  H+ + SO42- (2 степень) – эта степень с меньшей степенью диссоциации.
H+ + SO42- (2 степень) – эта степень с меньшей степенью диссоциации.
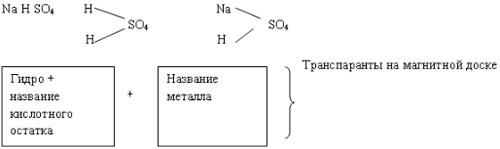
в) Соли основные:
Ca(OH)2 + HCl = CaOHCI + H2O
CaOHCl  CaOH+ + Cl- (1 ступень)
CaOH+ + Cl- (1 ступень)
CaOH+  Ca2+ + OH- (2 ступень) очень незначительна.
Ca2+ + OH- (2 ступень) очень незначительна.
Закрепление: провести исследование состава минеральных вод, используя этикетки производителей. Работа выполняется на местах, парами – учащиеся получают карточку с заданиями и этикетку от конкретной воды.

Разбираются лучшие ответы. Используя документ-камеру проецируем работу на интерактивную доску и обсуждаются полученные результаты.
Двое учеников работают в это время с датчиком VernierLabPro, определяя рН этой же минеральной воды и выводят результаты исследования на экран.
Выслушиваем отчет группы и рекомендации по потреблению минеральной воды.
Химические свойства солей (практическая работа по группам)
Проведение реакций по группам с реактивами, стоящими на столах.
2 свойства солей мы с вами уже изучили.
Какие? С чем реагируют кислоты? (Ответы ребят и проведение опытов с кислотами и основаниями).
Что получилось? Комментарии.
А как вы думаете, с чем еще могут реагировать соли? (Друг с другом)
Любые соли или есть условие протекания реакции? (Осадок)
Проведите реакцию между нитратом серебра и хлоридом натрия.
А как вы думаете, с чем еще могут реагировать соли? ( С металлами)
Со всеми? (только, стоящими в ряду напряжений до водорода) проделываем опыт с гвоздем.
Беседа о правилах техники безопасности при проведении опытов с использованием твердых и жидких веществ. (Наглядная химия. Инструктивные таблицы).


Методическое руководство по выполнению практической работы
«Химические свойства солей»
Проведите реакции, характеризующие общие свойства солей.
Порядок выполнения опытов:
1 опыт Взаимодействие сульфата меди (II) с гидроксидом натрия
2 опыт А) Взаимодействие хлорида бария с серной кислотой
Б) Взаимодействие карбоната натрия с серной кислотой
3 опыт Взаимодействие нитрата серебра и хлорида натрия
4 опыт Взаимодействие солей с металлами, стоящими в ряду напряжений
до водорода: сульфат меди (II) и железо;
сульфат железа (II) и медь.
После проведения опытов заполните таблицу:
| Что делали | Наблюдения | Уравнения реакции (молекулярное и ионное) |
| 1 |
|
|
| 2а |
|
|
| 2б |
|
|
| 3 |
|
|
| 4 |
|
|
Применение солей. (Презентация «Соли»). 

Подведение итогов
Домашнее задание: §41, упражнение № 1,5 стр. 225
Задача. Мы каждый день употребляем в пищу соль - хлорид натрия. Ученые подсчитали, что человек в день употребляет  15г соли. Рассчитайте, сколько соли съели вы за месяц, за год и за свою жизнь.
15г соли. Рассчитайте, сколько соли съели вы за месяц, за год и за свою жизнь.


















 15г соли. Рассчитайте, сколько соли съели вы за месяц, за год и за свою жизнь.
15г соли. Рассчитайте, сколько соли съели вы за месяц, за год и за свою жизнь. 









