Комплексные соединения
Цель урока: сформировать у учащихся представление о комплексных соединениях, продолжить работу по развитию умения составления формул химических соединений; воспитание трудолюбия.
Тип урока: усвоение новых знаний, урок-лекция.
Ход урока
Организационный этап
Приветствие, подготовка учащихся к уроку.
Актуализация опорных знаний, дать определения понятий:
- ковалентная связь
- катионы, анионы
- соли с точки зрения ТЭД
Сообщение темы и цели урока
Изучение новых знаний
Теорию комплексных (координационных) соединений разработал в 1893 г. швейцарский химик А. Вернер.
Состав комплексных соединений
| Внутренняя сфера (комплексный ион) в квадратных скобках | Комплексообразователь | Центральный ион, имеющий положительный заряд | атомы Ме Na3[AlF6] и неМе H2[SiCl6], чаще всего – атомы d-элементов |
| Лиганды | Противоположно заряженные ионы или полярные молекулы, которые удерживают (координируют) комплексообразователь | Гидроксид-ионы ОН- - гидроксокомплексы, анионы кислотных остатков Cl-, CN-, NO2- - ацидокомплексы, нейтральные молекулы NH3, H2O – аммикаты, аквокомплексы |
|
| Координационное число | Показывает, сколько лигандов связано с ионом- комплексообразователем | Чаще всего = 4 и 6. Как правило = удвоенному заряду (С.О.) иона-комплексообразователя. |
| Внешняя сфера | Ионы, которые непосредственно не связаны с ионом-комплексообразователем |
|
Например: в Na3[AlF6] 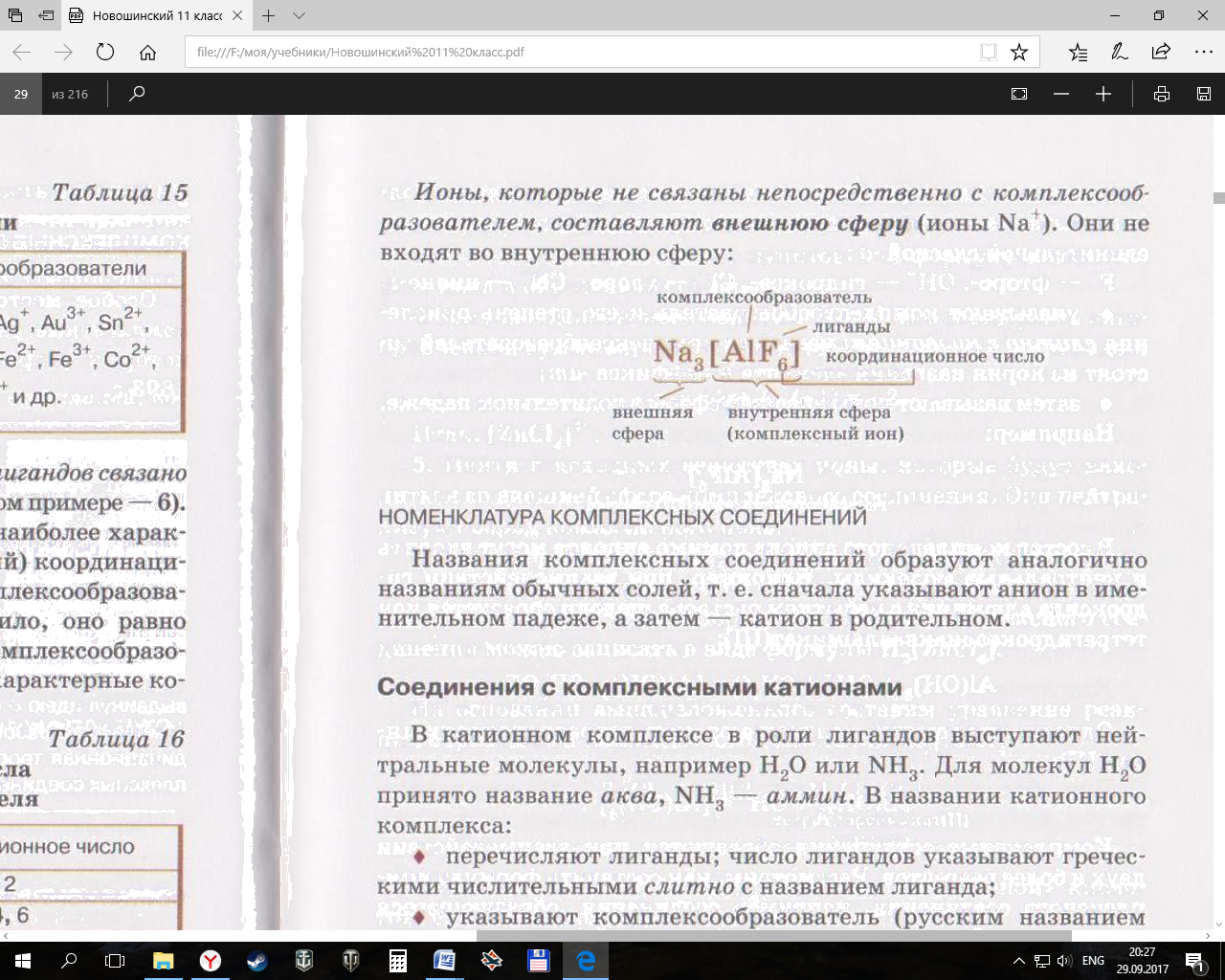
ион Al3+ - комплексообразователь,
ионы F- - лиганды,
координац. число = 6,
[AlF6]3- – внутренняя сфера (комплексный ион)
Заряд комп. иона =  .
.
Например: [AlF6]х ; х= +3 + 6*(-1) = -3
Если лиганды – нейтральные молекулы, то Заряд комп. иона = заряду иона-комплексообразователя.
[Ag+(NH3)20]x; х=+1+0*2=+1
Na+ - внешняя сфера
Номенклатура комплексных соединений
Название = анион (именит. падеж) + катион (род. падеж)
| Числительные 2- ди 3-три 4-тетра 5-пента 6-гекса | Названия лигандов |
| H2O - аква NH3 - амин СO - карбонил OН- - гидроксо СN- - циано | F- - фторо, Cl- - хлоро, Br- – бромо, I- – йодо, NO2- - нитро |
Соединения с комплексными катионами
Лиганды – нейтральные молекулы H2O - аква и NH3 – амин
В названии катионного комплекса:
- перечисляют лиганды, их число – греческими числительными слитно с названием гиганда;
- указывают комплексообразователь (русское название элемента в родительном падеже) и его с.о. слитно с названием:
[Al(H2O)6]Cl3 [Cu(NH3)4]SO4
Хлорид сульфат
гексаакваалюминия (III) тетраамминмеди (II)
Комплексные соединения – аквакомплексы и аммиакаты.
Соединения с комплексными анионами
Лиганды – анионы (отриц. Заряженные ионы)
В названии анионного комплекса:
- перечисляют лиганды – название соответствующего аниона + соединительная буква О:
F- - фторо, OH- - гидроксо, Cl- - хлоро, CN- - циано.
- указывают комплексообразователь и с.о. слитно с названием (корень латинского названия элемента + суффикс -ат): Al –алюминат, Cr – хромат, Fe – феррат Cu - купрат Ag - аргентат Au - аурат Hg - меркурат Zn – цинкат
- называют ионы внешней сферы в родительном падеже:
Na3[AlF6] гексафтороалюминат натрия
В состав комплексного аниона могут входить и нейтральные молекулы, например ион тетрагидроксодиакваалюминат(III) образуется в избытке щелочи:

Алгоритм составления формулы комплексного соединения
- найти комплексообразователь и определить его заряд (с.о.);
- определить координац. число – удвоить заряд комплексообразователя;
- найти лиганды;
- составить формулу комплексного иона (внешней сферы) и определить его заряд;
- найти в исходных веществах ионы внешней сферы (они нейтрализуют заряд комплексного иона
Например,
ZnCl2 + 2HCl = H2[ZnCl4] –тетрахлороцинкат (II) водорода, «травленая» кислота, используют для пайки.
Механизм образования комплексных соединений
Есть три теории. Две изучают в высшей школе.
Третья теория - Лиганды – доноры электронов, комплексообразователь – акцептор. Донорно-акцепторное взаимодействие неподеленных пар лигандов и свободных орбиталей иона-комплексообразователя.
Cu(OH)2 + 4NH3 = [Cu(NH3)4](OH)2 гидроксид тетраамминмеди (II)
При образовании связей доноры электронов – молекулы аммиака, т.к. у азота есть неподеленная пара электронов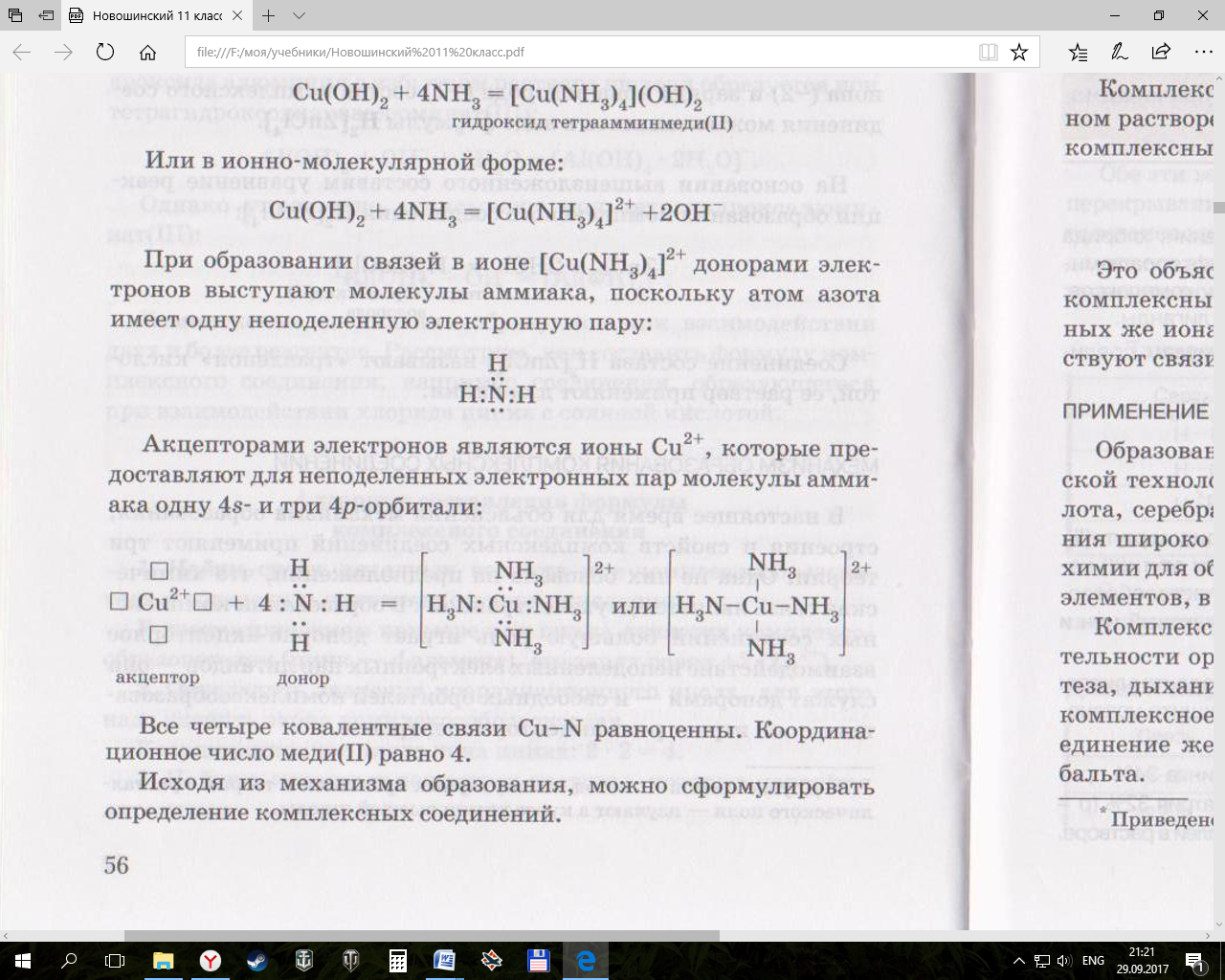
Акцепторы электронов – Cu2+, которые предоставляют свободные орбитали 4s и 4p. Все 4 связи Cu-N равноценны, координационное число меди = 4.

Итак, комплексные соединения – соединения, которые содержат хотя бы одну ковалентную связь, образованную по донорно-акцепторному механизму.
Диссоциация комплексных соединений
| Неэлектролиты – нет внешней сферы, не диссоциируют [Zn(NH3)2Cl2] | Электролиты – комплексные кислоты, соли, основания соль -K3[Fe(CN)6] – гексацианоферрат (III) калия (красная кровяная соль) кислота - H[AuCl4] – тетрахлороаурат водорода основание - Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия H2[SiF6] = 2H+ + [SiF6]- Между внешней сферой и комп. ионом - ионная связь |
Классификация комплексных соединений По знаку электрического заряда комплекса:
1) Катионные – имеют комплексный катион. [Ag(NH3)2]OH - гидроксид диамминсеребра (1)
2) Анионные – имеют комплексный анион.K4[Fe(CN)6]— гексацианоферрат(III) калия
3) Нейтральные – внутренняя сфера нейтральная. [Ni(CO)4] тетракарбонилникель
Значение комплексных соединений
В аналитической химии.
В металлургии (для получения золота, платины, урана).
В качестве красителей, дающих прочные покрытия.
Их используют для очистки природных и сточных вод.
Комплексными соединениями являются два вещества, без которых невозможна жизнь на земле животных и растений.
Двойные соли: металл + металл + кислотный остаток. Двойные соли называют, начиная с кислотного остатка и называют металлы образующие соль по порядку.
Домашнее задание: §10, №1-6 (эл)








 .
.











