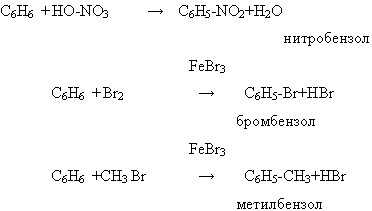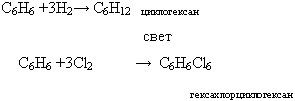Технологическая карта по химии на тему:
«Ароматические углеводороды, или арены»
Предмет: Химия
Класс: 10
УМК: Химия. О.С. Габриелян, И.Г. Остроумов, С.А. Сладков 10 класс
Тема: Ароматические углеводороды, или арены
Тип урока: урок изучения нового материала
Цель урока: Сформировать у обучающихся систему знаний об аренах, как об одном из гомологических рядов углеводородов; изучить: химические свойства, способы получения бензола, применение бензола на основе свойств.
Ход урока
I. Организационный момент
Приветствие, проверка готовности учащихся к уроку.
II. Актуализация знаний
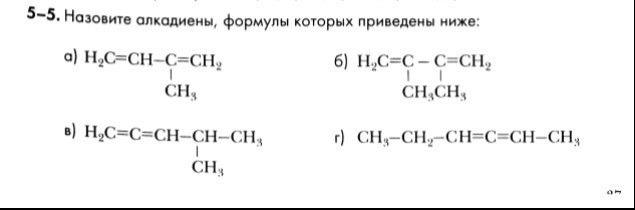
Ребята! Сегодня мы приступаем к изучению еще одного гомологического ряда углеводородов. Но прежде, чем начать изучение нового материала, вспомним материал прошлого урока (Алкадиены)
Задание: Назовите алкадиены, формулы которых приведены ниже.
Ⅲ. Изучение нового материала
Тема нашего урока – Ароматические углеводороды, или арены
Запишем тему урока в тетради.
Арены. Общая формула – СnН2n-6
Представитель – С6Н6 (бензол)
История открытия бензола
У бензола интересная история. Впервые бензол описал немецкий химик Иоганн Глаубер, который получил это соединение в 1649 году в результате перегонки каменноугольной смолы. Но названия вещество не получило, и состав его был неизвестен.
1825 г – Майкл Фарадей установил, что вещество состоит только из водорода и углерода, назвал его «карбюрированным водородом»
1833 г – Эйльгард Мичерлих определил эмпирическую формулу С6Н6 нагрел негашеную известь CaO с бензойной кислотой C6H5COOH (она содержится во многих ягодах, в частности, в клюкве и бруснике, и препятствует их гниению) и получил неизвестную, легкокипящую жидкость с резким запахом. Вот тогда и вспомнили об открытии Фарадея. Он назвал его "бензином".
Наиболее полно свойства бензола описал немецкий химик Фридрих Август Кекуле. Он же предложил циклическую формулу бензола в 1865 г.
Современное представление об электронной природе связей в бензоле основывается на гипотезе Лайнуса Полинга, который предложил изображать молекулу бензола в виде шестиугольника с вписанной окружностью, подчёркивая тем самым отсутствие фиксированных двойных связей и наличие единого электронного облака, охватывающего все шесть атомов углеродного цикла.
Плоскость в которой расположены атомы углерода, называется бензольным ядром или бензольным кольцом. Связь в бензольном ядре часто называют ароматической.
Попробуем сформулировать определение ароматических углеводородов или аренов.
Ароматические углеводороды, или арены — это углеводороды, в молекулах которых имеется одно или несколько бензольных колец.
После открытия бензола дискуссия о его строении велась в науке очень долго.
У углеводородов этого гомологического ряда исторически сложившееся название - ароматические, которое они получили из-за того, что представители имеют характерный запах (иногда приятный, иногда - нет.)
Физические свойства
Бензол Легкокипящая бесцветная жидкость, имеет специфический запах, не растворяется в воде, растворяется в органических растворителях, сам является растворителем.
При охлаждении легко застывает и превращается в белую кристаллическую массу с температурой плавления 5.5 °С.
Токсичен, опасен для окружающей среды, огнеопасен.
Биологическое действие
При непродолжительном вдыхании паров бензола не возникает немедленного отравления. В больших дозах бензол вызывает тошноту и головокружение, а в некоторых тяжёлых случаях отравление может повлечь смертельный исход. Первым признаком отравления бензолом нередко бывает эйфория. Пары бензола могут проникать через неповрежденную кожу. Если организм человека подвергается длительному воздействию бензола в малых количествах, последствия также могут быть очень серьёзными. В этом случае хроническое отравление бензолом может стать причиной лейкемии и анемии.
Наиболее эффективные средства их обезвреживания
Сам Бензол и его производные химически малоактивны, способны к аккумуляции в организмах животных, почвах, дерновом покрове, иле, мхе. Водную среду очищают обычно засыпая участок поражения большим количеством пористого сорбента - известняка, песчаника, доломитовой крошки и тп. Затем по возможности сорбент вычерпывают и захороняют. Почвы не очищают - их просто засыпают глинами или снимают верхний слой и опять засыпают.
Универсальных химических агентов обезвреживания ароматических углеводородов не существует.
Применение бензола
Бензол является важнейшим сырьем для химической промышленности, поскольку, он используется и как исходный реагент для синтеза самых разнообразных соединений, и как растворитель для других реакций (бензол растворяет практически все органические соединения, это своего рода «органическая вода»).
Химические свойства
а) ароматическая система, состоящая из 6 σ и единой 6р π связи обладает устойчивостью. Для аренов наиболее характерны реакции замещения, которые протекают легче, чем у предельных углеводородов и заканчиваются, как правило, замещением одного атома водорода. Замещение (галогенирование, нитрование, сульфирование, алкилирование) каталитическое и носит электрофильный характер.
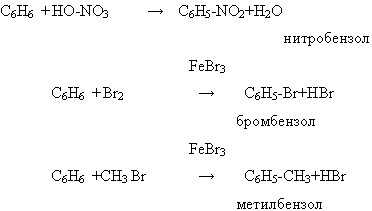
б) для бензола менее характерны реакции присоединения (хлорирования и гидрирования). Они проходят труднее, чем у непредельных углеводородов.
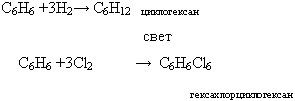
в) Бензол не обесцвечивает бромную воду (Вr2) и раствор перманганата калия (КМnO4) так как в молекулах аренов нет двойных связей.
г) Арены горят коптящим пламенем, так как массовая доля углерода высокая и составляет 92,3%.
Учащиеся делают вывод, что по химическим свойствам бензол занимает как бы промежуточное положение между предельными и непредельными углеводородами, т.к. вступают в реакции замещения и присоединения. Но реакции замещения у бензола идут легче, чем у предельных, а реакции присоединения – труднее, чем у непредельных углеводородов.
Изомерия
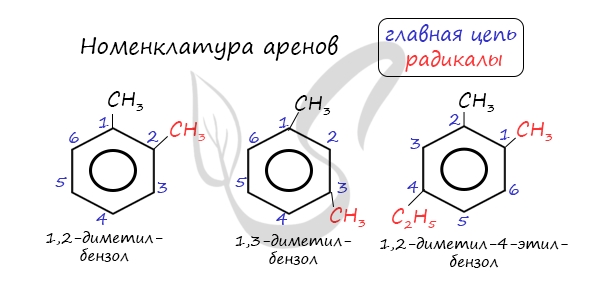
Для аренов характерна изомерия положения нескольких заместителей.
Названия аренов формируются путем добавления названий заместителей к главной цепи - бензольному кольцу: бензол, метилбензол (толуол), этилбензол, пропилбензол и т.д. Заместители, как обычно, перечисляются в алфавитном порядке.
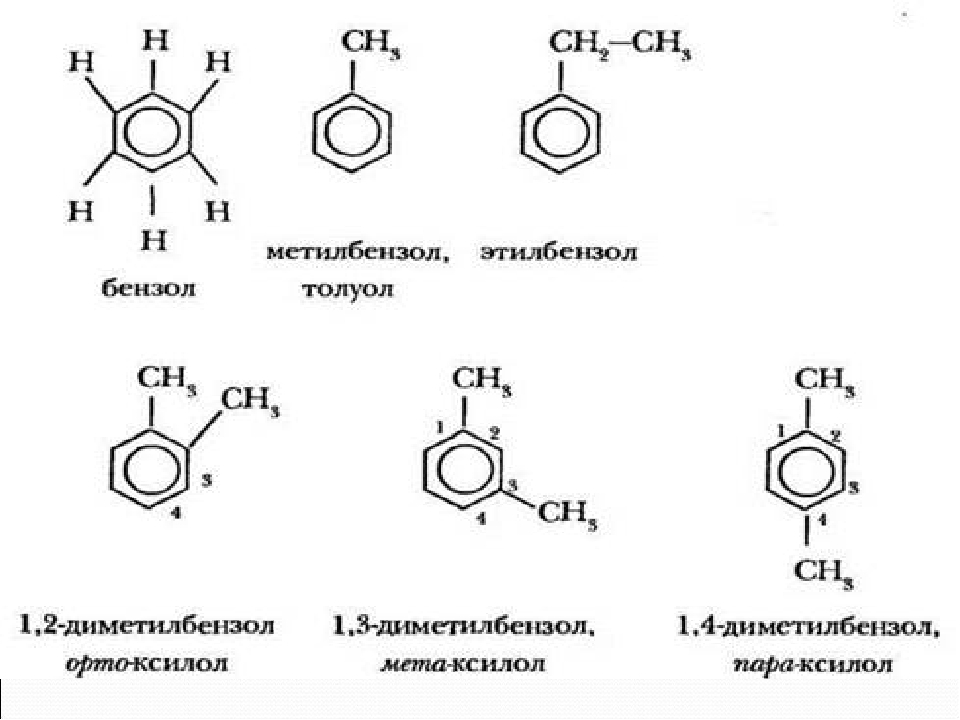
Если в бензольном кольце несколько заместителей, то выбирают кратчайший путь между ними.
Ⅳ. Закрепление и обобщение пройденного материала.
А сейчас давайте подведем итоги и попробуем вспомнить:
Какова общая формула гомологического ряда аренов?
Какова молекулярная формула бензола?
Имеет ли молекула бензола кратные связи, подобные двойным связям в молекулах алкенов?
Чему равен валентный угол в молекуле бензола?
Что такое ароматическая связь?
Ⅴ. Информация о домашнем задании: § 7, упражнение 4 на с.44 (письменно)
3