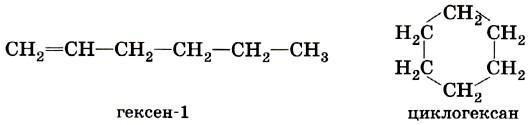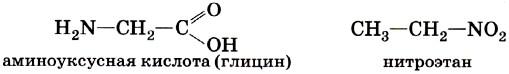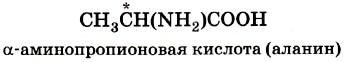Просмотр содержимого документа
«Разработка урока по химии в 10 классе "Теория строения органических соединений А.М. Бутлерова. Изомерия. Виды изомерии."»
10 класс
Урок №3.
Тема урока: Теория строения органических соединений А.М. Бутлерова. Изомерия. Виды изомерии.
Цели и задачи урока:
Образовательные: сформировать представления об основных видах изомерии и о самом явлении;
Развивающие: продолжить формирование знаний об органических веществах; формировать у учащихся образное мышление; развивать у учащихся умение сравнивать, анализировать и применять информацию из других областей знаний, развивать коммуникативные способности.
Воспитательные: способствовать воспитанию у учащихся активной жизненной позиции.
Здоровьесберегающие технологии: следить за осанкой учащихся; проводить упражнения для снятия напряжения глаз; проветривание помещения.
Оборудование: ИКТ
Ход урока:
Организационный момент.
Проверка знаний:

Основные положения теории строения органических веществ.
Ряд алканов.
Упр. 5,6 стр. 13
Основная часть. Виды изомерии.
- Структурная изомерия
Выделяют следующие разновидности структурной изомерии: изомерию углеродного скелета, изомерию положения, изомерию различных классов органических соединений (межклассовую изомерию).
1. Изомерия углеродного скелета обусловлена различным порядком связи между атомами углерода, образующими скелет молекулы. Как уже было показано, молекулярной формуле С 4 Н 10 соответствуют два углеводорода: н-бутан и изобутан. Для углеводорода С 5 Н 12 возможны три изомера: н-пентан, изопентан и неопентан.
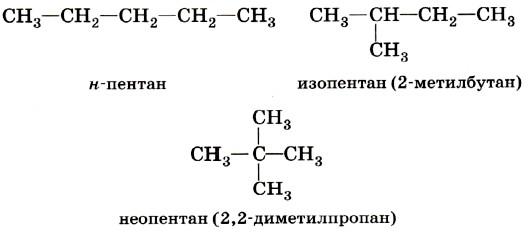
С увеличением числа атомов углерода в молекуле число изомеров быстро растёт. Для углеводорода С10Н22 их уже 75, а для углеводорода С20Н42 — 366 319.
2. Изомерия положения обусловлена различным положением кратной связи, заместителя, функциональной группы при одинаковом углеродном скелете молекулы.
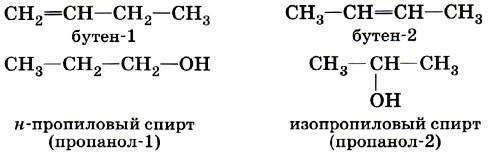
3. Изомерия различных классов органических соединений (межклассовая изомерия) обусловлена различным положением и сочетанием атомов в молекулах веществ, имеющих одинаковую молекулярную формулу, но принадлежащих разным классам.
А) Алкены и Циклоалканы
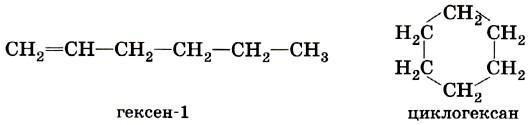
Б) Алкины и Диеновые

В) Простые эфиры и Спирты

Г) Альдегиды и Кетоны
Д) Карбоновые кислоты и Сложные эфиры
Е) Аминокислоты и Нитроалканы
Например, аминоуксусная кислота и нитроэтан, отвечающие молекулярной формуле C2H5NO2.
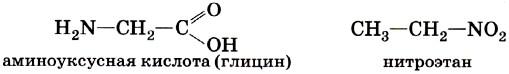
Изомеры этого типа содержат различные функциональные группы и относятся к разным классам веществ. Поэтому они отличаются по физическим и химическим свойствам значительно больше, чем изомеры углеродного скелета или изомеры положения.
- Пространственная изомерия
Пространственная изомерия подразделяется на два вида: геометрическую и оптическую.
1. Геометрическая изомерия характерна для соединений, содержащих двойные связи, и циклических соединений. Так как свободное вращение атомов вокруг двойной связи или в цикле невозможно, заместители могут располагаться либо по одну сторону плоскости двойной связи или цикла (цис-положение), либо по разные стороны (транс-положение). Обозначения цис и транс обычно относят к паре одинаковых заместителей.
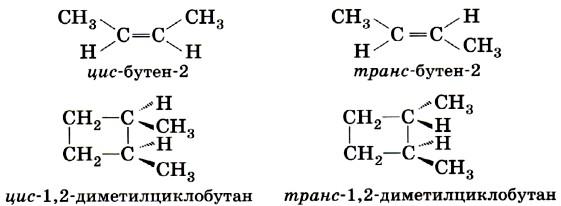
Геометрические изомеры различаются по физическим и химическим свойствам.
2. Оптическая изомерия возникает, если молекула несовместима со своим изображением в зеркале (рис. 7).

Это возможно, когда у атома углерода в молекуле четыре различных заместителя. Этот атом углерода называют асимметрическим и обозначают звёздочкой:
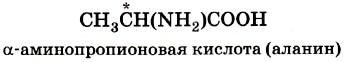
Закрепление: Составить возможные изомеры с общей формулой С6Н14. Дать им названия.
Д/з § 2, записи в тетради, по типу упр. 8 стр.23 (С6Н14); упр.10 стр. 22