Газовые законы
Тип урока: урок изучения и первичного закрепления новых знаний
Место урока: урок проводится в 10 классе после изучения основ МКТ газов и понятия температура.
Цели урока:
Обучающая:
Развивающая:
- развивать умение учащихся работать в группах
развивать навыки экспериментальной работы
развивать интеллектуальные умения: наблюдать, обобщать, анализировать и делать выводы
развивать качества личности: активность, самостоятельность, внимательность, критичность, желание рассуждать, объективность в оценках и самооценке.
Воспитывающая:
- воспитывать интерес к предмету;
- воспитывать дисциплинированность, ответственность;
- воспитывать умение слушать товарищей, аргументировать свою точку зрения;
Оборудование и оснащение урока:
Цилиндр переменного объема (сильфон), манометр, трубка резиновая, сосуд с горячей водой;
Стеклянная трубка, запаянная с одного конца; цилиндрический сосуд, наполненный горячей водой (t~60°С); стакан с водой комнатной температуры; пробка, линейка, термометр.
Методы обучения:
- по степени самостоятельности ученика в приобретении знаний – репродуктивный, частично-поисковый, исследовательский;
- по способу подачи школьникам учебной информации – словесные, наглядные, практические;
- по способу организации мышления – индуктивный, дедуктивный.
Дидактическая цель урока: ввести понятие «изопроцесс», изучить газовые законы
--------------------------------------------------------------------------------------------------------------------------
Актуализация знаний (мотивационный этап):
1. Что является объектом изучения МКТ? (Идеальный газ.)
2. Что в МКТ называется идеальным газом? (Идеальный газ – это газ, в которомвзаимодействием между молекулами можно пренебречь.)
3. Для того чтобы описать состояние идеального газа, используют тритермодинамических параметра. Какие? (Давление, объем и температура.)
4. Какое уравнение связывает между собой все три термодинамических параметра?(Уравнение состояния идеального газа – Уравнение Менделеева-Клапейрона).
5. Как записывается уравнение состояния ИГ? ( )
)
------------------------------------------------------------------------------------------------------------------------------
Итак, мы отметили, что уравнение состояния идеального газа связывает между собой три макроскопических параметра: р, Т и V.
А при любых ли процессах изменяютсявсе эти параметры?
Рассмотрим изменение параметров воздуха на примерах.
- при сжатии мяча(уменьшении его объема) давление увеличивается (T=const)
- при нагревании мяча на солнце воздух расширяется (p=const);
- при нагревании воздуха давление увеличивается (V=const).
Теперь мы знаем, что существуют процессы, при которых отдельные макроскопические параметры сохраняются.
Рассмотрим каждый из представленных процессов подробнее и установим для каждого из них связь между Т, р и V.
-------------------------------------------------------------------------------------------------------------------------------
«Сегодня на уроке нам необходимо:
а) изучить процессы, в которых масса газа и один из трех параметров остаются неизменными;
б) выявить их особенности;
в) вывести формулы, описывающие эти процессы;
г) экспериментально подтвердить или опровергнуть эти законы, т.к. согласно А. Эйнштейну -
«Истина – это то, что выдерживает проверку опытом»
И тема нашего сегодняшнего урока – «Газовые законы»
Изучение нового материала:
Процесс, при котором масса газа и один из его термодинамических параметров остаются неизменными называется изопроцессом.
Чтобы лучше запомнить названия изопроцессов, составим схему:
терма, Т
ИЗО бара, Р
хора, V
Количественные зависимости между двумя параметрами газа одной и той же массы при неизменном значении третьего параметра называют газовыми законами.
Используя уравнение состояния идеального газа, можно вывести все три закона за 10 минут.
Но в истории физики эти открытия были сделаны в обратном порядке: сначала экспериментально были получены газовые законы, и только потом они были обобщены в уравнение состояния. Этот путь занял почти 200 лет: первый газовый закон был получен в 1662 году Бойлем и Мариоттом, уравнение состояния – в 1834 году Клапейроном, а более общая форма уравнения – в 1874 году Д.И. Менделеевым.
----------------------------------------------------------------------------------------------------------
Изотермический процесс
Изотермический процесс – это процесс, происходящий в системе при постоянной температуре (T = const).
Математическая зависимость между параметрами этого процесса была установлена двумя учеными Робертом Бойлем (1662 г) и Эдмом Мариоттом (1676) и получила название закона Бойля-Мариотта.
Закон Бойля-Мариотта – при неизменной температуре произведение объема данной массы газа на его давление является величиной постоянной.
pV = constпри T = const
Из закона Бойля–Мариотта следует, что при постоянной температуре газа его давление обратно пропорционально объему.
При увеличении объема газа в 2 раза его давление уменьшается тоже в 2 раза.
Для двух состояний газа можно записать выражениеp1V1=p2V2
Закон Бойля – Мариотта справедлив для любых газов, а также и для их смесей, например для воздуха. Лишь при давлениях, в несколько сотен раз больше атмосферного, отклонения от этого закона становятся существенными.
Изотермическим можно приближенно считать процесс медленного сжатия воздуха или расширения газа под поршнем насоса при откачке его из сосуда. Правда температура газа при этом меняется, но в первом приближении этим изменением можно пренебречь.
Зависимость давления газа от объема при постоянной температуре графически изображается кривой, которая называется изотермой.
Разным постоянным температурам соответствуют разные изотермы. Изотерма соответствующая более высокой температуре лежит выше изотермы соответствующей более низкой температуре.

Объясним этот процесс с точки зрения молекулярно – кинетической теории:
При разрежении газа, то есть увеличении объема, молекулы располагаются дальше друг от друга, уменьшается их концентрация в сосуде. Поэтому они реже ударяют о стенки сосуда, и от этого давление газа уменьшается.
А при сжатии газа, то есть уменьшении его объема, молекулы располагаются ближе друг к другу, увеличивается их концентрация в сосуде. Поэтому они чаще ударяют о стенки сосуда, и от этого давление газа увеличивается.
----------------------------------------------------------------------------------------------------------
Изобарный процесс
Изобарный процесс – это процесс, происходящий в системе при постоянном давлении (p = const).
Математическая зависимость между параметрами этого процесса была установлена французским физиком и химиком Жозефом Луи Гей-Люссаком (1802 г) и получила название закона Гей-Люссака.
Закона Гей-Люссака– при неизменном давлении отношение объема данной массы газа к его температуре является величиной постоянной.
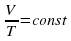 при T = const
при T = const
Из закона Гей-Люссака следует, что при постоянном давлении газа его объем прямо пропорционален температуре.
При увеличении температуры газа в 4 раза, его объем увеличится тоже в 4 раза.
Для двух состояний газа можно записать выражение 
Закон Гей-Люссака справедлив не только для воздуха, но и для других газов и паров. (На самом деле пары, весьма приближенно, подчиняются газовым законам).
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
Зависимость объема тела от его температуры при постоянном объеме графически изображается прямой, которая называется изобарой.
Различным давлениям соответствуют разные изобары. Изобара соответствующая более высокому давлению, лежит ниже изобары, соответствующей более низкому давлению.
Объясним этот процесс с точки зрения молекулярно – кинетической теории:
При нагревании газа увеличивается скорость движения молекул, которые при столкновении друг с другом разлетаются на большие расстояния, то есть происходит увеличение объема газа.
При охлаждении – понижении температуры, уменьшается скорость движения молекул, что приводит к уменьшению расстояния между молекулами, так как они уже не могут разлетаться на большие расстояния и объем газа уменьшается.
----------------------------------------------------------------------------------------------------------
Изохорный процесс
Изохорный процесс – это процесс, происходящий в системе при постоянномобъеме (V = const).
Математическая зависимость между параметрами этого процесса получила название закона Шарля.
В 1787 году французский ученый Жак Шарль измерял давление различных газов при нагревании при постоянном объеме и установил линейную зависимость давления от температуры, но не опубликовал исследования. Через 15 лет к таким же результатам пришел и Гей-Люссак и, будучи на редкость благородным, настоял, чтобы закон назывался в честь Шарля.
Закон Шарля – при неизменном объеме отношение давления данной массы газа к его температуре является величиной постоянной.
 приT = const
приT = const
Из закона Шарля следует, что при постоянном объеме газа его давление прямо пропорционально температуре.
При увеличении объема газа в 2 раза его давление уменьшается тоже в 2 раза.
Для двух состояний газа можно записать выражение
Закон Шарля справедлив только для идеального газа. Он применим с определенной степенью точности к реальным газам при низких давлениях и невысоких температурах (например, атмосферный воздух, продукты сгорания в газовых двигателях и пр.)
Изохорным можно считать увеличение давления газа в любой емкости или в электрической лампочке при нагревании.
Зависимость давления газа от его температуры при постоянной объеме графически изображается кривой, которая называется изохорой.
Разным объемам соответствуют разные изохоры. Изохора, соответствующая большему объему, располагается ниже изохоры, соответствующей меньшему объему.
Объясним этот процесс с точки зрения молекулярно – кинетической теории:
При нагревании газа увеличивается скорость движения молекул, которые сильнее ударяют о стенки сосуда, что приводит к увеличению давления.
А при охлаждении скорость движения молекул уменьшается, следовательно, они реже и слабее ударяют о стенки сосуда, что приводит к уменьшению давления.
-----------------------------------------------------------------------------------------------------------------------
Исследование зависимости p от V при T=cons.
Оборудование: цилиндр переменного объема (сильфон), манометр, трубка резиновая.
Опыт:
Для проведения опыта соединяют цилиндр резиновой трубкой с манометром как показано на рисунке. Открывают у манометра оба крана и с помощью винта растягивают или сжимают цилиндр. Затем закрывают свободный кран манометра и приступают к демонстрации.
Несколько раз медленно изменяют объем воздуха в приборе и наблюдают за показаниями манометра.
Убеждаются, что с уменьшением V тела р соответственно увеличивается, а с увеличением V тела р соответственно уменьшается.Зависимость обратно пропорциональная ( ).
).
Ответьте на вопросы:
1. Зависимость между какими величинами вы наблюдали на опыте?
2. Изменялась ли температура и масса воздуха во время опыта?
3. Что можно сказать о зависимости давления от объема?
4. Обьясните происходящее явление с точки зрения МКТ.
----------------------------------------------------------------------------------------------------------------------
Исследование зависимости V от Tпри p=cons.
Оборудование: Стеклянная трубка, запаянная с одного конца; цилиндрический сосуд, наполненный горячей водой (t~60°С); стакан с водой комнатной температуры; пробка, линейка, термометр.
Опыт:
1. Стеклянной трубку поместить открытым концом вверх в сосуд с горячей водой на 3-5 минут.
2. Закройте открытый конец трубки пробкой, чтобы масса газа не изменялась.
3. Отпустите трубку закрытым концом в стакан с водой комнатной температуры и под водой снимите пробку.
4. Дождитесь прекращения подъема воды в трубке (трубка охлаждается).
5. Убедитесь, что длина воздушного столба в трубке стала меньше
Убеждаются, что с уменьшением T тела V объем также уменьшается, а с увеличением T тела Vсоответственно увеличивается. Зависимость прямо пропорциональная ( ).
).
Ответьте на вопросы:
1. Зависимость между какими величинами вы наблюдали на опыте?
2. Изменялось ли давление и масса воздуха во время опыта?
3. Что можно сказать о зависимости объема от температуры?
4. Обьясните происходящее явление с точки зрения МКТ.
Исследование зависимости p от T при V=cons.
Оборудование: цилиндр переменного объема (сильфон), манометр, трубка резиновая, сосуд с горячей водой.
Опыт:
Для проведения опыта соединяют цилиндр резиновой трубкой с манометром как показано на рисунке. Открывают у манометра оба крана и с помощью винта сжимают цилиндр. Затем закрывают свободный кран манометра.
Ставим в цилиндр в сосуд. И наливаем в сосуд кипяток. По мере нагревания воздуха, о чем судят по демонстрационному термометру, наблюдают по манометру постепенное увеличение давления в цилиндре.
Убеждаются, что с увеличениемT тела р соответственно увеличивается, а с уменьшением T тела р соответственно уменьшается. Зависимость прямо пропорциональная ( T).
T).
Ответьте на вопросы:
1. Зависимость между какими величинами вы наблюдали на опыте?
2. Изменялась ли температура и масса воздуха во время опыта?
3. Что можно сказать о зависимости давления от объема?
4. Обьясните происходящее явление с точки зрения МКТ.
--------------------------------------------------------------------------------------------------------------------
Тест по теме «Газовые законы»
1.Какое уравнение описывает состояние идеального газа?
A. p=n·k·TB.  C. T=t+273D.
C. T=t+273D. 
2.Процесс, протекающий при неизменном значении одного из параметров, называют …
A. Плавление B. Испарение C. Изопроцесс D. Нагревание
3. Процесс изменения состояния термодинамической системы при постоянном давлении называется
A. Изотермическим. B.Изобарным. C. Изохорным.
4. Изохорным процессом называется процесс изменения состояния термодинамической системы при постоянном
A. Давлении. B. Температуре. C. Объёме. D. Массе.
5. Процесс изменения состояния термодинамической системы при постоянной температуре называют …
A. Изотермический B. Изобарный C. Изохорный
6. Каким законом описывается изотермический процесс?
A. Гей–ЛюссакаB. Шарля C. Бойля–Мариотта D. Клапейрона
7. Каким законом описывается изобарный процесс?
A. Гей–ЛюссакаB. Шарля C. Бойля–Мариотта D. Клапейрона
8. Каким законом описывается изохорный процесс?
A. Гей–ЛюссакаB. Шарля C. Бойля–Мариотта D. Клапейрона
9.Уравнением изотермического процесса для данной массы идеального газа является:
A.  B.
B.  C.
C.  D.
D. 
10. Уравнением изобарного процесса для данной массы идеального газа является:
A.  B.
B.  C.
C.  D.
D. 
11. Уравнением изохорного процесса для данной массы идеального газа является:
A.  B.
B.  C.
C.  D.
D. 
----------------------------------------------------------------------------------------------------------------------
Домашнее задание:
§ 69
Подготовить доклады:
Биография Роберта Бойля
Биография Эдма Мариотта
Биография Жозефа Луи Гей-Люссака
Биография Жак Шарля
----------------------------------------------------------------------------------------------------------------------------------------------------------







 )
)
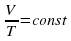 при T = const
при T = const

 приT = const
приT = const


 ).
).
 ).
). T).
T).
 B.
B.  C.
C.  D.
D. 



















