Разработка урока
по химии
9 класс
Тема «Сероводород. Сульфиды.»
Автор:
учитель химии и биологии
МБОУ СОШ №11
Гашева С.А.
Ходзь, 2021г
Тема урока: Сероводород. Сульфиды.
“И у природы есть всему свой срок
И осени пора и бурного цветенья
И химии не кончится урок
Жизнь будет ее вечным продолжением”
Определить смысл этих строк.
Цели урока:
Образовательные:
– Рассмотреть состав, строение и свойствасероводорода.
- Научиться писать уравнения реакций, характеризующие свойства сероводорода и качественные реакции на сульфиды.
– Рассмотреть влияние сероводорода на окружающую среду и здоровье человека.
Развивающие:
- Уметь применять полученные знания для объяснения разнообразных химических явлений и свойств веществ.
- Уметь применять дополнительный материал из информационных источников, компьютерных технологий
- Использовать приобретенные знания и умения в практической деятельности и повседневной жизни: а) экологически грамотного поведения в окружающей среде; б) оценки влияния химического загрязнения окружающей среды на организм человека.
Воспитательные:
– Бережное отношение учащихся к окружающей среде и своему здоровью.
- Воспитание умения работать в парах при самоанализе контрольных срезов, тестов.
Задачи урока:
Изучить состав, строение и свойства, способы получения сероводорода и сульфидов;
Проследить причинно-следственную связь между строением, свойствами и применением веществ;
Рассмотреть влияние сероводорода на окружающую среду и здоровье человека;
Закрепить умения составлять УХР и рассматривать их с точки зрения окислительно-восстановительных процессов;
Содействовать развитию химической грамотности учащихся.
Межпредметные связи:Связь химии с другими науками: биологией, географией, математикой, медициной и литературой.
Оборудование,реактивы и материалы: растворы сульфида натрия, ацетата (нитрата) свинца, сульфата цинка, хлорида магния, сульфата железа(II).
Учебники: Н.Е.Кузнецовой, О.С. Габриеля, Занимательная химия Л.Ю. Аликберовой.
Ход урока I. Организационный момент. 1. Актуализация опорных знаний
1.Фронтальная беседа:
– Опишите физические свойства серы.
– Поясните сущность аллотропии. Каковы причины аллотропии у серы? Каковы причины аллотропии у кислорода?
– В природе сера встречается где? Перечислите, какие природные соединения серы вы знаете?
2.Вопрос учащимся у доски:
– Какие степени окисления имеет сера в каждом из этих соединений?
H2SO4, SCl4, SCl2O, CS2, K2SO4, SF6, SO2, Na2S, SCl2O2,
+6 +4 +4 -2 +6 +6 +4 -2 +6
– Как взаимодействует сера с металлами?
– Как взаимодействует сера с неметаллами?
– В каких случаях сера выступает как окислитель, а в каких– как восстановитель?
Задание всему классу: Напишите взаимодействие серы и водорода, укажите окислитель и восстановитель.
2. Мотивация к учебной деятельности
Я всюду есть – но понемножку,
Черню серебряную ложку.
Когда испорчено яйцо,
Я тоже сразу налицо
Я отбиваю аппетит
И очень сильно ядовит.
А еще помните строки у А.С. Пушкина, написанные в 1832 году в стихотворении «И далее мы пошли – и страх обнял меня»:
«… Тогда услышал я (о, диво!) запах скверный,
Как будто тухлое разбилося яйцо…»
О каком соединении упоминает Пушкин в отрывке этого стиха?
А как вы догадались, что это сероводород?
А что пока неизвестно вам из свойств сероводорода?
II. Изучение нового материала
1.введение в тему: Итак, тема урока сегодня – сероводород
Записываем в тетради тему «Сероводород. Сульфиды».
Изучить состав, строение и свойства, способы получения сероводорода и сульфидов;
Проследить причинно-следственную связь между строением, свойствами и применением веществ;
Рассмотреть влияние сероводорода на окружающую среду и здоровье человека;
Закрепить умения составлять УХР и рассматривать их с точки зрения окислительно-восстановительных процессов;
Содействовать развитию грамотности учащихся.
При изучении нового материала учащиеся заполняют таблицу:
| Свойства | Сероводород |
| 1.Химическая формула вещества |
|
| 2.Тип химической связи |
|
| 3.Агрегатное состояние при н.у. |
|
| 4.Цвет |
|
| 5.Легче или тяжелее воздуха (подтвердить расчётами) |
|
| 6.Запах |
|
| 7.Растворимость в воде |
|
| 8.Физиологическое действие |
|
| 9.Нахождение в природе |
|
| 10.Получение в лаборатории (уравнение реакции) |
|
| 11.Химические свойства сероводорода |
|
| 12.Свойства водного раствора сероводорода |
|
| 13.Качественная реакция на сульфид -ионы |
|
| 14.Применение |
|
| 15.Загрязнение окружающей среды |
|
2.Учащихся разбиваю на группы для выполнения заданий и заполнения соответствующих строк (пунктов) в таблиц:
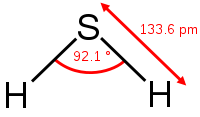
 Вопросы 1 – 3, 15 прорабатывает одна группа; пункты 4 – 8 вторая; 9 - 11 третья и 12 – 14 четвертая. Школьники работают с учебниками Н.Е.Кузнецовой стр. 79 – 84, § 18; О.С. Габриеля на стр.100 – 101 § 22; Занимательная химия Л.Ю. Аликберовой стр. 268 – 272.Учащиеся изучают материал, заносят сведения в свои листочки и в шаблон на компьютере.
Вопросы 1 – 3, 15 прорабатывает одна группа; пункты 4 – 8 вторая; 9 - 11 третья и 12 – 14 четвертая. Школьники работают с учебниками Н.Е.Кузнецовой стр. 79 – 84, § 18; О.С. Габриеля на стр.100 – 101 § 22; Занимательная химия Л.Ю. Аликберовой стр. 268 – 272.Учащиеся изучают материал, заносят сведения в свои листочки и в шаблон на компьютере.
3. анализ проделанной работы. Ученики знакомят своих товарищей с тем материалом, который они подготовили, обсуждаем, дополняем, заносим в свои таблицы недостающее. Вот что должно получится.(см. готовую таблицу)
| Свойства | Сероводород |
| 1.Химическая формула вещества | H2S |
| 2.Тип химической связи |  ковалентная полярная ковалентная полярная
|
| 3.Агрегатное состояние при н.у. | ядовитый газ |
| 4.Цвет | безцветный |
| 5.Легче или тяжелее воздуха (подтвердить расчётами) | тяжелее воздуха: Mrвозд. = 29 Mr(H2S) = 34; 34: 29 = 1,17 |
| 6.Запах | неприятный запах тухлых яиц |
| 7.Растворимость в воде | имеет невысокую растворимость |
| 8.Физиологическое действие | Очень токсичен. Вдыхание воздуха с содержанием сероводорода вызывает головокружение, головную боль, тошноту, а со значительной концентрацией приводит к коме, судорогам, отёку лёгких и даже к летальному исходу. При высокой концентрации однократное вдыхание может вызвать мгновенную смерть. При небольших концентрациях довольно быстро возникает адаптация к неприятному запаху «тухлых яиц», и он перестаёт ощущаться. Во рту возникает сладковатый металлический привкус. При большой концентрации ввиду паралича обонятельного нерва запах сероводорода не ощущается. Разрушается гемоглобин:кровь не может переносить кислород Н2S + Fe2+= FeS↓ + 2H+ |
| 9.Нахождение в природе | Встречается в природе в составе нефти, природного газа, вулканического газа и в горячих источниках. Он образуется при гниении растительных и животных организмов |
| 10.Получение в лаборатории (уравнение реакции) | H2 + S = H2S FeS + HCl = FeCl 2 2 + H2S↑ |
| 11.Химические свойства сероводорода | H2S – восстановитель 2H2S + О2 = 2SO2 + 2H2O 2H2S + О2 = 2S + 2H2O 2H2S + SО2 = 3S + 2H2O |
| 2.Свойства водного раствора сероводорода | Кислотные свойства H2S + 2NaOH = Na2S + 2H2O H2S + NaOH = NaHS + H2O |
| 13.Качественная реакция на сульфид -ионы | Na2S + Pb(NO3)2 = 2NaNO3 + PbS↓ черный 2Na+ + S2– + Pb2+ + 2NO3– = 2Na+ + 2NO3– + PbS↓ S2– + Pb2+ = PbS↓ (Na2S + CuCl2 → CuS↓ + 2HCl) осадок черного цвета
|
| 14.Применение | Сероводород из-за своей токсичности находит ограниченное применение. В аналитической химии сероводород и сероводородная вода используются как реагент для осаждения тяжёлых металлов, сульфиды которых очень слабо растворимы В медицине — в составе сероводородных ванн Сероводород применяют для получения серной кислоты, элементной серы, сульфидов В последние годы рассматривается возможность использования сероводорода, накопленного в глубинах Чёрного моря, в качестве энергетического и химического сырья. |
| 15.Загрязнение окружающей среды | Ядовитость сероводорода часто недооценивают и работы с ним ведут без соблюдения достаточных мер предосторожности. Между тем уже 0,1 % Н2S в воздухе быстро вызывает тяжелое отравление. Предельно допустимая концентрация (ПДК) Н2S в атмосферном воздухе 8 мг/м3 |
Вывод: Раствор H2S в воде – слабая двухосновная кислота.
Сероводородная кислота образует два ряда солей - средние (сульфиды) и кислые (гидросульфиды):
4. ознакомление с сульфидами:
А)Работа с учебником
- Прошу найти в таблице растворимости сульфиды и дать им характеристику. (В воде растворимы сульфиды только щелочных, щелочноземельных металлов и аммония, остальные не растворимы.)
Вызываю сильного ученика к доске и прошу составить формулы некоторых солей: гидросульфида натрия NaHS, сульфида натрия Na2S, гидросульфида барияBa(HS)2
Б)Лабораторный опыт: Качественная реакция на сульфиды, определение S2- в растворах Цель: научиться определять анионы S2- в растворах.
Реактивы и оборудование: растворы: сульфида металла, сульфата меди; нитрата свинца; хлорида цинка; сульфата марганца; сульфата кадмия; стеклянные трубочки, предметное стекло, стеклянные палочки.
Последовательность выполнения опыта.
На 4 предметных стекла нанести по 1 капли раствора S2-.
Добавить по 1 капли по очереди на каждое стекло к сульфиду натрия растворы CuSO4, ZnCl2, MnSO4, CdSO4
Отметьте характерный признак реакции.
Составьте уравнения реакций в молекулярном и ионном виде.
Оформите отчёт по работе и сделайте выводы.
Pb(NO3)2 + Na2S → PbS↓ + 2NaNO3
осадок черного цвета
(Na2S + CuSO4 → CuS↓ + Na2SO4
осадок черного цвета
ZnCl2 + Na2S → ZnS↓ + 2NaCl
осадок белого
MnSO4 + Na2S → MnS ↓ + Na2SO4
осадок розового цвета
CdSO4 + Na2S → CdS↓ + Na2SO4
осадок желтого цвета
написать полное ионное и краткое ионное уравнение
Многие сульфиды окрашены и нерастворимы в воде: PbS – черный, CdS – желтый, ZnS – белый, MnS – розовый, CuS – черный, NiS – черный.

III. Рефлексия.
1.Создаю условия для заключительной рефлексии:
- Что узнали нового для себя?
- Остались ли вопросы, на которые вы хотите получить ответ?
- Понравился урок или нет
2.анализ эпиграфа в начале урока
Вернемся к эпиграфу в начале урока. В чем же смысл строчек, приведенных перед изучением темы?
Смысл этих строк заключается в том, что знания, полученные на уроках химии, биологии, а также других предметов пригодятся вам в жизни, при выборе профессии. Ведь так много профессий тесно связанных и с химией и биологией. Это профессия медика, биолога, эколога, нефтяника и так далее. Поэтому ваша задача – уметь применять свои знания, использовать их в дальнейшей жизни.
IV. Домашнее задание.§ 18








 Вопросы 1 – 3, 15 прорабатывает одна группа; пункты 4 – 8 вторая; 9 - 11 третья и 12 – 14 четвертая. Школьники работают с учебниками Н.Е.Кузнецовой стр. 79 – 84, § 18; О.С. Габриеля на стр.100 – 101 § 22; Занимательная химия Л.Ю. Аликберовой стр. 268 – 272.Учащиеся изучают материал, заносят сведения в свои листочки и в шаблон на компьютере.
Вопросы 1 – 3, 15 прорабатывает одна группа; пункты 4 – 8 вторая; 9 - 11 третья и 12 – 14 четвертая. Школьники работают с учебниками Н.Е.Кузнецовой стр. 79 – 84, § 18; О.С. Габриеля на стр.100 – 101 § 22; Занимательная химия Л.Ю. Аликберовой стр. 268 – 272.Учащиеся изучают материал, заносят сведения в свои листочки и в шаблон на компьютере.


















