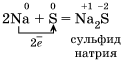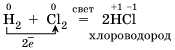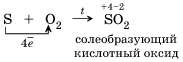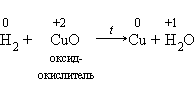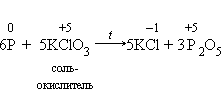Тема: Неметаллы
Цель: Обобщить знания обучающихся о положении неметаллов в ПС Д.И. Менделеева, характерных особенностях строения атомов неметаллов, закрепить понятие аллотропных модификаций. Систематизировать сведения о химических свойствах неметаллов.
Задачи:
Образовательная: Сформировать представление о группе неорганических веществ- неметаллах.
Развивающая: Совершенствовать интеллектуальные умения (анализ, прогнозирование, умения устанавливать причинно-следственные связи).
Воспитательная:
Продолжить формирование ценностного отношения к исследовательской деятельности как основному способу получения знаний в химии.
Тип урока: лекция с элементами беседы
Оборудование: презентация «Неметаллы», таблица Д. И. Менделеева, образцы простых веществ-неметаллов.
Межпредметные связи: биология (органические соединения клетки)
Ход занятия:
1.Этап организации урока.
2.Проверка домашнего задания:
-Что такое металлургия, металлургический процесс?
-Какие способы получения металлов вам известны?
-В чем сущность электролиза Ме?
-Где применяется электролиз растворов и расплавов?
Задача: К раствору, содержащему 27г хлорида меди(II) , добавили 14г железных опилок. Какая масса меди выделилась в результате этой реакции?
Ответ: 12,8г.
О


 существить превращения: медь нитрат меди(II) гидроксид меди(II) оксид меди(II) медь хлорид меди
существить превращения: медь нитрат меди(II) гидроксид меди(II) оксид меди(II) медь хлорид меди
3.Этап подготовки к восприятию нового материала.
4. Объяснение нового материала:
Химические элементы-неметаллы
Неметаллы – это химические элементы, для атомов которых характерна способность принимать электроны до завершения внешнего слоя.
Все элементы-неметаллы (кроме водорода) занимают в Периодической системе химических элементов Д. И. Менделеева верхний правый угол, образуя треугольник, вершиной которого является фтор F, а основанием диагональ – В–At. Однако следует особо остановиться на двойственном положении водорода в Периодической системе: в I и VII группах главных подгрупп. Это не случайно. С одной стороны, атом водорода, подобно атомам щелочных металлов, имеет на внешнем (и единственном для него) электронном слое один электрон (электронная конфигурация 1s1), который он способен отдавать, проявляя свойства восстановителя.
В большинстве своих соединений водород, как и щелочные металлы, проявляет степень окисления +1. Но отдача электрона атомом водорода происходит труднее, чем у атомов щелочных металлов. С другой стороны, атому водорода, как и атомам галогенов, для завершения внешнего электронного слоя недостает одного электрона, поэтому атом водорода может принимать один электрон, проявляя свойства окислителя и характерную для галогена степень окисления -1 в гидридах – соединениях с металлами, подобных соединениям металлов с галогенами – галогенидам. Но присоединение одного электрона к атому водорода происходит труднее, чем у галогенов.
При обычных условиях водород Н2 – газ. Его молекула, подобно галогенам, двухатомна.
У атомов неметаллов преобладают окислительные свойства, то есть способность присоединять электроны. Эту способность характеризует значение электроотрицательности, которая закономерно изменяется в периодах и подгруппах (рис. 1).
Фтор – самый сильный окислитель, его атомы в химических реакциях не способны отдавать электроны, то есть проявлять восстановительные свойства
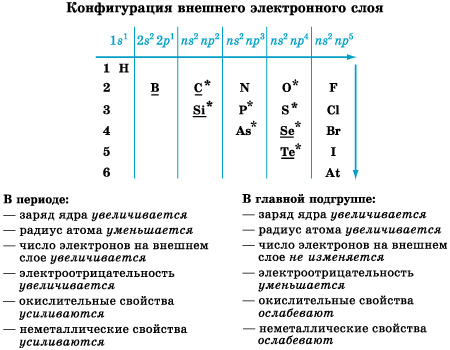
Рисунок 1.
Элементы-неметаллы и их свойства
Другие неметаллы могут проявлять восстановительные свойства, хотя и в значительно более слабой степени по сравнению с металлами; в периодах и подгруппах их восстановительная способность изменяется в обратном порядке по сравнению с окислительной.

Химических элементов-неметаллов всего 16! Совсем немного, если учесть, что известно 114 элементов. Два элемента-неметалла составляют 76 % от массы земной коры. Это кислород (49 %) и кремний (27 %). В атмосфере в содержится 0,03 % от массы кислорода в земной коре. Неметаллы составляют 98,5 % от массы растений, 97,6 % от массы тела человека. Шесть неметаллов – С, Н, О, N, Р и S – биогенные элементы, которые образуют важнейшие органические вещества живой клетки: белки, жиры, углеводы, нуклеиновые кислоты. В состав воздуха, которым мы дышим, входят простые и сложные вещества, также образованные элементами-неметаллами (кислород O2, азот N2, углекислый газ СО2, водяные пары Н2О и др.).
Водород – главный элемент Вселенной. Многие космические объекты (газовые облака, звезды, в том числе и Солнце) более чем наполовину состоят из водорода. На Земле его, включая атмосферу, гидросферу и литосферу, только 0,88 %. Но это по массе, а атомная масса водорода очень мала. Поэтому небольшое содержание его только кажущееся, и из каждых 100 атомов на Земле 17 – атомы водорода.
Простые вещества-неметаллы
Строение. Физические свойства
Как вам уже известно, простые вещества-неметаллы могут иметь:
Молекулярное строение. При обычных условиях большинство таких веществ представляют собой газы (Н2, N2, O2, F2, Cl2, О3) или твердые вещества (I2, Р4, S8) и лишь единственный бром (Br2) является жидкостью. Все эти вещества молекулярного строения, поэтому летучи.
Атомное строение. Эти вещества образованы длинными цепями атомов (Сn, Вn, Sin, Sen, Ten). Из-за большой прочности они имеют высокую твердость. Многие такие вещества имеют высокие температуры плавления и кипения, а летучесть их весьма мала. Многие элементы-неметаллы образуют несколько простых веществ – аллотропных модификаций. Это свойство атомов называют аллотропией. Аллотропия может быть связана и с разным составом молекул (О2, О3), и с разным строением кристаллов. Аллотропными модификациями углерода являются графит, алмаз, карбин, фуллерен (рис.2).
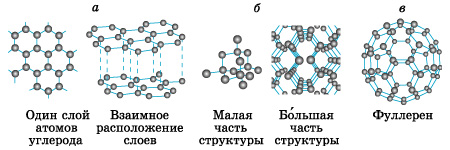
Рисунок.2.
Кристаллические структуры аллотропных модификаций углерода: а – графит, б – алмаз, в – фуллерен
Большинство неметаллов не имеют металлического блеска.
Химические свойства
Окислительные свойства простых веществ неметаллов
1)Окислительные свойства неметаллов проявляются в первую очередь при их взаимодействии с металлами
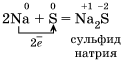
2)Окислительные свойства хлора Cl2 выражены сильнее, чем у серы, поэтому и металл Fe, который имеет в соединениях устойчивые степени окисления +2 и +3, окисляется им до более высокой степени окисления.

3)Большинство неметаллов проявляют окислительные свойства при взаимодействии с водородом. В результате образуются летучие водородные соединения.
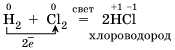
4)Электроотрицательность серы больше, чем у фосфора, поэтому она здесь проявляет окислительные свойства.
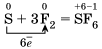
5)Электроотрицательность фтора больше, чем у всех остальных химических элементов, поэтому он проявляет свойства окислителя.
Восстановительные свойства простых веществ – неметаллов
При рассмотрении реакций неметаллов друг с другом мы уже отмечали, что в зависимости от значений их электроотрицательности один из них проявляет свойства окислителя, а другой – свойства восстановителя.
1)По отношению к фтору все неметаллы (даже кислород) проявляют восстановительные свойства. Разумеется, неметаллы, кроме фтора, служат восстановителями при взаимодействии с кислородом:
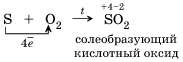
2).Многие неметаллы могут выступать в роли восстановителя в реакциях со сложными веществами-окислителями:
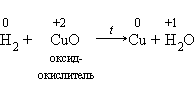
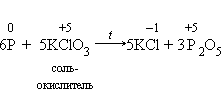
5.Закрепление пройденного материала:
-Охарактеризовать химические элементы- неметаллы.
-Охарактеризовать простые вещества-неметаллы
-Что собой представляют аллотропные модификации? Привести примеры.
-Какие свойства (окислительные или восстановительные) проявляют простые вещества – неметаллы? Привести примеры.
Дом. задание: конспект








 существить превращения: медь нитрат меди(II) гидроксид меди(II) оксид меди(II) медь хлорид меди
существить превращения: медь нитрат меди(II) гидроксид меди(II) оксид меди(II) медь хлорид меди