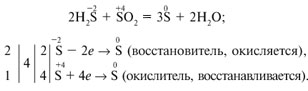МИНОБРНАУКИ РОССИИ
федеральное государственное бюджетное образовательное учреждения высшего образования
«ПЕРМСКИЙ ГОСУДАРСТВЕННЫЙ ГУМАНИТАРНО-ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ»
ЕСТЕСТВЕННОНАУЧНЫЙ Факультет
Кафедра анатомии, физиологии, химии и безопасности жизнедеятельности
Реферат
УЧЕНИЕ О ХИМИЧЕСКОМ ПРОЦЕССЕ: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ.
|
| Работу выполнила: обучающийся ZМ 622 группы, направленность (профиль) «Химия» Уросова Нина Сергеевна Преподаватель: профессор, доктор фармацевтических наук Козьминых Елена Николаевна
|
|
|
|
ПЕРМЬ
2020
Оглавление
| Введение ……………………………………………………………………… | 3 |
| Глава 1. ПРИЗНАКИ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ. СТЕПЕНЬ ОКИСЛЕНИЯ…………………………… 1.1 Правила расчёта степени окисления (СО)……………..………. |
6 6 |
| Глава 2. КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ……………………….….…… 2.1 Межмолекулярные окислительно –восстановительные реакции ……………….………………………..…………………..… 2.2 Внутримолекулярные окислительно –восстановительные реакции ……………….………………………..…………………..… 2.3 Диспропорционирование…………………..…………………..… |
8
8
8 8 |
| Глава 3. МЕТОД ЭЛЕКТРОННОГО БАЛАНСА………………..…… Глава 4. НАПРАВЛЕННОСТЬ ОКИСЛИТЕЛЬНО – ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ В РАСТВОРАХ………….. | 9
10 |
| Глава 5. ПРЕПОДАВАНИЕ ТЕМЫ «ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ» В ШКОЛЕ…………………… 5.1 Требования стандарта к изучению темы «Окислительно-восстановительные реакции»………………………………………... 5.2 Этапы развития представлений об окислительно – восстановительных реакциях……………………………………….. |
13
13
14 |
| Заключение ……………………………………………………………..…….. | 18 |
| БИБЛИОГРАФИЧЕСКИЙ СПИСОК ……………………………………. | 19 |
Введение
Химия – фундаментальная наука, тесно связанная с материальным миром знакомство с химией как с наукой начинается со школьного урока. Именно на уроке впервые зарождается интерес к науке химии, именно на уроке ребята учатся писать первые химические формулы и уравнения реакций, именно на уроке начинают понимать химическую картину мира.
Окружающий мир постоянно изменяется. С каждым годом во все области человеческой деятельности поступает огромное количество различных веществ, роль химических знаний становится очевидной, и ценность их постоянно возрастает. Именно знания о химических процессах в значительной степени могут обеспечить экологически грамотное отношение к природе и умелое обращение с веществами. Глубокое изучение основ химии очень важно специалистам большинства отраслей народного хозяйства: будущим врачам, химикам-технологам, инженерам – биотехнологам, военным специалистам, агрономам, ветеринарам и т. д.
Окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление - один из важнейших процессов природы. С этими реакциями связана жизнь любого живого существа: процессы обмена веществ в организме, фотосинтез, гниение и брожение. Окислительно-восстановительные реакции можно наблюдать при сгорании топлива, коррозии металлов, электролизе и выплавке металлов. С их помощью получают щелочи, кислоты и многие другие ценные химические вещества. Эти же реакции лежат в основе преобразования химической энергии в электрическую в гальванических и топливных элементах. Таким образом, окружающий нас мир можно рассматривать как гигантскую химическую лабораторию, в которой ежесекундно протекают химические реакции в основном окислительно-восстановительные.
Развитие представлений об окислительно-восстановительных реакциях началось с работ русского ученого и педагога С.В. Дайна, преподавателя Томского технологического института, который не только сформулировал и обобщил принципиальные особенности этого типа реакций, но и разработал методический подход к трактовке и изучению ОВР, как ряда последовательных стадий. Он теоретически обосновал и развил практические методы подбора стехиометрических коэффициентов в реакциях данного типа, фактически не претерпевшие изменений до настоящего времени.
Уже в 1910 году, т.е. до выхода в свет основополагающих публикаций Ф. Резерфорда и Н. Бора С.В. Дайн применял свою теорию при изучении качественного анализа в Томском политехническом институте. С.В. Дайн, исходя из химических свойств элементов и соединений, понял ряд особенностей распределения электронов в атоме. Однако этого было недостаточно для создания стройных представлений об ОВР. Дайн фактически ввел понятие степени окисления, понимая под этим заряд, который возникает на атоме после полной передачи или присоединения электронов. Нетрудно заметить, что современное понятие степени окисления ничем не отличается от понятия «значности» данного С.В. Дайном. «Например, — писал он — азот, трех‑ и пятивалентный с положительной значностью может переходить в трехвалентный с отрицательной».
При изучении школьного курса химии основной из задач учителя является формирование ключевых понятий (информационных, интеллектуальных, организационных, социальных, жизненных, предметных: обобщенно-теоретических и прикладных) у учащихся.
Если понятия не сформированы, то не могут быть усвоены ни законы, ни теории, поэтому данная проблема находится в центре внимания методистов и учителей. Согласно данным психолого-дидактических исследований можно выделить ключевые шаги формирования понятий:
Особенностью программы по химии является её концентричность, т.е. повторяемость из года в год одних и тех же тем с добавлением новых сведений, что способствует усвоению курса химии за весь период обучения. Такой подход делает процесс формирования понятий преемственным и непрерывным.
В условиях сокращения отведенного времени на изучение химии в 8-9-х классах до 2-х часов в неделю, а в 10-11-х классах базового уровня до 1 часа в неделю остро возникает проблема осуществления качественного и эффективного обучения каждого ученика.
Изучение окислительно-восстановительных реакций вызывает у учащихся определенные трудности. Особенно сложно воспринимаются такие реакции в курсе органической химии, а между тем данная тема включена в задания части А, Б, С при сдаче экзамена в форме ЕГЭ. Все это требует поисков новых, нестандартных решений, оптимизации способов подачи материала.
- Глава 1. ПРИЗНАКИ ОИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ. СТЕПЕНЬ ОКИСЛЕНИЯ
Окислительно-восстановительные реакции (ОВР) – это такие химические реакции, в которых происходит передача электронов от одних частиц (атомов, молекул, ионов) к другим, в результате чего степень окисления атомов, входящих в состав этих частиц, изменяется.
Наличие атомов, у которых в ходе реакции изменяется степень окисления - характерный признак ОВР.
Степень окисления (СО) – формальный заряд, который можно приписать атому, входящему в состав какой-либо частицы (молекулы, иона), исходя из предположения о чисто ионном характере связи в данной частице (частица состоит из ионизированных атомов).
1.1 Правила расчета степени окисления (СО)
-
Сумма СО всех атомов в частице равна заряду этой частицы (в простых веществах СО всех атомов равна 0).
-
В соединениях с ионным и ковалентно-полярным характером связи более электроотрицательным атомам соответствует более низкая СО. В бинарных ионных соединениях, атомы неметалла, как правило, проявляют минимальные СО.
-
Постоянную степень окисления имеют атомы: щелочных металлов (+1), щелочноземельных металлов (+2), водорода (+1) (кроме гидридов NaH, CaH2 и др., где степень окисления водорода -1), кислорода (-2) (кроме F2-1O+2 и пероксидов, содержащих группу –O–O–, в которой степень окисления кислорода -1). Например, в CaO2: СО(Сa)= +2, СО(О)= -1.
Степени окисления атомов в простых веществах равны нулю (Na0; H20).
-
Максимальная СО равна номеру группы (для короткопериодного варианта периодической таблицы элементов Д.И. Менделеева), за исключением ряда элементов, входящих в VIIIБ и IБ-подгруппы, и некоторых f-элементов. Минимальная СО неметаллов = Nгр-8. Например P+5 и P-3, S+6и S-2.
Окислитель (Ox) – частица, которая в ходе ОВР приобретает электроны.
Восстановитель (Red) – частица, которая в ходе ОВР отдаёт электроны.
Восстановление – процесс, в ходе которого окислитель приобретает электроны и переходит в сопряжённую восстановленную форму. При восстановлении степень окисления понижается:
Mn+4+ 2ē → Mn+2; S0+ 2ē → S-2; Cr+6+3ē → Cr+3;
Cl20+2ē → 2Cl-; O2 0 + 4ē → 2O-2.
Окисление – процесс, в ходе которого восстановитель отдаёт электроны и переходит в сопряжённую окисленную форму.
При окислении степень окисления повышается:
H20 - 2ē → 2H+; S-2 - 2ē → S0; Al0 - 3ē → Al+3;
Fe+2 - ē → Fe+3; 2Br - - 2ē → Br20.
Условная форма записи ОВР:
Cu2+ + 2e= Cu0
Zn0 – 2e = Zn2+
Cu2+ + Zn0 = Zn2+ + Cu0
- Глава 2. КЛАССИФИКАЦИЯ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ
-
Межмолекулярные окислительно-восстановительные реакции
Окислитель и восстановитель находятся в разных веществах; обмен электронами в этих реакциях происходит между различными атомами или молекулами:
S0 + O2 0 → S+4O -2
S - восстановитель; O2 - окислитель
-
Внутримолекулярные окислительно - восстановительные реакции
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
2KCl+5O -2 → 2KCl-1 + 3O 0
Cl+5 - окислитель; О-2 – восстановитель
-
Диспропорционирование
Диспропорционирование - окислительно-восстановительная реакция, в которой один элемент одновременно повышает и понижает степень окисления.
Cl2 0 + 2KOH → KCl+1O + KCl-1 + H2O
Глава 3. МЕТОД ЭЛЕКТРОННОГО БАЛАНСА
Уравнивание ОВР основано на записи полуреакций окисления и восстановления.
Алгоритм метода:
-
Найти атомы, у которых изменяется СО, и составить схему полуреакций окисления и восстановления с участием этих атомов.
-
Уравнять каждую полуреакцию, добиваясь:
-
материального баланса (равенства числа атомов каждого элемента в правой и левой частях уравнения)
-
баланса по зарядам (равенства суммарных зарядов в правой и левой частях уравнения реакции). Для этого к левой части полуреакции добавляют или вычитают из неё необходимое количество электронов.
-
Умножить каждую полуреакцию на коэффициенты:
-
учитывающие стехиометрию реагирующих (образующихся) молекул (численное отношение между атомами в полуреакциях должно соответствовать стехиометрии молекул)
-
для достижения электронного баланса: сумма отданных электронов должна быть равна сумме принятых электронов.
-
Сложить полуреакции (при этом Σe = 0).
-
Проверить материальный баланс.
Пример:

-
- Глава 4. НАПРАВЛЕННОСТЬ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ В РАСТВОРАХ
Одна из ключевых задач химии – предсказание направления и глубины протекания химической реакции. В случае ОВР имеется удобная возможность экспериментального
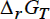 определения как максимальной полезной электрохимической работы
определения как максимальной полезной электрохимической работы
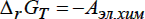 при постоянных давлении (р) и температуре (Т): . Знак “-“ перед Аэл.хим соответствует термодинамической системе знаков. Он означает, что система совершает работу Аэл.хим над окружающей средой. Неравенству соответствует протекание неравновесного и необратимого процесса, равенство выполняется для обратимых равновесных окислительно-восстановительных процессов, в которых отсутствуют другие виды работ (кроме работы расширения р∆V): Действительно, характерная особенность ОВР, отличающая этот вид химических реакций от других, состоит в том, что процессы окисления и восстановления можно пространственно разделить, если проводить реакцию в электрохимической цепи. При этом удаётся осуществить перенос электронов через металлический проводник и измерить величину, непосредственно
при постоянных давлении (р) и температуре (Т): . Знак “-“ перед Аэл.хим соответствует термодинамической системе знаков. Он означает, что система совершает работу Аэл.хим над окружающей средой. Неравенству соответствует протекание неравновесного и необратимого процесса, равенство выполняется для обратимых равновесных окислительно-восстановительных процессов, в которых отсутствуют другие виды работ (кроме работы расширения р∆V): Действительно, характерная особенность ОВР, отличающая этот вид химических реакций от других, состоит в том, что процессы окисления и восстановления можно пространственно разделить, если проводить реакцию в электрохимической цепи. При этом удаётся осуществить перенос электронов через металлический проводник и измерить величину, непосредственно
связанную с Аэл.хим, а именно электродвижущую силу (ЭДС).
Рассмотрим устройство и работу электрохимической цепи на примере элемента Даниэля (рис.1). Он состоит из цинкового электрода, погруженного в раствор сульфата цинка, и медного электрода, погруженного в раствор сульфата меди. Электроды соединены металлическим проводником, а растворы – солевым мостиком. Солевой мостик – это трубка, заполненная концентрированным раствором электролита с равными или близкими подвижностями анионов и катионов (например, КCl). Один конец трубки погружён в раствор ZnSO4, другой – CuSO4. При погружении металлического проводника в раствор, содержащий катионы того же самого металла, устанавливается динамическое равновесие между катионами Мn+, находящимися в растворе, и атомами М на поверхности электрода: Мn++ ne=М.
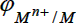 Часть атомов М в виде катионов Мn+ переходит в раствор, в тоже время катионы Мn+ могут восстанавливаться на поверхности электрода. Если преобладает прямая реакция, то пластина заряжается положительно, а раствор вблизи электрода отрицательно. Если преимущественно идёт обратная реакция, то пластина заряжается отрицательно, а раствор вблизи электрода – положительно. В любом случае в результате пространственного разделения зарядов противоположного знака на границе электрод – раствор образуется разность потенциалов - двойной электрический слой. Величина электрического потенциала электрода называется
Часть атомов М в виде катионов Мn+ переходит в раствор, в тоже время катионы Мn+ могут восстанавливаться на поверхности электрода. Если преобладает прямая реакция, то пластина заряжается положительно, а раствор вблизи электрода отрицательно. Если преимущественно идёт обратная реакция, то пластина заряжается отрицательно, а раствор вблизи электрода – положительно. В любом случае в результате пространственного разделения зарядов противоположного знака на границе электрод – раствор образуется разность потенциалов - двойной электрический слой. Величина электрического потенциала электрода называется
электродным потенциалом (обозначение 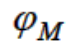 или
или 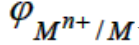 ). Она зависит от температуры, природы металла, состава раствора и концентрации катионов Mn+. Чем активнее металл, тем ниже его электродный потенциал, в частности
). Она зависит от температуры, природы металла, состава раствора и концентрации катионов Mn+. Чем активнее металл, тем ниже его электродный потенциал, в частности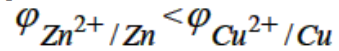 . Для того, чтобы в электрохимической цепи протекала окислительно-восстановительная реакция, необходимо, чтобы электроды были соединены проводником, а растворы - солевым мостиком. В этом случае электроны перемещаются от электрода с меньшим потенциалом (Zn) к электроду с большим потенциалом (Cu).
. Для того, чтобы в электрохимической цепи протекала окислительно-восстановительная реакция, необходимо, чтобы электроды были соединены проводником, а растворы - солевым мостиком. В этом случае электроны перемещаются от электрода с меньшим потенциалом (Zn) к электроду с большим потенциалом (Cu).
CuSO4 + Zn → Cu + ZnSO4.
Элемент Даниэля.
Э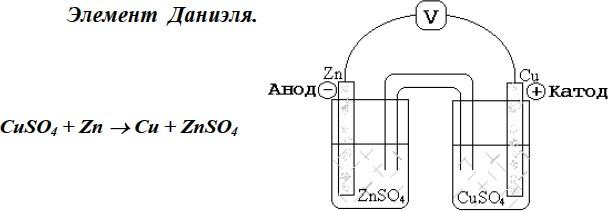 лектрод, на котором протекает процесс окисления, называется анодом Zn0 –2e = Zn2+. Электрод, на котором протекает процесс восстановления, называется катодом Сu2+ + 2e = Cu0.
лектрод, на котором протекает процесс окисления, называется анодом Zn0 –2e = Zn2+. Электрод, на котором протекает процесс восстановления, называется катодом Сu2+ + 2e = Cu0.
Если ОВР в электрохимической цепи протекает самопроизвольно, то такая цепь называется гальваническим элементом. Гальванические элементы находят применение в качестве химических источников тока. Если ОВР идёт под внешним воздействием в направлении, противоположном самопроизвольному, то такая электрохимическая цепь называется электролитической ячейкой. В ней протекает электролиз. Действительно, если к элементу Даниэля подключить внешний источник тока и подать на Сu- и Zn-электроды достаточно большие положительный и отрицательный потенциалы, соответственно, то на электродах будут протекать процессы, противоположные самопроизвольным:
Cu0 – 2e = Cu2+ (анод, окисление)
Zn2+ +2e = Zn0 (катод, восстановление) Cu0 + Zn2+ = Cu2+ + Zn0
|
ЭЛЕКТРОХИМИЧЕСКАЯ ЦЕПЬ | ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ (ОВР протекает самопроизвольно) сокращенная форма записи: 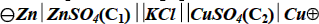
|
| ЭЛЕКТРОЛИТИЧЕСКАЯ ЯЧЕЙКА (ОВР идет в направлении, обратном самопроизвольному) сокращенная форма записи: 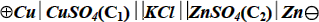
|
Глава 5. ПРЕПОДАВАНИЕ ТЕМЫ «ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ» В ШКОЛЕ
5.1 Требования стандарта к изучению темы «Окислительно-восстановительные реакции»
Опираясь на новый образовательный стандарт по химии 2004 г., можно выделить обязательный минимум содержания знаний и умений в курсе химии:
-
стандарт основного (общего) образования по химии предполагает: понятие о валентности и степени окисления, химические реакции, классификация их по изменению степени окисления;
-
стандарт среднего (полного) общего образования расширяет и дополняет знания об ОВР, рассматривая: изучение окислительно-восстановительных реакций в растворах электролитов, электролиз растворов и расплавов, теоретические вопросы, восстановительные свойства металлов, электрохимический ряд напряжений металлов, понятие о коррозии, способы защиты, представление соединений некоторых переходных металлов: KMnO4 и K2Cr2O7 как окислители.
На сегодняшний момент существует огромное количество учебников химии, где данная тема рассматривается по-разному. В нашей области широкое распространение получили учебники Габриеляна О.С. По программе Габриеляна О.С. на изучение темы "Окислительно-восстановительные реакции" выделяется следующее количество часов:
8 класс – 3 часа:
-
ОВР. Составление уравнений методом электронного баланса.
-
Составление и использование алгоритма расстановки коэффициентов методом электронного баланса в уравнениях ОВР.
-
Контрольная работа по теме.
9 класс - повторение и расширение знаний об ОВР практически на каждом уроке - изучение окислительно-восстановительных свойств металлов, неметаллов и их соединений.
10 класс - повторение и расширение знаний об ОВР - изучение процессов окисления органических веществ.
11 класс - повторение и углубление знаний об ОВР:
-
закономерности изменения окислительно-восстановительных свойств.
-
ОВР в растворах электролитов.
-
Электрохимические процессы: электролиз.
-
Коррозия металлов.
5.2 Этапы развития представлений об окислительно – восстановительных реакциях
I этап
Понятие о химической реакции начинает формироваться с самых первых уроков 8 класса. Первоначально вводится понятия о явлениях, происходящих в природе, повседневной жизни, быту, разграничивая их на физические и химические. Затем учитель информирует учащихся о тождественности понятий «химическое явление» и «химическая реакция», разъясняя, как можно по внешним признакам обнаружить химическую реакцию.
Центральное место в обучении занимает анализ содержания материала, его своеобразия и внутренней логики. На данном этапе необходимо не только дать информацию и добиться ее воспроизведения учеником, но и выделить определенные причинно-следственные связи.
II этап
После изучения темы «Периодический закон. Строение атома» в 8 классе рассматриваются вопросы химической связи. Появляется новая трактовка: химическая реакция – процесс разрушения старых связей и образования новых.
Дается классификация химических реакций на уровне сравнения числа исходных и полученных веществ. При этом учащиеся используют такие мыслительные приемы как сравнение, анализ, синтез, обобщение. Все эти сведения включены в раздел «Первоначальные химические понятия». Далее все стороны системы понятий о химической реакции должны расширяться и дополняться новыми данными, т. е начинается этап накопления знаний.
В теме "Химическая связь" вводится одно из фундаментальных понятий – "степень окисления". На его основе анализируются изучаемые учащимся реакции разных типов, доказывая, что среди них можно найти и окислительно-восстановительные.
Выделяются основные признаки нового типа реакций - изменение степени окисления элементов реагирующих веществ. На основе этого признака раскрывается содержание основных понятий и дается определение окислительно-восстановительной реакции как процесса, в ходе которого происходит изменение степени окисления элементов вследствие полного или частичного смещения электронов. Поэтому окисление сопровождается повышением, а восстановление – понижением степени окисления.
Предлагаются два способа расстановки коэффициентов в уравнения химических реакций, идущих с изменениями степеней окисления атомов химических элементов:
1) метод подбора коэффициентов;
2) использование электронного баланса.
Но главное внимание уделяется формированию умений в нахождении коэффициентов в уравнениях ОВР с использованием электронного баланса. Как известно, в школьной практике утвердился метод составления электронных уравнений при оформлении электронного баланса:
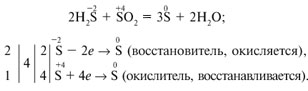
Для успешного овладения метода электронного баланса необходимы различные умения:
а) химические (умения определять степени окисления атомов элементов в формулах соединений, распознавать окисление и восстановление по изменениям степеней окисления в ходе реакции, подсчитывать число электронов, оттянутых от восстановителя и притянутых к окислителю, и др.);
б) математические (умение находить наименьшее общее кратное, дополнительные множители и др.);
в) логические (умение выделить из множества признаков существенные, находить общее в конкретном, сравнивать, классифицировать явления и т.д.).
В 8-м классе понятие об окислительно-восстановительных реакциях дается в ознакомительном плане, поэтому приобретение навыков в составлении электронного баланса и умений его объяснить начинается с тренинга на самых простых уравнениях ОВР: соединения, разложения, замещения.
III этап
В 9-м классе вопросы окисления-восстановления включены во все темы курса химии элементов.
На уроках повторения в 9 классе учащиеся вспоминают, что в периодах с увеличением порядкового номера элемента восстановительные свойства простых веществ понижаются, а окислительные повышаются. Например, во втором периоде самый активный восстановитель – литий, а самый активный окислитель – фтор (это связано с числом электронов на внешнем энергетическом уровне атома и его радиусом). У элементов главных подгрупп с увеличением порядкового номера усиливаются восстановительные свойства и ослабевают окислительные (это связано с увеличением радиуса атома). Лучшие восстановители – щелочные металлы (Fr, Сs), лучшие окислители – галогены (F, Сl). Отрабатываются умения в составлении электронного баланса для окислительно-восстановительных реакций, приобретенные в 8-м классе.
В теме "Металлы" расширяется понятие "электрохимический ряд напряжений металлов". Необходимо научить ребят пользоваться данным рядом при составлении реакций или их предсказания. Как разновидность электрохимических процессов рассматриваются темы "Электролиз" (факультативно) и "Коррозия". Особое внимание уделяется изучению взаимодействия металлов с азотной и серной кислотами.
Изучается зависимость окислительно-восстановительных свойств элементов от строения атома: металлы благодаря их строению обладают только восстановительными свойствами, неметаллы в отличие от металлов могут быть окислителями и восстановителями. Примером может служить сера: атом серы, имея шесть электронов на внешнем энергетическом уровне, способен принимать еще два электрона и проявлять при этом степень окисления -2 или отдавать либо два, либо четыре, либо шесть электронов, проявляя при этом степень окисления соответственно +2, +4, +6.
Рассматривая окислительно-восстановительные процессы, учащиеся приходят к выводу о способности элементов с низшей степенью окисления повышать её - отдавая электроны, проявляя при этом свойства восстановителей, а с высшей – ее понижать, принимая электроны, проявляя свойства окислителей.
При изучении азота и фосфора знания учащихся пополняются новыми конкретными примерами процессов окисления и восстановления. Анализируется реакции азотной кислоты с металлами и неметаллами (таблица 2), совершенствуются навыки составления уравнений и метода электронного баланса.
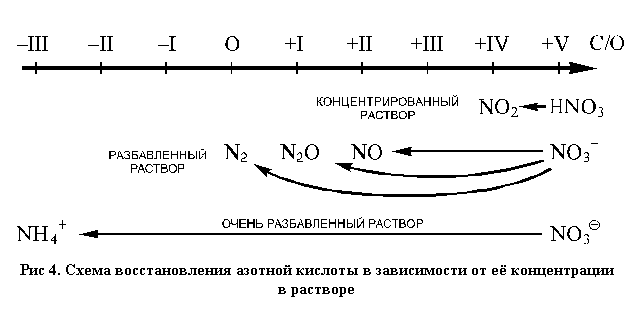
Таблица 2. Продукты восстановления азотной кислоты.
Приобретенные знания и умения закрепляются на уроках – тренингах и проверяются на специально проводимых по этой теме самостоятельных работах. Таким образом, учащиеся, заканчивая изучение неорганической химии, умеют рассматривать окислительно-восстановительные процессы и могут объяснить причины их протекания.
В 11-м классе изучается раздел «Общая химия». Качественно новым этапом в изучении окислительно-восстановительных реакций является теория электролитов, в которой учитель знакомит учащихся с новым видом окислителей и восстановителей – ионами, выявляет и раскрывает закономерности протекания таких реакций в водных растворах.
На уроке, посвященном повторению знаний об окислительно – восстановительных реакциях, суммируются все имеющиеся у учащихся знания, используя понятия «электроотрицательность», «степень окисления», «окислитель», «окисление», «восстановитель», «восстановление», закономерности протекания ОВР, правила составления уравнений ОВР и нахождения коэффициентов с помощью методов электронного и ионно-электронного баланса. Особое внимание уделяется способам прогнозирования продуктов окислительно-восстановительного процесса. В процессе работы учащиеся приходят к выводу, что методу полуреакций следует отдать предпочтение и применять его при составлении уравнений окислительно-восстановительных реакций, протекающих в водных растворах, а также с участием органических соединений.
Заключение
При постоянном изменении окружающего мира во все области человеческой деятельности поступает огромное количество различных веществ, роль химических знаний становится очевидной, и ценность их постоянно возрастает.
Как уже выяснилось, что окислительно-восстановительные процессы принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. Окисление-восстановление - один из важнейших процессов природы. С этими реакциями связана жизнь любого живого существа: процессы обмена веществ в организме, фотосинтез, гниение и брожение. Окислительно-восстановительные реакции можно наблюдать при сгорании топлива, коррозии металлов, электролизе и выплавке металлов. С их помощью получают щелочи, кислоты и многие другие ценные химические вещества. Эти же реакции лежат в основе преобразования химической энергии в электрическую в гальванических и топливных элементах. Таким образом, окружающий нас мир можно рассматривать как гигантскую химическую лабораторию, в которой ежесекундно протекают химические реакции в основном окислительно-восстановительные.
Изучение основ химии очень важно специалистам большинства отраслей народного хозяйства: будущим врачам, химикам-технологам, инженерам – биотехнологам, военным специалистам, агрономам, ветеринарам и т. д. Именно знания о химических процессах в значительной степени могут обеспечить экологически грамотное отношение к природе и умелое обращение с веществами.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
-
Окислительно-восстановительные процессы. Морозов И.В., Болталин А.И., Карпова Е.В. Уч.п. – М.: Издательство Московского университета, 2003. – 79 с.
-
Курс общей химии под ред. Н.В. Коровина. М.: Высшая школа,1983.
-
Глинка Н.Л. Общая химия. Л.: Химия, 1980.
-
Ахметов Н. С. Неорганическая химия. М.: Высшая школа, 2003.
-
Метод электронного баланса в доступном изложении (07.02.2020):
https://profmeter.com.ua/communication/learning/course/course6/lesson326/
-
Справочник химика 21(06.02.2020): https://chem21.info/info/1498724/
-
Курс лекций по общей химии (08.02.2020): http://oreluniver.ru/file/chair/chemistry/study/kl_6_270800_270100__151001.pdf








 лектрод, на котором протекает процесс окисления, называется анодом Zn0 –2e = Zn2+. Электрод, на котором протекает процесс восстановления, называется катодом Сu2+ + 2e = Cu0.
лектрод, на котором протекает процесс окисления, называется анодом Zn0 –2e = Zn2+. Электрод, на котором протекает процесс восстановления, называется катодом Сu2+ + 2e = Cu0.