Рекомендации к выполнению контрольной работы по дисциплине
«Химия»
для студентов заочной формы обучения
по специальности 19.02.10 Технология продукции общественного питания
Преподаватель: Воронкова Татьяна Сергеевна
Контрольная работа должна быть выполнена самостоятельно и оформлена в тетради в клетку. Ответы на задания должны быть написаны разборчивым почерком, в противном случае преподаватель оставляет за собой право потребовать исполнения работы в электронном варианте согласно общим методическим рекомендациям к оформлению письменных работ.
Контрольная работа состоит из 2 блоков:
1 блок содержит 3 задания, требующих подробного ответа;
2 блок содержит 5 заданий в тестовой форме с одним правильным ответом из предложенных.
3блок - задача.
Критерии оценки контрольной работы
Оценка «5» (отлично) выставляется в случае сдачи работы в установленный срок, полного выполнения работы, правильного оформления отчета, грамотного текста.
Оценка «4» (хорошо) выставляется в случае сдачи работы в установленный срок, полного выполнения всего объема работы, при наличии несущественных ошибок при оформлении отчета.
Оценка «3» (удовлетворительно) выставляется в случае несвоевременной сдачи работы, недостаточного полного выполнения работы, при наличии ошибок в оформлении отчета.
Оценка «2» (неудовлетворительно) выставляется в случае, если работа сдана с опозданием, допущена крайняя небрежность в оформлении отчета.
Требования к оформлению ответов на 1 блок
1. Предмет и задачи физической химии?
Текст развернутого ответа на вопрос.
2. Эквивалент вещества?
Текст развернутого ответа на вопрос.
Требования к оформлению ответов на 2 блок
1 - а.
2 - б.
3 - с и т.д.
Требования к оформлению 3 блока
Записано условие задания.
Записаны формулы. Сделаны соответствующие пояснения
Определена логическая цепочка решения.
Сделаны выводы.
Контрольная работа по дисциплине
«Химия»
для студентов заочной формы обучения
по специальности 19.02.10 Технология продукции общественного питания
ВАРИАНТ 1
Блок 1
Укажите условия, при которых реакции в растворах электролитов идут до конца. Приведите примеры.
Определения раствора, растворителя, растворенного вещества. Что называется растворимостью вещества? Какой раствор называется ненасыщенным, насыщенным, пересыщенным? Как изменяется растворимость большинства твердых веществ:
а) при повышении температуры?
б) при увеличении концентрации растворителя?
Какие реакции называются «аналитическими»? Признаки аналитических реакций. Общие, групповые, избирательные и специфические реакции.
Блок 2
Выберите один правильный ответ из предложенных
Какие термодинамические характеристики из перечисленных ниже являются функциями состояния: Ответ дайте последовательностью букв.
работа,
внутренняя энергия,
теплота,
энтальпия,
энтропия.
Состояние системы, при котором ее свойства постоянны во времени при наличии потоков энергии и вещества, называется:
начальным,
стационарным,
переходным,
стандартным,
конечным.
Каково соотношение между Ср и Сv для идеального газа?
Ср + Сv = R
Ср = Сv + R
Ср / Сv = R
Ср = Сv + RT
Какая величина ∆Н или ∆Е больше для следующей химической реакции:
4NO(г) + 6Н2О(ж) = 4 NH3(г) + 5О2(г)
∆Н ∆Е
∆Н ∆Е
∆Н = ∆Е
Можно ли по изменению энтропии судить о направлении протекания процесса? Да, если система:
закрытая,
изолированная,
открытая,
в любых типах систем,
только в гетерогенных.
Блок 3
Вычислить тепловой эффект реакции  при стандартных условиях
при стандартных условиях 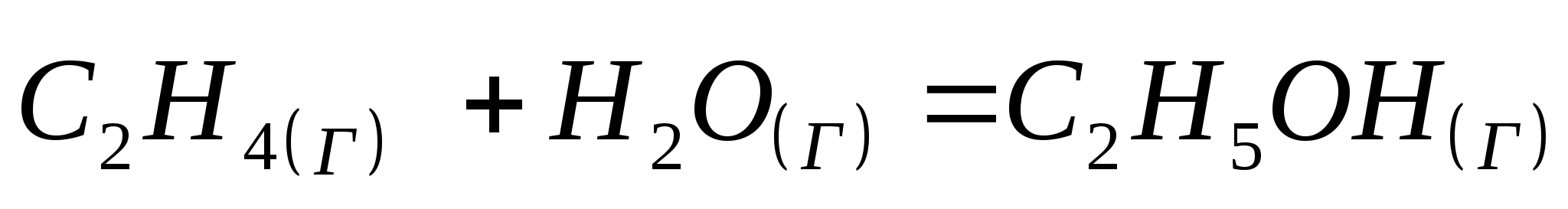
Контрольная работа по дисциплине
«Химия»
для студентов заочной формы обучения
по специальности 19.02.10 Технология продукции общественного питания
ВАРИАНТ 2
Блок 1
Коагуляция дисперсной системы. Скорость коагуляции. Причины, вызывающие процесс самопроизвольной коагуляции.
Диффузия и осмос в растворах.
Предмет и задачи аналитической химии. Ее значение для технологов общественного питания.
Блок 2
Уравнение изобары химической реакции демонстрирует зависимость константы равновесия от:
изменения энергии Гиббса
теплоты процесса
давления в системе
температуры
Укажите максимальное число фаз однокомпонентной системы, которые могут одновременно находиться в состоянии термодинамического равновесия.
4
2
3
1
Что такое ΔS гидратации ионов? Каков знак ΔS гидратации?
изменение энтропии при растворении электролита в воде. ΔS0.
изменение энтропии в процессе распада электролита на ионы. ΔS0.
изменение энтропии в процессе образования акватированного иона. ΔS
изменение энтропии в процессе образования ассоциатов. ΔS
Буферный раствор это:
раствор соли сильного основания и слабой кислоты и соответствующего основания.
раствор сильной кислоты и слабого основания.
раствор, способный поддерживать постоянство состава при добавлении к нему других веществ.
раствор, способный поддерживать постоянство pH при добавлении небольших количеств кислоты или основания.
Укажите возможные варианты правильного ответа.
Скорость гомогенной каталитической реакции зависит от …
природы катализатора,
концентрации катализатора,
площади поверхности катализатора,
способности катализатора участвовать в реакции,
температуры.
Укажите возможные варианты правильного ответа.
Блок 3
Как повлияет: а) повышение давления; б) повышение температуры; в) увеличение концентрации кислорода на химическое равновесие системы:
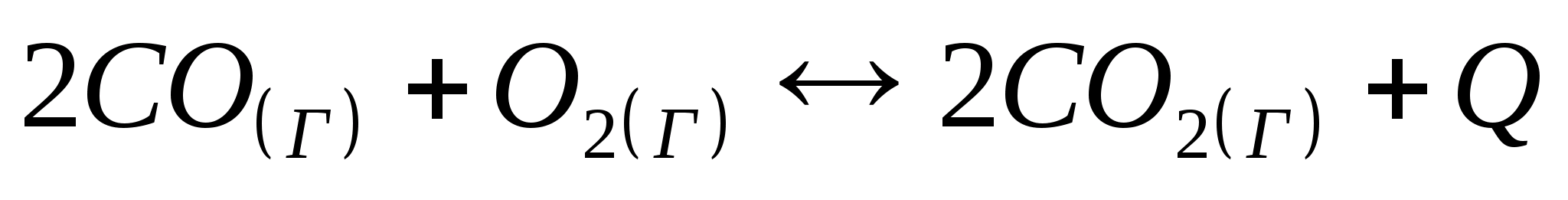
Контрольная работа по дисциплине
«Химия»
для студентов заочной формы обучения
по специальности 19.02.10 Технология продукции общественного питания
ВАРИАНТ 3
Блок 1
Чувствительные реакции. Дайте определение и приведите пример.
Что такое термодинамическая система? Гомо- и гетерогенные системы. Открытые, закрытые и изолированные системы. Параметры системы.
Поверхностное натяжение, методы его определения.
Блок 2
Имеет ли размерность (единицы измерения) и какую константа скорости реакции?
не имеет размерности.
имеет размерность скорости.
размерность определяется интегральной формой кинетического уравнения для различных порядков реакции.
зависит от условий протекания реакции.
Краевой угол смачивания раствора, содержащего ПАВ, по сравнению с краевым углом смачивания чистого растворителя:
уменьшается;
увеличивается;
не изменяется;
стремится к нулю.
Броуновское движение частиц дисперсной системы обусловлено:
температурой,
малыми размерами,
электрическим зарядом,
тепловым движением молекул дисперсионной среды.
Укажите возможные варианты правильного ответа.
Рассеяние света в коллоидных растворах связано с:
с поглощением света частицами дисперсной фазы.
с отражением света частицами дисперсной фазы
с дифракцией света частицами дисперсной фазы
Перечислить вещества, которые могут образовывать структурно-механический барьер на границе раздела вода-масло и использоваться в качестве стабилизаторов прямых эмульсий.
натрий пропионат
валериановая кислота
желатин
мел
лецитин
Укажите возможные варианты правильного ответа.
Блок 3
Определите, во сколько раз увеличится скорость реакции 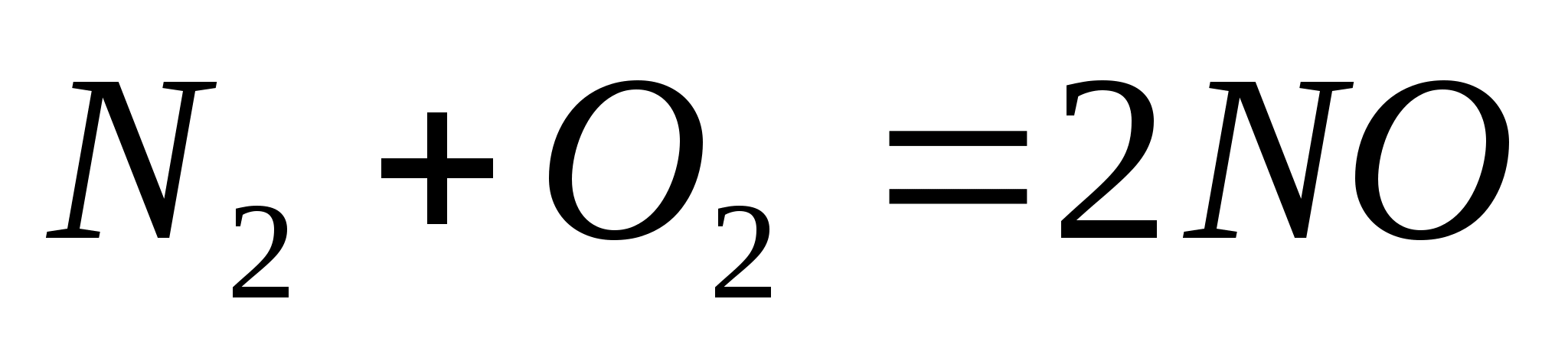 , если увеличить количества веществ азота и кислорода в реакционной системе в два раза при постоянном объеме.
, если увеличить количества веществ азота и кислорода в реакционной системе в два раза при постоянном объеме.
Контрольная работа по дисциплине
«Химия»
для студентов заочной формы обучения
по специальности 19.02.10 Технология продукции общественного питания
ВАРИАНТ 4
Блок 1
Свойства растворов. Общая характеристика растворов.
Что такое аналитическая реакция?
Общие сведения о высокомолекулярных соединениях.
Блок 2
Коллоидная химия – это:
раздел химической науки, изучающий химическую энергетику, химическую кинетику и агрегатные состояния веществ;
физическая химия гетерогенных высокодисперсных систем, а так же растворов высокомолекулярных соединений;
учение, рассматривающее природу растворов, их внутреннюю структуру, важнейшие свойства, зависящие от концентрации и химической природы компонентов, составляющих раствор, а также свойства растворов электролитов.
Способы получения тонких дисперсных систем, содержащих частицы золота в стекле впервые рассматривал:
Т.Грэм;
М.Ломоносов;
А. Энштейн.
Величина удельной поверхности – это:
отношение общей поверхности частиц к общему объёму вещества,подвергшегося дроблению;
величина обратная размеру частиц;
отношение числа распавшихся на ионы молекул к общему числу растворённых молекул.
Причина ТЭД:
процесс сольватации ионов;
процесс ионизации растворённого вещества;
процесс дегидратации растворителя.
К электролитам относятся:
соли, кислоты;
органические соединения, основания;
простые вещества, гликозиды.
Блок 3
Дано уравнение обратимой химической реакции:
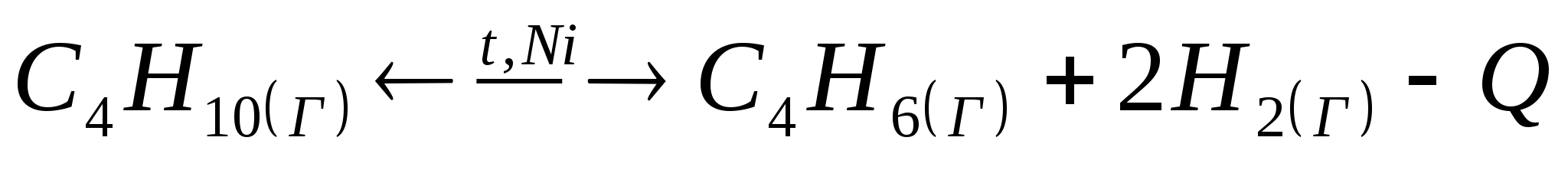
В какую сторону будет смещаться химическое равновесие данной реакции при: а) понижении температуры; б) уменьшении давления; в) уменьшении концентрации водорода? Дайте обоснованный ответ.
Контрольная работа по дисциплине
«Химия»
для студентов заочной формы обучения
по специальности 19.02.10 Технология продукции общественного питания
ВАРИАНТ 5
Блок 1
Химическая термодинамика как наука. Первый закон термодинамики, его формулировка и математическое выражение.
Дайте понятие сильным и слабым электролитам. Приведите примеры.
Газообразное состояние вещества: уравнение состояния идеального газа.
Блок 2
По степени диссоциации электролиты делятся на:
водные и неводные;
электролиты и неэлектролиты;
сильные и слабые.
«Понижение давления пара растворителя над раствором при постоянной температуре пропорционально молярной доле растворённого вещества», так формулируется…закон Рауля:
криометрический;
эбулиометрический;
тонометрический
ТЭД разработал:
С. Аррениус;
Вант-Гофф;
М Фарадей.
Величина рН характерна для:
общей кислотности (основности);
активной кислотности (основности);
общей и активной кислотности (основности).
Величина обратная размеру частиц – это:
степень удельности;
степень дисперсности;
степень гетерогенности.
Блок 3
В какую сторону сместится химическое равновесие системы
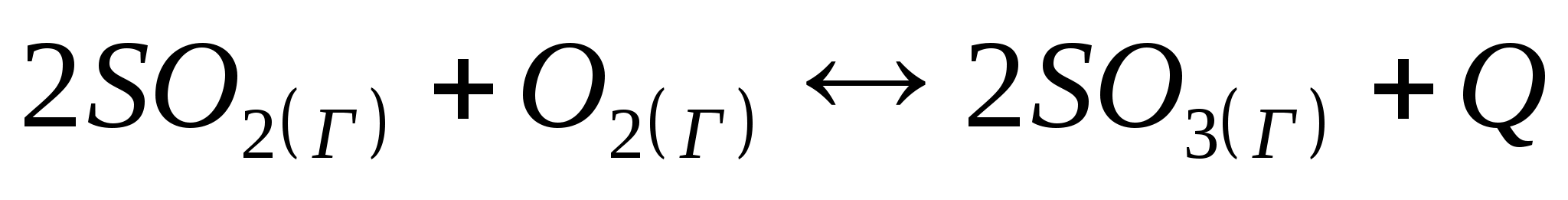
при повышении температуры;
при повышении давления;
при увеличении концентрации оксида серы (VI)?
Дайте обоснованный ответ.
























