Просмотр содержимого документа
«Роль воды в химии»

Роль воды в химических реакциях
Выполнила: Ефимчик Алеся
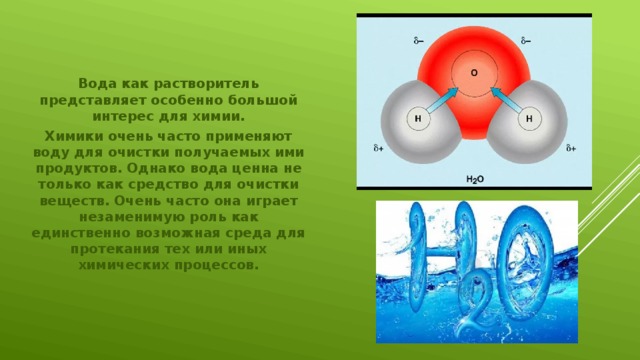
Вода как растворитель представляет особенно большой интерес для химии.
Химики очень часто применяют воду для очистки получаемых ими продуктов. Однако вода ценна не только как средство для очистки веществ. Очень часто она играет незаменимую роль как единственно возможная среда для протекания тех или иных химических процессов.

Вода отличается ещё одним важным свойством: она сама способна соединяться с очень многими веществами, быть активным участником различных химических процессов.Вода способна соединяться с простыми веществами как металлами, так и неметаллами.
Вода вступает в реакции и со многими сложными веществами. Мы здесь укажем только несколько примеров этих реакций, приводящих к образованию очень важных в химической промышленности веществ — оснований (или гидроокисей) и кислот.


Вода- уникальное химическое вещество, роль которого в химических реакциях трудно переоценить.
По отношению к воде как растворителю все вещества условно делят на следующие группы:
- - растворимые (в 100г воды растворяется более 1г вещества);
- - малорастворимые ( в 100 г воды растворяется от 0,01 до 1г вещества)
- - практические нерастворимые (в 100г воды растворяется менее 0,01 г вещества).

Растворение – это не просто физический процесс – результат диффузии. При растворении веществ в воде происходит их химическое взаимодействие с ней – гидратация. Результатом такого взаимодействия является образование растворов.
Водные растворы – это гомогенные системы, состоящие из молекул воды, частиц растворенного вещества и продуктов их взаимодействия.
Молекулы окруженные оболочкой из молекул воды называют гидратированными. Это результат процесса гидратации – взаимодействия воды с молекулами растворяемого вещества.

Косвенным доказательством гидратации как химического процесса является существование твердых кристаллогидратов. Наиболее известными кристаллогидратами являются медный купорос, гипс и кристаллическая сода.
Значительна роль воды для транспортировки вещества в сферу реакции.
Не менее значима роль воды как участника химических реакций, как реагента.

Взаимодействие ацетилена с водой было известно до М.Г. Кучерова:
Hg2+ O
HC ≡ CH + H2O → CH3 – CH
С водой при обычных условиях энергично реагируют щелочные и щелочноземельные металлы, При этом образуется щелочь и водород:
2Na +2H2O = 2NaOH +H2↑
Ca + 2H2O = Ca(OH)2 + H2↑

Спасибо за внимание.


























