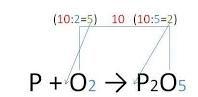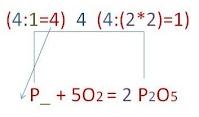СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Самостоятельная работа по химии. 8-9 класс (дидактический материал)
Для внеурочной самостоятельной работы по химии в вечерней школе для обучающихся 8,9 классов отводится по 1 часу в неделю. В данной разработке представлен тематический план и дидактический материал для изучения тем по химии 8,9 классе самостоятельно .
Просмотр содержимого документа
«Самостоятельная работа по химии. 8-9 класс (дидактический материал)»
ГОСУДАРСТВЕННОЕ КАЗЕННОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
КЕМЕРОВСКОЙ ОБЛАСТИ «СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА ПРИ ИСПРАВИТЕЛЬНЫХ УЧРЕЖДЕНИЯХ УГОЛОВНО-ИСПОЛНИТЕЛЬНОЙ СИСТЕМЫ»
Самостоятельная работа
(дидактический материал)
по химии
8-9 класс
2019г.
Тематический план внеурочной самостоятельной работы по химии
обучающихся 8 класс ФГОС ЗФО (1 час в неделю) ФКУ ИК-22
| № п/п
| Наименование разделов и тем программы | Макс. нагрузка (час) | № сам. раб | Вид и тема самостоятельной работы | Учебная нагрузка (час) |
| 1 | Раздел 1. Первоначальные понятия и законы химии. | 20ч. | 1 | Подготовить сообщение «Химия в жизни человека и на производстве» | 1 |
| 2 | Составить таблицу «Чистые вещества и смеси. Способы разделения смесей». | 2 | |||
| 3 | Составить конспект «Атомно – молекулярное учение». Выполнить задание по теме. | 2 | |||
| 4 | Выполнить задание «Нахождение и вычисление относительной атомной и молекулярной массы». Составить таблицу» Условия и признаки протекания химических реакций» | 2 | |||
| 5 | Подготовить доклад «Жизнь и деятельность Д.И. Менделеева» | 2 | |||
| 6 | Выполнить задание на составление химических формул | 2 | |||
| 7 | Решить задачи по теме « Количество вещества. Молярный объем газов» | 2 | |||
| 8 | Составить схемы уравнений химических реакций | 2 | |||
| 9 | Заполнить таблицу «Типы химических реакций» | 2 | |||
| 10 | Решить задачи по уравнению химической реакции | 3 | |||
| 2 | Раздел 2 Строение вещества. | 6 | 11 | Составить электронные формулы 20 химических элементов | 2 |
| 12 | Охарактеризовать 20 химических элементов по положению в ПС | 2 | |||
|
|
|
| 13 | Составить схемы образования ковалентной и ионной связей. Заполнить таблицу «Сходство и различия видов химической связи» | 2 |
|
| Раздел 3. Состав и классификация химических соединений | 4 | 14 | Выполнить задание на определение степени окисления химических элементов в различных соединениях. Работа по карточкам на классификацию неорганических соединений | 2 |
|
| Раздел 4. Растворы. Теория электролитической диссоциации | 7 | 15 | Составить опорный конспект «Растворы» | 2 |
|
|
|
| 16 | Выполнить задания по теме «Химические свойства кислот, оснований в свете теории ЭД» | 2 |
|
|
|
| 17 | Выполнить задания по теме Химические свойства солей в свете теории ЭД | 2 |
|
|
|
| 18 | Работа по карточкам с заданиями по теме «Генетическая связь между классами неорганических соединений» | 2 |
|
| Всего: |
| 18 |
| 35 |
Дидактический материал для проведения внеурочной
самостоятельной работы по химии
для обучающихся 8 класса ОЗФО (35 часов)
САМОСТОЯТЕЛЬНАЯ РАБОТА № 1
| Подготовить сообщение по теме «Химия в жизни человека и на производстве» | 1 ч. |
Подготовить сообщение по плану:
Роль химии в жизни человека
Химия в быту
Химия и человеческий организм
Химия в промышленности
Значение химии в нашей жизни
Вредное воздействие
Польза химии
САМОСТОЯТЕЛЬНАЯ РАБОТА № 2
| Составить таблицу «Чистые вещества и смеси. Способы разделения смесей». | 2ч. |
Задание № 1
Дать определение:
Чистые вещества –
Раствор –
Смеси –
Задание № 2
Разделите на 2 группы перечисленные вещества (песок, молоко, дистиллированная вода, карбонат кальция, раствор соляной кислоты, смесь серы и железных опилок, медь, серебро, глюкоза).
| чистые вещества | смеси |
По какому принципу вы их разделили?
Как определить чистое перед вами вещество или смесь?
Задание № 3
Составьте таблицу (способы разделения смесей), используя слова: отстаивание фильтрование, выпаривание, центрифугирование, перегонка.
|
| способ разделения смесей | характеристика |
| |
|
|
Задание № 4
Ответьте на вопросы:
Перед переработкой бытового мусора (бумажной макулатуры) необходимо избавиться от железных предметов. Как проще всего это сделать.
Как выделить указанные вещества из их водных растворов: раствор сахара, раствор поваренной соли.
Муку очищают от отрубей просеиванием. Почему это удается.
САМОСТОЯТЕЛЬНАЯ РАБОТА № 3
| Составить конспект «Атомно – молекулярное учение». Выполнить задание по теме. | 2ч. |
Задание № 1
Составить конспект «Атомно – молекулярное учение». По плану
Ломоносов М.В.(Км он был, клад в атомно-молекулярное учение)
Основные положения атомно-молекулярного учения.
История открытия закона *
Значение закона
Задание № 2
Ответьте на вопросы
Когда и где возникли первые представления об атомах?
В одной из работ М.В. Ломоносов писал: «Элемент есть часть тела, не состоящая из каких-либо меньших и отличных между собою тел... Корпускулы есть собрание элементов в одну небольшую массу... Корпускулы однородны, если состоят из одинакового числа одних и тех же элементов, соединённых одинаковым образом... Корпускулы разнородны, когда элементы их различны и соединены различным образом или в различном числе; от этого зависит бесконечное разнообразие тел». Перепишите, заменив в цитате выделенные слова современными терминами.
САМОСТОЯТЕЛЬНАЯ РАБОТА № 4
| Выполнить задание «Нахождение и вычисление относительной атомной и молекулярной массы». Составить таблицу» Условия и признаки протекания химических реакций» | 2 ч. |
Задание № 1
Дать определение
Химическая реакция -
Относительная атомная масса –
Относительно молекулярная масса -
Задание № 2
Используя текс учебника, составите таблицу условия и признаки протекания химических реакций
| Химические реакции | |
| признаки химических реакций | Условия протекания химических реакций |
|
|
|
Задание № 3
Напишите относительные атомные массы, используя периодическую систему Д.И. Менделеева
| название | символ | атомная масса |
| азот |
|
|
| хлор |
|
|
| алюминий |
|
|
| кальций |
|
|
| фтор |
|
|
| медь |
|
|
Задание № 4
Определение относительной молекулярной массы веществ по предложенным формулам (работа с опорной схемой).
| Молекула | значение Мr |
| Н2О | Мr(Н2О)= 2Ar (Н) +1Ar(О)= 2·1 +1·16 = 18 |
| H2SO4 | Мr(H2SO4) = Ar( ) + Ar ( ) + Ar ( ) = |
| HNO3 | Мr(HNO3) = Ar( ) + Ar( ) + Ar( ) = |
| Fe2O3 | Мr(Fe2O3) = Ar + Ar = |
| SO3 | Мr( ) = |
| NaOH | Мr( ) = |
| H3PO4 | Мr ( ) = |
| N2 | Мr ( ) = |
| H2O2 | Мr ( ) = |
Задание № 5
Сравнение относительных молекулярных масс. Вставьте знак, больше, меньше, равно, выполнив вычисления
| Mr (Н2SO4) |
| Mr (Н3РO4) |
| Mr (SO3) |
| Mr (MgO) |
| 5 Mr (CH4) |
| 2 Mr (NaOH) |
| Mr (NH3) |
| Mr (PH3) |
САМОСТОЯТЕЛЬНАЯ РАБОТА № 5
| Подготовить доклад «Жизнь и деятельность Д.И. Менделеева» | 2 ч. |
План
Биография
Хроника творческой жизни ученого
Научная деятельность.
Периодический закон Д.И. Менделеева
САМОСТОЯТЕЛЬНАЯ РАБОТА № 6
| Выполнить задание на составление химических формул | 2 ч. |
Теория
Химическая формула - это запись состава вещества с помощью символов элементов и подстрочных индексов.
Индекс (подстрочный) обозначает число атомов данного элемента в молекуле вещества.
Индекс «1» в химической формуле опускается.
Если в формуле записан знак химического элемента без индекса, значит, в частице вещества содержится один атом данного элемента.
Химические формулы веществ молекулярного строения показывают состав молекул. Это молекулярные формулы.
Например, запись 7H2SO4 означает: семь молекул серной кислоты, каждая из которых состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода.
Пример:
O2 («о-два») — молекулярная формула кислорода. В молекуле кислорода содержатся два атома химического элемента кислорода.
He («гелий») — молекулярная формула инертного (благородного) газа гелия. Молекулы благородных газов одноатомные.
H2SO4 («аш-два-эс-о-четыре») — молекулярная формула серной кислоты. Молекула серной кислоты содержит два атома водорода, один атом серы и четыре атома кислорода.
Химические формулы веществ немолекулярного строения показывают простейшее соотношение числа атомов химических элементов в веществе. Такие формулы называют простейшими формулами.
Группа атомов, состав которой соответствует простейшей формуле вещества, называется формульной единицей.
Для простых веществ немолекулярного строения формульной единицей является атом, поэтому их формулы записывают просто знаками химических элементов без индексов.
Пример:
Cu («купрум»)— формула меди, которая показывает, что её формульной единицей является атом.
Fe2O3 («феррум-два-о-три») — простейшая формула оксида железа(III). В этом веществе на два атома железа приходится три атома кислорода.
Повторяющиеся группы атомов в формуле заключают в скобки.
Пример:
Mg(OH)2 («магний-о-аш-дважды»)— в гидроксиде магния на один атом магния приходится два атома кислорода и два атома водорода.
Ca3(PO4)2 («кальций-три-пэ-о-четыре-дважды»)— в фосфате кальция на три атома кальция приходится два атома фосфора и восемь атомов кислорода.
В химических записях используются коэффициенты.
В химических записях используются коэффициенты.
Коэффициент — цифра в химической записи, которая ставится перед формулой и показывает число отдельных атомов, молекул или формульных единиц.
Коэффициент «1» не записывается.
Пример:
O — один атом кислорода.
3H2 — три молекулы водорода, каждая из которых состоит из двух атомов химического элемента водорода.
10H2SO4 — десять молекул серной кислоты, содержащих по два атома водорода, одному атому серы и по четыре атома кислорода.
2Mg(OH)2 — две формульные единицы гидроксида магния, состоящие из одного атома магния, двух атомов кислорода и двух атомов водорода.
Практические задания
Задание № 1 Дать определение:
Химическая формула – это
Индекс (подстрочный) обозначает
Коэффициент — это
Задание № 2 Напишите химическую формулу вещества, если известно, что в его состав входят:
а) атом железа и три атома хлора;
б) два атома алюминия и три атома кислорода;
в) атом кальция, атом углерода и три атома кислорода.
Задание № 3 Что означают записи: 4H, 2H2, HgO, 5FeS, 3H2SO4?
Задание № 4 Заполните таблицу.
| Вещество | Качественный состав | Количественный состав |
| KMnO4 |
|
|
| H2SO4; |
|
|
Задание № 5
Состав вещества отражает формула K2SO4. Определите: а) суммарное число атомов в молекуле; б) число химических элементов, входящих в состав вещества; в) число атомов каждого химического элемента в веществе.
Задание № 6
| Что означает запись 4CO2 1) четыре атома кислорода 2) четыре молекулы углерода 3) четыре молекулы углекислого газа 4) восемь молекул кислорода
| Что означает запись 3H2O 1) шесть молекул воды 2) три молекулы кислорода 3) три молекулы водорода 4) три молекулы воды
|
Задание № 7
| Сколько атомов серы в 5Na2S2O3 1) 5 2) 7 3) 15 4) 10 | Сколько атомов хрома в 7K2Cr2O7 1) 14 2) 7 3) 9 4) 2 |
Задание № 8
Формула молекулы вещества, которая состоит из трех атомов калия,
одного атома фосфора и четырех атомов кислорода: ____________________
Формула молекулы вещества, которая состоит из двух атомов натрия,
одного атома кремния и трех атомов кислорода: ____________________
Задание № 9
Молекула сернистого газа состоит из одного атома серы и двух атомов
кислорода. Какова формула сернистого газа?
1) SCl2 2) SO3 3) SO2 4) H2S
Выберите формулу пероксида натрия, состоящего из двух атомов натрия
и двух атомов кислорода.
1) Na2O 2) Na2O2 3) Na2O4 4) NaO2
Задание № 10
Соотнесите:
Число атомов водорода
А) 9 Б) 2 В) 7 Г) 6
Химические записи
1) 3H2CO3 4) Ca(OH)2
2) 3NH3 5) 7NaHSO4
3) 5H3PO4 6) 8HCl
| 1 | 2 | 3 | 4 | 5 | 6 |
|
|
|
|
|
|
|
САМОСТОЯТЕЛЬНАЯ РАБОТА № 7
| Решить задачи по теме» Количество вещества. Молярный объем газов» | 2 ч. |
ФОРМУЛЫ ДЛЯ РЕШЕНИЯ ЗАДАЧ
Количество вещества характеризует число структурных единиц (атомов, молекул, ионов), которое содержится в определенном образце данного вещества.
Единицей измерения количества вещества является моль.
Количество вещества (ν) связано с числом структурных единиц (N) в образце вещества, его массой (m) и объемом (V) — для газообразных веществ при н. у. — следующими уравнениями:
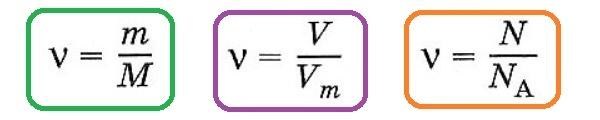
в которых
Vm = 22,4 л/моль (мл/ммоль, м3/кмоль) при н.у.,
Na = 6,02 • 1023 (постоянная Авогадро),
а молярная масса (М) численно равна относительной молекулярной массе вещества:

Наличие подобной взаимосвязи позволяет, зная одну из величин (количество вещества, массу, объем, число структурных величин) определить все другие величины.
Пример
Задача № 1
Какое количество вещества содержится в 33 г оксида углерода (IV)?

Ответ: ν(СО2) = 0,75 моль.
Задача № 2
Какое число молекул содержится в 2,5 моль кислорода?
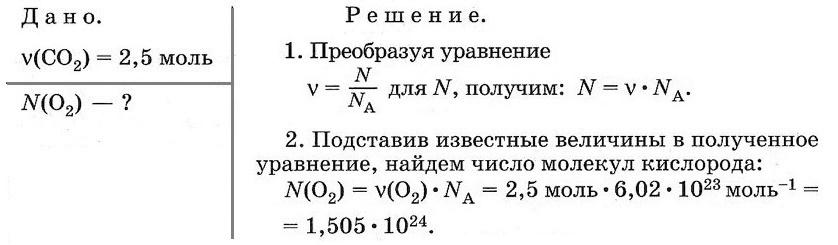
Ответ: N(O2) = 1,505 • 1024.
Задача № 3
Определите объем (н. у.), который займут 0,25 моль водорода.

Задача № 4
Имеется 3 моль кислорода О2 при н.у. Определите массу кислорода, его объем, а также число имеющихся молекул кислорода.
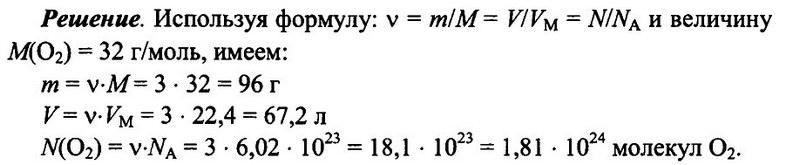
Ответ: m = 96 г; V = 67.2 л; N(O2) = 1,81 • 1024.
Задание
1. КОЛИЧЕСТВО ВЕЩЕСТВА
В каком количестве вещества содержится 1,8*1023 атомов серебра?
В каком количестве вещества содержится 2,4*1023 молекул воды?
Сколько молекул содержится в 0,3 моль воды? Подсказка: N = Na*n
Сколько молекул содержится в 0,5 моль поваренной соли?
Сколько атомов содержится в 2 моль натрия?
2. КОЛИЧЕСТВО ВЕЩЕСТВА. МОЛЯРНАЯ МАССА.
Рассчитайте количество вещества и массу 36*1023 молекул оксида бария ВаО.
Сколько моль и молекул содержится в 28,4 г оксида фосфора (V) P2O5?
Найти массу 0,5 моль хлора. Сколько там содержится молекул?
Найти массу 0,1 моль водорода. Сколько содержится молекул в данном количестве водорода?
Найти массу 0,3 моль кислорода. Сколько содержится молекул в данном количестве кислорода?
3. МОЛЯРНЫЙ ОБЪЕМ
Какой объем (н.у.) займут а) 0,6 моль азота; б) 3 моль кислорода? Подсказка: V=Vm*n ; Vm=22,4 л/моль
Какой объем (н.у.) займут 0,3 моль сероводорода?
Какой объем (н.у.) займут 5 моль хлороводорода
Сколько моль углекислого газа занимают объем 5,6 л (н.у.)?
Сколько моль угарного газа занимают объем 89,6 л (н.у.)?
4. КОЛИЧЕСТВО ВЕЩЕСТВА.
МОЛЯРНАЯ МАССА. МОЛЯРНЫЙ ОБЪЕМ.
Найти количества вещества и массу: а) 6,72 л (н.у.) кислорода; б) 4,48 л (н.у.) хлора.
Найти количество вещества и объем (н.у.): а) 6 г водорода; б) 6,4 г кислорода.
Найти массу и объем (н.у.): а) 0,5 моль азота; б) 2 моль углекислого газа.
Найти количество вещества, массу и объем (н.у.): а) 12*1023 молекул фтора; б) 3*1023
молекул азота; в) 1,8*1023 молекул хлора;
САМОСТОЯТЕЛЬНАЯ РАБОТА № 8
| Составить схемы уравнений химических реакций | 2ч. |
Составлять химические уравнения и производить расчеты по ним нужно, опираясь на закон сохранения массы веществ при химических реакциях. Рассмотрим, как можно составить химическое уравнение, на примере реакции меди с кислородом.
Слева запишем названия исходных веществ, справа — продуктов реакции. Если веществ два и более, соединяем их знаком «+». Между левой и правой частями пока поставим стрелку:
медь + кислород → соединение меди с кислородом.
Подобное выражение называют схемой химической реакции. Запишем эту схему при помощи химических формул:
![]()
Число атомов кислорода в левой части схемы равно двум, а в правой — одному. Так как при химических реакциях атомы не исчезают, а происходит только их перегруппировка, то число атомов каждого элемента до реакции и после реакции должно быть одинаковым. Чтобы уравнять число атомов кислорода в левой и правой частях схемы, перед формулой CuO ставим коэффициент 2:
![]()
Теперь число атомов меди после реакции (в правой части схемы) равно двум, а до реакции (в левой части схемы) — только одному, поэтому перед формулой меди Cu так же поставим коэффициент 2. В результате произведенных действий число атомов каждого вида в левой и правой частях схемы одинаково, что дает нам основание заменить стрелку на знак «=» (равно). Схема превратилась в уравнение химической реакции:
![]()
Это уравнение читается так: два купрум плюс о-два равно два купрум-о (рис. 60).
Алгоритм составления уравнения химической реакции
| Составим уравнение химической реакции взаимодействия фосфора и кислорода |
| 1. В левой части уравнения записываем химические формулы реагентов (веществ, вступающих в реакцию). Помните! Молекулы большинства простых газообразных веществ двухатомны – H2; N2; O2; F2; Cl2; Br2; I2. Между реагентами ставим знак «+», а затем стрелку: P + O2 → |
| 2. В правой части (после стрелки) пишем химическую формулу продукта (вещества, образующегося при взаимодействии). Помните! Химические формулы необходимо составлять, используя валентности атомов химических элементов: P + O2 → P2O5 |
| 3. Согласно закону сохранения массы веществ число атомов до и после реакции должно быть одинаковым. Это достигается путём расстановки коэффициентов перед химическими формулами реагентов и продуктов химической реакции. Вначале уравнивают число атомов, которых в реагирующих веществах (продуктах) содержится больше. В данном случае это атомы кислорода. Находим наименьшее общее кратное чисел атомов кислорода в левой и правой частях уравнения. Наименьшее кратное для атомов натрия –10:
Находим коэффициенты путём деления наименьшего кратного на число атомов данного вида, полученные цифры ставим в уравнение реакции:
Закон сохранения массы вещества не выполнен, так как число атомов фосфора в реагентах и продуктах реакции не равно, поступаем аналогично ситуации с кислородом:
Получаем окончательный вид уравнения химической реакции. Стрелку заменяем на знак равенства. Закон сохранения массы вещества выполнен: 4P + 5O2 = 2P2O5 |
Задание № 1
Преобразуйте следующие схемы в уравнения химических реакций расставив необходимые коэффициенты и заменив стрелки на знак равенства:
Zn + O2 → ZnO
Fe + Cl2→ FeCl3
Mg + HCl → MgCl2 + H2
Al(OH)3 → Al2O3 + H2O
HNO3→ H2O+NO2+O2
CaO+H2O→ Ca(OH)2
H2+Cl2→ HCl
KClO3→ KClO4+KCl
Fe(OH)2+H2O+O2→ Fe(OH)3
KBr+Cl2→ KCl+Br2
Задание № 2
Используя алгоритм составления уравнений химических реакций, составьте уравнения реакций взаимодействия между следующими парами веществ:
1) Na и O2
2) Na и Cl2
3) Al и S
Задание № 3.
Расставьте коэффициенты в следующих схемах реакций:
Al + O2 = Al2O3
N2 + H2 = NH3
Ca + H3PO4 = Ca3(PO4)2 +H2
Ba(OH)2 + HCl = BaCl2 + H2O
ZnCl2 + AgNO3 = AgCl + Zn(NO3)2
P + O2 = P2O3
Li + N2 = Li3N
Zn + HCl = ZnCl2 +H2
Fe(OH)3 + HCl = FeCl3 + H2O
BaCl2 + Al2(SO4)3 = AlCl3 + BaSO4
Al + O2 = Al2O3
N2 + H2 = NH3
Ca + H3PO4 = Ca3(PO4)2 +H2
Ba(OH)2 + HCl = BaCl2 + H2O
ZnCl2 + AgNO3 = AgCl + Zn(NO3)2
Задание № 4
Напишите уравнения реакций по следующим схемам:
Натрий + вода = гидроксид натрия + водород
Фосфор + кислород = оксид фосфора (III)
Хлорид железа (III) + гидроксид калия = гидроксид железа (III) + хлорид калия
Гидроксид алюминия = оксид алюминия + вода
Сульфат алюминия + хлорид бария = хлорид алюминия + сульфат бария
Барий + вода = гидроксид бария + водород
Азот + кислород = оксид азота (III)
Гидроксид железа (III) = оксид железа (III) + вода
Нитрат алюминия + фосфат натрия = фосфат алюминия + нитрат натрия
Серная кислота + гидроксид натрия = сульфат натрия + вода
Натрий + вода = гидроксид натрия + водород
Фосфор + кислород = оксид фосфора (III)
Хлорид железа (III) + гидроксид калия = гидроксид железа (III) + хлорид калия
Гидроксид алюминия = оксид алюминия + вода
Сульфат алюминия + хлорид бария = хлорид алюминия + сульфат бария
САМОСТОЯТЕЛЬНАЯ РАБОТА № 9
| Заполнить таблицу Типы химических реакций | 2 ч. |
под формулой каждого вещества написать его тип –простое или сложное –
буквами «П» и «С» соответственно
объединить снизу фигурной скобкой и подписать количество исходных веществ и продуктов реакции
написать тип реакции
пояснить, как определен тип реакции
уравнять схему реакции коэффициентами, превратив ее в химическое уравнение
Образец.
задание: Fe2O3+HNO3 → Fe(NO3)3+H2O
решение:
| Fe2O3 | + | 6 HNO3 | = | 2 Fe(NO3)3 | + | 3 H2O |
| С |
| С |
| С |
| С |
|
|
|
|
|
|
|
|
| 2 исходных |
|
|
| 2 продукта |
|
|
| (реакция обмена, |
|
|
|
|
|
|
Схемы для поверочной работы.
1) Fe2O3 + C → Fe + CO↑
2) O2 + Fe → Fe3O4
3) NaClO3 → O2↑ + NaCl
4) SnO2 + HCl → SnCl4 + H2O
I. ТЕСТ
1. Какой из признаков относится к признакам химической реакции:
1) испарение воды; 2) выделение газа; 3) плавление металла.
2. Какой из металлов не будет взаимодействовать с серной кислотой: 1) Hg; 2) Mg; 3) Zn.
3. Реакция Cu + HgSO4 = CuSO4 + Hg относится к реакциям:
1) соединения; 2) разложения; 3) замещения.
4. Коэффициент перед хлором в уравнении реакции, схема которой P + Cl2 = PCl5 равен:
1) 2; 2) 5; 3) 7.
5. Реакция, имеющая общий вид типа: АВ = А + В относится к реакциям:
1) соединения; 2) разложения; 3) замещения.
6. Выберите уравнение реакции, соответствующее следующему описанию: натрий взаимодействует с водой, при этом образуется гидроксид натрия и выделяется водород.
1) Na2O + H2O = 2NaOH; 2) Na + H2O = NaOH + H2; 3) 2Na + 2H2O = 2NaOH + H2.
II. СООТНЕСИТЕ
| РЕАКЦИЯ | ТИП |
| 1) 2H2 + O2 = H2O | А) РАЗЛОЖЕНИЕ |
| 2) SO3 + H2O = H2SO4 | Б) СОЕДИНЕНИЕ |
| 3) 3 Mg + 2 AlCl3 = 3MgCl2 + 2 Al | В) ЗАМЕЩЕНИЕ |
| 4) 2 KClO3 = 2 KCl + 3 O2 | Г) ОБМЕН |
| 5) Fe2O3 + 2 Al = 2 Fe + Al2O3 |
|
| 6) 2 Fe(OH)3 = Fe2O3 + 3 H2O |
|
| 7) Al2O3 + 6HCl = 2AlCl3 + 3H2O |
|
III. Выберите верные утверждения:
1. Реакция обмена - это реакция между простыми и сложными веществами.
2. Реакция обмена протекает между сложными веществами, которые обмениваются своими составными частями.
3. Реакция обмена идет до конца только тогда, когда образуется вода.
4. Реакция обмена идет до конца, когда образуется газ, осадок или вода.
5. Реакция между cильной кислотой и щелочью называется реакцией нейтрализации.
6. Любая реакция обмена является реакцией нейтрализации.
7. HNO3 + NaOH → NaNO3 + H2O - это реакция обмена и нейтрализации.
8. CuO + H2SO4 → CuSO4 + H2O - это реакция обмена.
9. Al2O3 + 6HCl → 2AlCl3 + 3H2O - это реакция нейтрализации.
IV. Выберите верный ответ
1. Образование из двух простых веществ одного сложного – это реакция:
а) разложения б) замещения в) соединения г) обмена.
2. Образование из одного сложного вещества нескольких более простых – это реакция:
а) разложения б) замещения в) соединения г) обмена.
3. Реакции, при которых атомы простого вещества замещают атомы в сложном веществе – это реакции: а) разложения б) замещения в) соединения г) обмена.
4. Реакции, протекающие между двумя сложными веществами, обменивающимися своими составными частями – это реакции:
а) разложения б) замещения в) соединения г) обмена.
5.Укажите реакцию замещения:
а) Fe + O2 → Fe3O4 б) Mg + HCl → MgCl2 + H2
в) HgO → Hg + O2 г) FeO + HNO2 → Fe(NO2)2 + H2O .
САМОСТОЯТЕЛЬНАЯ РАБОТА № 10
| Решить задачи по уравнению химической реакции | 3 ч. |
Алгоритм решения задач по химическим уравнениям
Способ 1. «По количеству вещества»
1шаг: Прочитай задачу. Определите массу кислорода необходимого для сжигания 8 г магния.
2 шаг: Запиши дано задачи, найти, молярные массы веществ, используя соответствующие обозначения.
m (Мg)=8 г
m (02)=?
M (Мg) = 24г/моль
M (02) = 32г/моль
3 шаг: Составь уравнение реакции: 2Мg + 02 = 2 Мg0
4 шаг: Найди количество известного вещества по формуле
ν = m : М
ν (Мg)= m (Мg): M(Мg)= 8г:24г/моль= 0,33 моль
5 шаг: Поставь полученное количество вещества над формулой вещества, над формулой неизвестного поставь х
0,33 моль х моль
2Мg + 02 = 2Мg0
6 шаг: Под формулами веществ запиши количество вещества необходимых для реакции:
0,33 моль х моль
2Мg + 02 = 2МgО
2 моль 1 моль
7 шаг: Составь пропорцию и реши ее:
0,33 моль - х моль
2 моль - 1 моль х=0,167 моль
8 шаг: Найди массу неизвестного вещества по формуле m = М · ν:
m (02)= М (02) · ν (02) = 0,167 моль ·32 г/моль=5,344 г
9 шаг: Запиши ответ: масса кислорода 5,344 г.
Способ 2. «По массе вещества»
1 шаг: Прочитай задачу. Определите массу кислорода необходимого для сжигания 8 г магния.
2 шаг: Запиши дано задачи, найти, молярные массы веществ, используя соответствующие обозначения.
m (Мg)=8 г
m (02)=?
М (Мg) = 24г/моль
М(02) = 32г/моль
3 шаг: Составь уравнение реакции 2Мg + 02 = 2 МgО
4 шаг: Над формулой известного вещества записать массу, над формулой неизвестного вещества поставить х г.
8 г х г
2Мg + 02 = 2 МgO
5 шаг: Под формулами веществ, о которых идет речь, записать массы веществ, рассчитанные по формуле m= M· ν, где ν - коэффициент перед формулой вещества:
8 г х г
2Мg + 02 = 2 МgO
48 г 32 г
6 шаг: Составь пропорцию и решите ее:
8 г - х г
48 г - 32 г m(02)=х = 5,34г
7 шаг: Запиши ответ: масса кислорода 5,34 г
Задача
В раствор, содержащий 1,2 моль НCl опустили избыток алюминия. Какой объём водорода выделится при этом?
Решение. Составим уравнение реакции и запишем, что дано в ней, над формулами соединений. При этом обязательно указывайте размерность.

Задача Сколько граммов алюминия нужно растворить в соляной кислоте, чтобы получить 5,6 л водорода?
Решение. Составим уравнение реакции и запишем, что дано в ней, над химическими формулами соединений. При этом обязательно указывайте размерность.

В случае, когда нужно определить объёмы реагирующих газов, можно воспользоваться следствием из закона Авогадро.
Объёмы реагирующих газов относятся как их коэффициенты в уравнении химической реакции.
Задача . Какой объём углекислого газа выделится при полном сгорании 6 л ацетилена С2Н2?
Решение.

Часть 2.
Задачи для самостоятельного решения
Рассчитайте массу и количество вещества углекислого газа, если разложилось 10 г карбоната кальция (СаСО3).
Сколько грамм сульфида алюминия (Al2S3) можно получить при взаимодействии 2,7 г алюминия с серой.
Какое количество вещества водорода прореагировало с углеродом, если образовалось 0,3моль метана (СН4).
Вычислите количество вещества оксида алюминия, образовавшегося в результате взаимодействия алюминия количеством вещества 0,27 моль с кислородом.
Вычислите количество вещества оксида натрия, образовавшегося в результате взаимодействия натрия количеством вещества 2,3 моль с кислородом.
Вычислите массу серы, необходимую для получения оксида серы (IV) количеством вещества 4 моль.
Вычислите массу лития, необходимого для получения хлорида лития (LiCl) количеством вещества 0,6 моль.
Вычислите количество вещества сульфида натрия (Na2S), если в реакцию с натрием вступает сера массой 12,8 г.
Вычислите количество вещества образующейся меди, если в реакцию с водородом вступает оксид меди (II) массой 64 г.
САМОСТОЯТЕЛЬНАЯ РАБОТА № 11
| Составить электронные формулы 20 химических элементов | 2 ч. |
Алгоритм (порядок действий) записи электронных формул.
1.Записываем знак химического элемента и заряд ядра его атома — он равен порядковому номеру элемента.
2. Определяем количество энергетических уровней — оно равно номеру периода.
3. Определяем количество электронов на каждом уровне.
3. Составляем электронную формулу, учитывая порядок заполнения электронами каждого энергетического уровня — сначала s-электроны, затем р-электроны. Записываем номер уровня, затем вид орбитали и количество электронов на ней, учитывая их общее количество на энергетическом уровне.
Необходимо помнить, что на первом слое находится максимум 2 электрона 1s2, на втором - максимум 8 (два s и шесть р: 2s2 2p6), на третьем - максимум 18 ( два s, шесть p, и десять d: 3s2 3p6 3d10).
Например, электронная формула углерода: С 1s2 2s2 2p2 (порядковый номер 6, номер периода 2, номер группы 4).
САМОСТОЯТЕЛЬНАЯ РАБОТА № 12
| Охарактеризовать 20 химических элементов по положению в ПС | 2 ч. |
План характеристики элементов по ПСХЭ
1. Порядковый номер элемента (Z), относительная атомная масса (Ar), химический знак
2.Строение атома (заряд ядра, количество протонов, нейтронов, электронов).
3. Распределение электронов по энергетическим уровням, электронная формула, электронно-графическая схема последнего энергетического уровня.
4. Положение элемента в ПС (период, группа, подгруппа), семейство элемента (s, p, d, f).
5.Характер элемента (металл, неметалл, переходный).
6.Формула высшего оксида, название, его характер.
7.Формула гидроксида (основания или кислоты), название, его характер.
8.Состав летучего водородного соединения (для неметаллов главных подгрупп), название, характер.
САМОСТОЯТЕЛЬНАЯ РАБОТА № 13
| Составить схемы образования ковалентной и ионной связей. Заполнить таблицу «Сходство и различия видов химической связи» | 2 ч. |
Прочитайте внимательно краткую теоретическую часть.
Вам известно, что атомы могут соединяться друг с другом с образованием как простых, так и сложных веществ. При этом образуются различного типа химические связи: ионная, ковалентная (неполярная и полярная), металлическая и водородная. Одно из наиболее существенных свойств атомов элементов, определяющих, какая связь образуется между ними – ионная или ковалентная, - это электроотрицательность, т.е. способность атомов в соединении притягивать к себе электроны.
Условную количественную оценку электроотрицательности дает шкала относительных электроотрицательностей.
В периодах наблюдается общая тенденция роста электроотрицательности элементов, а в группах – их падения. Элементы по электроотрицательностям располагают в ряд, на основании которого можно сравнить электроотрицательности элементов, находящихся в разных периодах.
Тип химической связи зависит от того, насколько велика разность значений электроотрицательностей соединяющихся атомов элементов. Чем больше отличаются по электроотрицательности атомы элементов, образующих связь, тем химическая связь полярнее. В зависимости от того, к какому из предельных случаев ближе по своему характеру химическая связь, ее относят либо к ионной, либо к ковалентной полярной связи.
Ионная связь.
Ионная связь образуется при взаимодействии атомов, которые резко отличаются друг от друга по электроотрицательности. Например, типичные металлы литий(Li), натрий(Na), калий(K), кальций (Ca), стронций(Sr), барий(Ba) образуют ионную связь с типичными неметаллами, в основном с галогенами.
Кроме галогенидов щелочных металлов, ионная связь также образуется в таких соединениях, как щелочи и соли. Например, в гидроксиде натрия(NaOH) и сульфате натрия(Na2 SO4 ) ионные связи существуют только между атомами натрия и кислорода (остальные связи – ковалентные полярные).
Ковалентная неполярная связь.
При взаимодействии атомов с одинаковой электроотрицательностью образуются молекулы с ковалентной неполярной связью. Такая связь существует в молекулах следующих простых веществ: H2 , F2 , Cl2 , O2 , N2 . Химические связи в этих газах образованы посредством общих электронных пар, т.е. при перекрывании соответствующих электронных облаков.
Составляя электронные формулы веществ, следует помнить, что каждая общая электронная пара – это условное изображение повышенной электронной плотности, возникающей в результате перекрывания соответствующих электронных облаков.
Ковалентная полярная связь.
При взаимодействии атомов, значение электроотрицательностей которых отличаются, но не резко, происходит смещение общей электронной пары к более электроотрицательному атому. Это наиболее распространенный тип химической связи, которой встречается как в неорганических, так и органических соединениях.
Металлическая связь.
Связь, которая образуется в результате взаимодействия относительно свободных электронов с ионами металлов, называются металлической связью. Этот тип связи характерен для простых веществ - металлов.
Сущность процесса образования металлической связи состоит в следующем: атомы металлов легко отдают валентные электроны и превращаются в положительные заряженные ионы. Относительно свободные электроны, оторвавшиеся от атома, перемещаются между положительными ионами металлов. Между ними возникает металлическая связь, т. е. электроны как бы цементируют положительные ионы кристаллической решетки металлов.
Алгоритм составления ковалентной связи
1. Определить валентные электроны.
2. Определить количество неспаренных электронов.
3. Записать электронную и структурную формулы получившейся молекулы.
Например:
1. Валентные электроны у серы 2s22p4
у хлора 2s22p6
2. Количество неспаренных электронов

3.

а) Ковалентная неполярная связь (КНС) – связь между атомами неметалла с одинаковой ЭО, когда общие электронные пары находятся на одинаковом расстоянии от обоих взаимодействующих атомов и в равной степени принадлежат им обоим. (Например, H2, O2, О3).
Механизм образования связи:
Например, образование молекул водорода Н2 и хлора F2:

б) Ковалентная полярная связь (КПС) – образуют атомы разных неметаллов и общие электронные пары смещены в сторону более ЭО химического элемента (Например, HCl, H2O).
Встречаются исключения, когда ковалентную связь образуют атом неметалла и металла!
Например, AlCl3, разница в электроотрицательности ∆ Э.О.
Механизм образования связи
Каждый атом неметалла отдает в общее пользование другому атому свои наружные неспаренные электроны. Образуются общие электронные пары. Общая электронная пара смещена к более электроотрицательному элементу.

| ИОННАЯ СВЯЗЬ (ИС) – образуется между атомами металлов и неметаллов, т.е. между атомами, резко отличающимися друг от друга по значениям электроотрицательности. (Например, NaCl, K2O, LiF) Механизм образования связи. Атом неметалла забирает наружные электроны у атома металла и превращается в анион (отрицательно заряженный ион). Атом металла теряет электроны и превращается в катион (положительно заряженный ион). Ионы связаны электростатическими силами. Происходит полная отдача (принятие) валентных электронов, перекрывание облаков отсутствует, обобществления электронов не наблюдается. Ионы Рассмотрим механизм образования молекулы фторида натрия: NaF – ис. Электронная схема образования молекулы NaF:
В результате образования связи электронная пара полностью сместилась к атому фтора, разноименно заряженные иона натрия и фтора притягиваются за счёт электростатического взаимодействия. |
Выполните самостоятельно задания.
Распределить данные вещества в таблицу. Согласно их типу химической связи.
| Ионная связь | Ковалентная полярная | Ковалентная неполярная |
| | | |
MgCl2, H2, CO2, NaI2, HF, Al, ZnO, Fe, Br2, Ca3N2, O2, SO3, HBr, Al2S3, CuSn(сплав)
На ваш выбор, изобразите схему образования химической связи, выбрав соединение из каждого столбика.
Покажите образование ионной связи между атомами Na и S. Обратите внимание на количество электронов, которое отдаст натрий и на количество электронов, которое принимает сер. После выполнения данного задания ответьте на вопросы:
Сколько атомов натрия необходимо взять для образования ионной связи между ним и серой? Почему?
Объясните почему атом натрия отдает электроны? Почему атом серы принимает электроны?
В чем сущность ионной связи? Чем она отличается по механизму образования от ковалентной связи?
В какой паре атомов химическая связь имеет ярко выраженный ионный характер: К - F, O - F, F - F, P - F ?
Составьте электронные схемы строения молекул. В какой молекуле связь ковалентная полярная: CI2, O2, HI, KCI?
Даны вещества: H2SO4, PCI5, Br2, CO2, Fe, H2O. Определите тип химической связи.
Сколько общих пар возникает при образовании молекул азота?
Произведите соответствие:
| Виды связи | Вещества |
| 1.Ковалентная неполярная | А) Хлорид кальция |
| 2.Ковалентная полярная | Б) Фтор |
| 3.Ионная | В) Цинк |
|
| Г) Аммиак |
|
| Д)Ацетилен |
|
| Е) Оксид бария |
Составить электронную схему образования: CaО, Na2О, AlCl3, K2O, Li2O, Ba3N2.
САМОСТОЯТЕЛЬНАЯ РАБОТА № 14
| Выполнить задание на определение степени окисления химических элементов в различных соединениях. Работа по карточкам на классификацию неорганических соединений | 2 ч |
1. Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения (и ионные, и ковалентные полярные) состоят из ионов.
2. С.О. положительная “+” и отрицательная “-” ставится над знаками элементов перед цифрами, в том числе и единицей.
ПРАВИЛА:
Степень окисления свободных атомов и простых веществ равна 0: (![]() ; Mg0)
; Mg0)
Степень окисления водорода в соединениях с неметаллами равна +1, а с металлами равна -1: (NaH-1, H+1Cl).
Степень окисления фтора в соединениях всегда равна -1: (HF-1, CaF-12).
Степень окисления кислорода в соединениях равна -2 (NO-2, Al2O-23), а в пероксидах -1 (H2O-12, O+1F2)
Степень окисления металлов в соединениях всегда положительная , у металлов I-A, II-A, III-A соответственно равна +1, +2, +3 .
Суммарная степень окисления всех атомов в молекуле равна 0.
Высшая степень окисления элемента равна (+№ группы).
Низшая степень окисления: для металлов равна 0, для неметаллов равна (№ группы -8).
Элементы в высшей степени окисления могут только принимать электроны
Элементы в низшей степени окисления могут только отдавать электроны
Элементы в промежуточной степени окисления могут и принимать, и отдавать электроны.
Из перечисленных формул выпишите формулы: оксидов, кислот, оснований и солей. Дайте названия веществам.
К2О, FеСl2, НСl, РbO2, Мn2O7, Ag2O, Fе(ОН)3, НNO3 , СаSO3, AgСl, КОН. Na Сl, Fе2О3, KСl, СаSO2, Cl2O7,
Ag2O, Са(ОH)2, Al2О3.
Дайте названия веществам.
К2О, FеО, НСl, РbO2, Мn2O7, Ag2O, Fе2О3, , Na 2О, Fе2О3, KСl, SO2, Cl2O7,
Ag2O, H2, Al2О3. Li 2О, Fе2О3, Na Сl, SO3, Cl2O7, HgO, О2, Cr2О3.
Расставить степени окисления в соединениях: Na; K2O; Fe; CaCO3; AlCl3; Li3N; BaSO4; Zn; H2CO3; O3; OF2; CuSO4; NaOH; O2; SO3; KH; KOH; BaH2; H2O; NH3.
САМОСТОЯТЕЛЬНАЯ РАБОТА № 15
| Составить опорный конспект по теме Растворы | 1 ч. |
| Решить задачи по теме «Массовая доля растворенного вещества» | 1ч. |
Теория
Рассмотрим примеры расчётов с массовой долей растворённого вещества.
Пример:
в 120 г раствора содержится 24 г хлорида натрия. Определи массовую долю хлорида натрия в растворе.
Массовая доля растворённого вещества в растворе вычисляется по формуле:
w(в−ва)=m(в−ва)m(р−ра);
w(NaCl)=m(NaCl)m(р−ра)=24120=0,2.
Ответ: w(NaCl)=0,2.
По известной массе раствора и массовой доле растворённого вещества можно определить массу этого вещества.
Пример:
вычисли массу серной кислоты, содержащейся в 200 г раствора с массовой долей растворённого вещества, равной 0,64.
Массу растворённого вещества вычислим по формуле: m(в−ва)=w(в−ва)⋅m(р−ра);
m(H2SO4)=w(H2SO4)⋅m(р−ра)=0,64⋅200=128 г.
Ответ: m(H2SO4)=128 г.
Если известна масса растворённого вещества и его массовая доля, можно найти массу раствора.
Пример:
в какой массе 10%-го раствора содержится 6 г гидроксида натрия?
Переведём массовую долю: w(NaOH)=0,1.
Массу раствора вычислим по формуле: m(р−ра)=m(в−ва)w(в−ва).
m(р−ра)=m(NaOH)w(NaOH)=60,1=60 г.
Ответ: m(р−ра)=60 г.
1). Сколько сухой соли образуется в чашке после выпаривания 150г. раствора с массовой долей этой соли 15%.
2). Смешали 250г. раствора с массовой долей серной кислоты 20% и 150г. раствора с массовой долей серной кислоты 10%. Определите массовую долю кислоты в полученной смеси.
3). К 140г. 5% -ного раствора соли добавили 60 мл. воды. Какова массовая доля соли в полученном растворе?
4). 150г. 4%- ного раствора селитры упарили до
120г. Определите массовую долю в полученном растворе.
5). Определите массу воды и азотной кислоты, содержащихся в 1,5 кг. Раствора с массовой долей этой кислоты 20%.
6). В 180г. 15% раствора гидроксида натрия растворили ещё 20г. щёлочи. Рассчитайте массовую долю щёлочи в полученном растворе.
7). Массовая доля солей в морской воде достигает 3,5%. Морскую воду массой 300г выпарили досуха. Вычислите массу остатка.
8). Вычислите массовую долю растворенного вещества, если в 150 г. воды растворили 7 г. соли.
9). Смешали 150 г. раствора с массовой долей серной кислоты 10 % и 250 г. раствора с массовой долей серной кислоты 8 %. Определите массовую долю кислоты в полученной смеси.
10). Вычислите массы соли и воды, необходимые для приготовления 300 г. раствора с массовой долей соли 15 %.
САМОСТОЯТЕЛЬНАЯ РАБОТА № 16
| Выполнить задания по теме «Химические свойства кислот, оснований в свете теории ЭД» | 2ч. |
Современная теория электролитической диссоциации говорит о том, что при растворении в воде электролиты распадаются на ионы. Пользуясь этой теорией, и знаниями о свойствах и классификации кислот ответьте на следующие вопросы:
Изучите химические свойства кислот в свете теории ЭДС.
С какими из перечисленных веществ взаимодействует раствор серной кислоты:
хлорид натрия, карбонат натрия, цинк, оксид меди(2),оксид углерода(4), медь, хлорид бария. Запишите уравнения реакций.
Изучите химические свойства оснований в свете теории ЭДС.
С какими из перечисленных веществ взаимодействует раствор гидроксида натрия : соляная кислота, хлорид меди(2), оксид меди(2),оксид углерода(4), медь, карбонат кальция.. Запишите уравнения реакций .
С какими из перечисленных веществ взаимодействует разбавленная серная кислота.
гидроксид калия
ртуть
оксид магния
оксид фосфора
алюминий
Запишите возможные реакции в ионном виде
Даны сокращенные ионные уравнения:
1) Ва2+ + SO42- = BaSO4
2) СO32- + 2H+ = CO2 + H2O
Составить полные ионные и молекулярные уравнения
Из перечня кислот: серная кислота, азотная кислота, сернистая кислота,
хлороводородная кислота, кремниевая кислота, угольная кислота выберите:
кислородсодержащие
нестабильные
нерастворимые в воде
двухосновные
Серная кислота не взаимодействует с металлом:
1. Мg 2. Cu 3. AL 4. Zn
7. С веществами какой группы будет реагировать раствор NaOH:
а) Cu, CO2, Cu(OH)2 б) HCl, SO3, CuSO4 в) Fe2O3, H2SO4, CaCO3 г) S, SO2,Na2S.
8. С какими оксидами не взаимодействует раствор KOH::
а) SО2 б) CO2 в) N2O5 г) MgO.
9. Что образуется при взаимодействии раствора Ca(OH)2 и P2O5:
а) соль и вода в) новое основание и новый оксид
б) соль и водород г) соль и кислота.
10. Что образуется при взаимодействии раствора Ba(OH)2 и H2SO4:
а) BaSO4 и H2 б) BaSO4 и SO2 в) BaSO4 и H2O г) BaSO4 и SO3.
11. В каком случае реакция протекает до конца:
а) Na2SO4 + NaOH б) K2CO3 + LiOH в) KNO3 + Ca(OH)2 г) K2SO4 + Ba(OH)2.
12. кислоты вступают во взаимодействие с...
а) металлами, солями, основаниями
б) оксидами неметаллов, металлами, основаниями, солями
в) кислотами, оксидами металлов, солями
г) солями, оксидами металлов, основаниями. металлами
Задание
1. Гидроксид калия реагирует с каждым из перечисленных веществ
1) CO2 и Fe 2) Fe и Al2O3 3) Al2O3 и FeCl3 4)FeCl3 и Mg(OH)2
2. Гидроксид натрия может реагировать с:
1) NaNO3 2) SO2 3) ВаО 4)Zn(ОН)2 5)СuSО4 6) Сu
3. Гидроксид кальция не взаимодействует с 1)HCl 2) CO2 3) ZnS 4) HNO3
4. Разбавленная серная кислота реагирует с каждым из двух веществ
1) Nа2SiO3 и НNO3 2) FеО и КNО3 3) Ag и Сu(ОН)2 4) Fе и А12О3
5. Не прореагирует раствор серной кислоты с
1) хлоридом бария 2) карбонатом кальция 3) нитратом калия 4) оксидом магния
6. Укажите пару веществ, которые полностью растворяются в соляной кислоте.
1) FеS, РbS 2) ВаSО4, МgSО4 3) СаСО3, СаSО3 4) Cu, Na2S
САМОСТОЯТЕЛЬНАЯ РАБОТА № 17
| Выполнить задания по теме Химические свойства солей в свете теории ЭД | 1ч. |
Изучите химические свойства солей в свете теории ЭДС.
Закончите уравнения возможных реакций:
Хлорид меди(2) +нитрат серебра
Хлорид кальция + азотная кислота
Хлорид бария+ сульфат натрия
Карбонат натрия +серная кислота
Сульфат меди (2) + цинк
Сульфат меди (2) + серебро
Задание
1. Химическая реакция возможна между
1) Сu и НСl 2) Fе и Nа3РО4 3) Аg и Мg(NО3) 2 4) Zn и FеСl2
2. Для карбоната калия не характерно взаимодействие в растворе с
1) хлоридом кальция 2) сульфатом бария
3) оксидом углерода (IV) 4) азотной кислотой
3. Раствор сульфата меди (II) реагирует с каждым двух веществ
1)НС1 и Н2SiO3 2) О2 и НNO3 3) Н2O и Сu(ОН)2 4) NаОН и ВаС12
4. С хлоридом меди (II) CuCl2 не взаимодействует:
1) Zn 2)Al 3) Ag 4) Fe
5.Хлорид железа (II) FeCl2 вступает в реакцию только с:
1) КOH 2) CuO 3) SO2 4) Cu
6. Схеме: сульфат калия + хлорид бария = сульфат бария + хлорид калия соответствует уравнение:
7) K2SO4 + BaCl2 = BaCl2 + K2SO4 3) K2SO4 + BaCl2 = BaSO4 + KCl
8) K2SO4 + BaCl2 = BaSO4 + KCl 4) K2SO4 + BaCl2 = BaSO4 + 2KCl
9) Металл, способный вытеснить свинец из раствора нитрата свинца
1) Na 2) Zn 3) Hg 4) Ag
4. Соль, которая реагирует с раствором гидроксида натрия
1) BaSO4 2) (NH4 )2 SO4 3) Na2 SO4 4) KCl
5.Какая из предложенных реакций не протекает:
1) AlCl3 + 3NaOH = Al(OH)3 + 3NaCl
2) Ag NO3+ NaCl = AgCl + NaNO3
3) КCl + NaNO3 = KNO3 + NaCl
4) Zn + FeCl2 = ZnCl2 + Fe
1. При диссоциации солей в качестве анионов образуются только:
1) ионы водорода 3) гидроксид-ионы
2) ионы кислотных остатков 4) ионы металлов
2. Соль, которая реагирует с раствором соляной кислоты
1) K2 CO3 2) KOH 3) NaNO3 4) K2SO4
3. Металл, способный вытеснитьмедь из раствора хлорида меди (II)
1) K 2) Hg 3)Zn 4) Ag
4. Хлорид меди (II) взаимодействует с каждым веществом из пары:
1) SO3и NaOH 3) AgNO3и NaOH
2) NaOH и H2O 4) NaOH и CaO
5. Гидроксид железа (III) получается при взаимодействии:
1) сульфата железа(II) с хлоридом бария
2) нитрата железа (II) c гидроксидом калия
3) хлорида железа (III) c гидроксидом натрия
4) сульфата железа (III) с водой
САМОСТОЯТЕЛЬНАЯ РАБОТА № 18
| Работа по карточкам с заданиями по теме «Генетическая связь между классами неорганических соединений» | 2 ч. |
Генетические связи - это связи между разными классами, основанные на их взаимопревращениях.
Зная классы неорганических веществ, можно составить генетические ряды металлов и неметаллов. В основу этих рядов положен один и тот же элемент.
Среди металлов можно выделить две разновидности рядов:
Генетический ряд, в котором в качестве основания выступает щёлочь. Этот ряд можно представить с помощью следующих превращений:
металл→основный оксид→щёлочь→соль
Например, K→K2O→KOH→KCl
Генетический ряд, где в качестве основания выступает нерастворимое основание, тогда ряд можно представить цепочкой превращений:
металл→основный оксид→соль→нерастворимое основание→ основный оксид→металл
Например, Cu→CuO→CuCl2→Cu(OH)2→CuO→Cu
Среди неметаллов также можно выделить две разновидности рядов:
Генетический ряд неметаллов, где в качестве звена ряда выступает растворимая кислота. Цепочку превращений можно представить в следующем виде:
неметалл→кислотный оксид→растворимая кислота→соль
Например, P→P2O5→H3PO4→Na3PO4
Генетический ряд неметаллов, где в качестве звена ряда выступает нерастворимая кислота:
неметалл→кислотный оксид→соль→кислота→ кислотный оксид→неметалл
Например, Si→SiO2→Na2SiO3→H2SiO3→SiO2→Si

Задание
Ряд, в котором представлены формулы веществ каждого из четырёх классов неорганических соединений: А. P2O5, H2SO4, H2SO3, NaOH. Б. SO2, H2SiO3, MgSO4, CuO. В. CO2, H2S, K2SO3, KOH.
В генетическом ряду Li Li2O X LiCl веществом Х является вещество с формулой:
А. Li. Б. LiOH. В. HCl.
Формула гидроксида, соответствующего оксиду фосфора (V): А. HPO2. Б. H3PO3. В. H3PO4.
Генетическим рядом является ряд, схема которого: А. SO3 H2SO4 CaSO4. Б. ZnCl2 Zn(OH)2 H2O. В. Al AlCl3 AgCl.
Хлорид меди (II) можно получить при взаимодействии веществ, формулы которых: А. Cu и HCl. Б. CuO и HCl. В. CuOH и HCl.
Пара формул веществ, взаимодействующих друг с другом: А. Ag и HCl. Б. SO2 и NaOH. В. CuO и NaOH.
Соляная кислота вступает в реакцию: А. С магнием. Б. С оксидом серы (IV). В. С серебром.
В схеме превращений P +X P2O5 +Y H3PO4 вещества X и Y имеют формулы: А. X - H2O, Y - HCl. Б. X – O2, Y – H2. В. X – O2, Y - H2O.
В генетическом ряду Э Э2О5 H3 ЭО4 Na3ЭO4 элемент Э - это: А. Калий. Б. Сера. В. Фосфор.
Ряд формул оксидов, в котором каждый из них взаимодействует с водой при обычных условиях: А. CO2, Li2O, SO3. Б. CuO, P2O5, CaO. В. BaO, FeO, ZnO.
Осуществите превращения по схеме, укажите типы реакций, назовите вещества 1.Al→Al2O3→AlCl3→Al(OH)3→Al2O3
2. P→P2O5→H3PO4→Na3PO4→Ca3(PO4)2
3. Zn→ZnCl2→Zn(OH)2→ZnO→Zn(NO3)2
4.Cu →CuO→CuCl2→Cu(OH)2→CuO→Cu
5.N2O5→HNO3→Fe(NO3)2→Fe(OH)2→FeS→FeSO4
Тематический план внеурочной самостоятельной работы по химии
обучающихся 9 класс ФГОС ЗФО (1 час в неделю) ФКУ ИК-22
| № п/п
| Наименование разделов и тем программы | Макс. нагрузка (час) | № сам. раб | Вид и тема самостоятельной работы | Учебная нагрузка (час) |
| 1 | Раздел 1. Общая характеристика химических элементов, веществ и химических реакций. | 11ч. | 1 | Составить опорный конспект «Периодический закон и периодическая система Д.И. Менделеева в свете учения о строении атома» | 2 |
| 2 | Охарактеризовать 20 химических элементов по положению в ПС. | 1 | |||
|
|
|
| 3 | Составить опорный конспект «Характеристика химического элемента по кислотно – основным свойствам его соединений» | 2 |
|
|
|
| 4 | Работа по карточкам по теме «Классификация химических соединений» | 1 |
|
|
|
| 5 | Составить опорный конспект « Катализ» | 2 |
|
|
|
| 6 | Заполнить таблицу «Факторы, влияющие на скорость химической реакции» | 1 |
|
|
|
| 7 | Подготовить конспект «Основные положения теории окислительно-восстановительных реакций» | 2 |
|
| Раздел 2. Металлы | 6 | 8 | Подготовить опорный конспект « Металлургическая промышленность» | 2 |
|
|
|
| 9 | Составить опорный конспект «Алюминий его свойства и соединения» | 2 |
|
|
|
| 10 | Подготовить план-конспект «Чугун и его значение в промышленности, транспорте, быту и искусстве» | 2 |
|
| Раздел 3 Неметаллы | 9 | 11 | Составить опорный конспект «Общая характеристика неметаллов. Получение важнейших соединений неметаллов» | 2 |
|
|
|
| 12 | Составить план - конспект «Галогены и их соединения» | 2 |
|
|
|
| 13 | Заполнить таблицу «Аллотропные модификации кислорода» | 1 |
|
|
|
| 14 | Составить опорный конспект «Кислородосодержащие соединения серы» | 1 |
|
|
|
| 15 | Заполнить таблицу «Кислородосодержащие соединения азота» | 1 |
|
|
|
| 16 | Составить опорный конспект «Кислородосодержащие соединения углерода». | 2 |
|
| Раздел 4. Краткие сведения об органических соединениях | 6 | 17
| Подготовить сообщение «Природные источники углеводородов». Решить задачу 1. по уравнению горения | 2 |
|
|
|
| 18 | Составить опорный конспект «Кислородосодержащие органические соединения» | 2 |
|
|
|
| 19 | Составить опорный конспект «Азотосодержащие органические соединения» | 2 |
|
| Раздел 5. Обобщение знаний по химии за курс основной школы. | 3 | 20 | Выполнить тестовые задания по курсу химии основной школы | 3 |
|
|
| 35 | 20 |
| 35 |
Дидактический материал для проведения внеурочной
самостоятельной работы по химии
для обучающихся 9 класса ОЗФО (35 часов)
Учебник: Химия. 9 класс О.С. Габриелян, И.Г. Остроумов, С.А. Сладков
САМОСТОЯТЕЛЬНАЯ РАБОТА № 1
| Составить опорный конспект «Периодический закон и периодическая система Д.И. Менделеева в свете учения о строении атома» | 2 ч. |
САМОСТОЯТЕЛЬНАЯ РАБОТА № 2
| Охарактеризовать 20 химических элементов по положению в ПС | 1 ч. |
САМОСТОЯТЕЛЬНАЯ РАБОТА № 3
| Составить опорный конспект по теме Характеристика химического элемента по кислотно – основным свойствам его соединений | 2 ч. |
САМОСТОЯТЕЛЬНАЯ РАБОТА № 4
| Работа по карточкам по теме Классификация химических соединений | 1 ч. |
САМОСТОЯТЕЛЬНАЯ РАБОТА № 5
| Заполнить таблицу Классификация химических реакций. Составить опорный конспект по теме Катализ | 2 ч. |
САМОСТОЯТЕЛЬНАЯ РАБОТА № 6
| Заполнить таблицу Факторы, влияющие на скорость химической реакции | 1 ч. |
САМОСТОЯТЕЛЬНАЯ РАБОТА № 7
| Подготовить конспект «основные положения теории окислительно-восстановительных реакций. Составить уравнения окислительно-восстановительных реакций | 2 ч. |
План конспекта
Определение
Окисление
Восстановление
Окислитель
Восстановитель
№1. Определите степень окисления атомов химических элементов по формулам их соединений: H2S, O2, NH3, HNO3, Fe, K2Cr2O7
№2. Определите, что происходит со степенью окисления серы при следующих переходах:
А) H2S → SO2 → SO3
Б) SO2→ H2SO3 → Na2SO3
Какой можно сделать вывод после выполнения второй генетической цепочки?
На какие группы можно классифицировать химические реакции по изменения степени окисления атомов химических элементов?
№3. Расставьте коэффициенты в УХР методом электронного баланса, укажите процессы окисления (восстановления), окислитель (восстановитель); запишите реакции в полном и ионном виде:
А) Zn + HCl = H2+ ZnCl2
Б) Fe + CuSO4 = FeSO4 + Cu
№4. Даны схемы уравнений реакций:
СuS + HNO3(разбавленная) = Cu(NO3)2 + S + NO + H2O
K + H2O = KOH + H2
Расставьте коэффициенты в реакциях используя метод электронного баланса.
Укажите вещество - окислитель и вещество - восстановитель.
Задача 1. Какие соединения и простые вещества могут проявлять только окислительные свойства? Выберите такие вещества из предложенного перечня: NH3, CO, SO2, K2MnO4, Сl2, HNO2. Составьте уравнение электронного баланса, расставьте коэффициенты в уравнении реакции:
HNO3 + H2S = H2SO4 + NO + H2O.
Задача 2. Почему азотистая кислота может проявлять как окислительные, так и восстановительные свойства? Составьте уравнения реакций HNO2: а) с бромной водой; б) с HI; в) с KMnO4. Какую функцию выполняет азотистая кислота в этих реакциях?
САМОСТОЯТЕЛЬНАЯ РАБОТА № 8
| Подготовить опорный конспект Металлургическая промышленность. Металлы в природе | 2 ч. |
САМОСТОЯТЕЛЬНАЯ РАБОТА № 9
| Составить опорный конспект «Алюминий и его соединения» Выполнить задания по теме Химические свойства алюминия» | 2 ч. |
Какое из физических свойств не характерно для алюминия:
А) высокая теплопроводность; б) электропроводность; в) тугоплавкость; г) высокая пластичность.
В промышленности алюминий получают методом:
А) пирометаллургии; б) гидрометаллургии; в) электрометаллургии г) всеми перечисленными способами.
С какими из перечисленных веществ реагирует алюминий: сера (1), магний (2), оксид хрома (3); концентрированная серная кислота (4); раствор гидроксида натрия (5); раствор сульфата меди (6):
А) 1,3,4,5; б) 1,3,5,6; в) 1,2,4,6; г) 1,4,5,6. Напишите уравнения необходимых реакций.
Оксид алюминия обладает:
А) основными свойствами; б) кислотными свойствами; в) амфотерными свойствами; г) это несолеобразующий оксид.
С какими из перечисленных веществ реагирует гидроксид алюминия: соляная кислота (1); гидроксид калия (2); вода (3); сульфат калия (4); железо (5):
А) 1,2,3; б) 1,2; в) 1,4,5; г) 1,2,4. Напишите уравнения соответствующих реакций.
С какими из перечисленных веществ реагирует оксид алюминия: раствор серной кислоты (1); гидроксид лития (2); сера (3); сульфит натрия (4); медь (5):
А) 1,2,3; б) 1,2; в) 1,4,5; г) 1,2,4. Напишите уравнения соответствующих реакций.
7. Алюминий не реагирует при обычных условиях с раствором:
А) соляной кислоты; Б) гидроксида натрия;
В) сульфата меди(ІІ); Г) концентрированной азотной кислоты.
8. Укажите верное суждение:
А) реакция алюминия с серой относится к реакциям замещения;
Б) реакция алюминия с раствором хлорида ртути(ІІ) относится к реакциям соединения;
1) верно только а; 2) верно только б; 3) верны оба суждения; 4)оба суждения неверны.
9. Поставьте коэффициенты в уравнении реакции:
Fe3O4 + Al → Fe + Al2O3.
Ответ дайте в виде коэффициента перед восстановителем.
А) 8; Б) 9; В) 3; Г) 4.
Гидроксид алюминия реагирует с растворами:
А) кислот, но не оснований; Б) оснований, но не кислот;
В) и кислот и оснований; Г) не реагирует с такими растворами.
12. Реакция, протекающая при горении бенгальских огней
А) 2Al + Br2 = 2AlBr3 Б) 4Al + 3O2 = 2Al2O3
В) 4Al + 3C = Al4C3 Г) 2Al + 3S = Al2S3
13. Формула гидроксида алюминия
А) AlOH Б)Al(OH)2 В) Al(OH)3 Г) H3AlO3
14. Продукт реакции взаимодействия алюминия с водным раствором гидроксида натрия
А) Al(OH)3 Б) Al2O3 В) NaAlO2 Г) Na[Al(OH)4]
15. С алюминием не вступает в реакцию
А) сера Б) серная кислоты (конц.) В) гидроксид натрия (р-р) Г) хлорид натрия
САМОСТОЯТЕЛЬНАЯ РАБОТА № 10
| Подготовить план-конспект «Чугун и его значение в промышленности, транспорте, быту и искусстве» | 2 ч. |
САМОСТОЯТЕЛЬНАЯ РАБОТА № 11
| Составить опорный конспект «Общая характеристика неметаллов. Получение важнейших соединений неметаллов» | 2 ч. |
САМОСТОЯТЕЛЬНАЯ РАБОТА № 12
| Составить план - конспект «Галогены и их соединения» Решить расчетную задачу на свойства галогенов | ч. |
План-конспект «Галогены»
Что такое галогены
Перечень и общая характеристика
Физические свойства
Химические свойства
Получение галогенов
Применение галогенов и их соединений
Задание
При взаимодействии 20 г металла с соляной кислотой выделилось 11,2 л водорода (н.у.). Определите исходный металл, если он в своих соединениях имеет степень окисления +2.
Один из оксидов хлора содержит 47,4 % кислорода. Плотность по водороду этого оксида в газообразном состоянии равна 33,75. Установите формулу оксида.
Плотность паров по воздуху хлорида и бромида одного и того же элемента соответственно равна 5,31 и 11,45. Определите, какой химический элемент образует хлорид и бромид.
САМОСТОЯТЕЛЬНАЯ РАБОТА № 13
| Заполнить таблицу Аллотропные модификации кислорода | 1 ч. |
Аллотропия –
Аллотропные модификации кислорода –
Заполнить таблицу
| признаки | кислород | озон |
| состав молекулы |
|
|
| строение |
|
|
| агрегатное состояние и цвет |
|
|
| запах |
|
|
| температура плавления |
|
|
| точка кипения |
|
|
| плотность |
|
|
| растворимость в воде |
|
|
| химическая активность |
|
|
| тип кристаллической решетки |
|
|
Физические свойства: кислорода, озона
САМОСТОЯТЕЛЬНАЯ РАБОТА № 14
| Составить опорный конспект Кислородосодержащие соединения серы | 1 ч. |
План конспекта
Дать общую характеристику кислородных соединений серы, формулы
Характеристика оксидов серы (физические, химические свойства, применение)
Характеристика кислоты (химические и физические свойства, применение)
Характеристика солей (химические и физические свойства, применение)
Задание
Осуществите ряд превращений S→H2S→SO2→SO3→H2SO4
САМОСТОЯТЕЛЬНАЯ РАБОТА № 15
| Заполнить таблицу «Кислородосодержащие соединения азота» | 1 ч. |
Таблица Оксиды азота
| степень окисления | +1 | +2 | +3 | +4 | +5 |
| формула соединения |
|
|
|
|
|
| цвет, агрегатное состояние |
|
|
|
|
|
| специфические свойства |
|
|
|
|
|
Задание
Осуществите ряд превращений N2→NH3→NO→NO2→HNO3→NH4NO3→N2O
САМОСТОЯТЕЛЬНАЯ РАБОТА № 16
| Составить опорный конспект «Кислородосодержащие соединения углерода». Заполнить таблицу «оксиды углерода» | 2 ч. |
Таблица
| свойства | оксид углерода 2 | оксид углерода 4 |
| агрегатное состояние |
|
|
| молекулярная масса |
|
|
| строение молекулы |
|
|
| цвет |
|
|
| запах |
|
|
| растворимость |
|
|
| физиологическое действие |
|
|
Задание
Осуществите ряд превращений CaCO3→CO2→CO→CO2→CaCO3
САМОСТОЯТЕЛЬНАЯ РАБОТА № 17
| Подготовить сообщение Природные источники углеводородов. Решить задачу по уравнению горения | 2 ч. |
Природные источники углеводородов. Нефть, первичная переработка нефти.
План
Основные районы добычи нефти в России
Состав нефти
Первичная переработка нефти
Продукты ее переработки
Последствия экологи ких катастроф
Природные источники углеводородов – каменный уголь
История добычи угля в России
Уголь – ископаемое топливо
Виды угля
Использование угля
Добыча угля
Месторождения угля
Проблемы угольной промышленности
Природный и попутный газ.
Историческое применение природного газа
Месторождения газа.
Переработка газа
Состав природного и попутного газа
Основные направления химических превращений аланов.
Задача
Вычислить сколько сгорело угля, если при этом выделилось 33250 КДж теплоты.
САМОСТОЯТЕЛЬНАЯ РАБОТА № 18
| Составить опорный конспект «Кислородосодержащие органические соединения» Подготовить сообщения» Охрана окружающей среды от химических загрязнений» | 2 ч. |
Функциональная группа
Спирты
Карбонильные соединения (альдегиды и кетоны)
Карбоновые кислоты
САМОСТОЯТЕЛЬНАЯ РАБОТА № 19
| Составить опорный конспект «Азотосодержащие органические соединения» | 2 ч. |
План
Нитросоединения. Амины
Аминокислоты. Белки
Тест
А. Класс органических веществ
1. нитросоединения
2. первичные амины
содержит функциональную группу
1) – О – NO2, 2) – NO2, 3) – NH2, 4) – NO3-
Б. При добавлении лакмуса к бесцветному водному раствору 2-аминопропановой кислоты раствор окрашивается в цвет:
1) красный 2) желтый 3) синий 4) фиолетовый
В. Анилин действует в процессах:
1) нейтрализация муравьиной кислотой 2) вытеснение водорода натрием
3) получение фенола 4) замещение с хлорной водой
Г. Глицин участвует в реакциях
1) окисления с оксидом меди (II) 2) синтеза дипептида с фенилаланином
3) этерификации бутанолом-1 4) присоединения метиламина
Д. Для распознавания изомеров со строением СН3—СН2—СН2—NO2 и NH2—СН(СН3) – СООН следует использовать реактив
1) пероксид водорода 2) бромная вода 3) раствор NaHCO3 4) раствор FeCl3
САМОСТОЯТЕЛЬНАЯ РАБОТА № 20
| Выполнить тестовые задания по курсу химии основной школы | 3 ч |
Тест (Часть №1)
А 1. Число электронов во внешнем электронном слое атома, ядро которого содержит 12 протонов, равно
1) 4 2) 6 3) 8 4) 2
А 2. Какой вид химической связи характерен для меди?
1) ковалентная неполярная 2) металлическая 3) ионная 4) ковалентная полярная
А 3. В каком из соединений степень окисления азота равна −3?
1) N2O3 2) Ba(NO2)2 3) (NH4)2SO4 4)HNO3
A 4. Признаком химической реакции между растворами сульфата меди (II) и гидроксида калия является
1) выделение газа 2) выпадение осадка 3) появление запаха 4) поглощение теплоты
A 5. Краткое ионное уравнение H+ + OH- =H2O отвечает взаимодействию веществ
1) H2CO3 и KOH 2) H3PO4 и Fe(OH)2 3) HCL и KOH 4) HCL и Fe(OH)3
А 6. И кислород, и водород реагируют с
1 ) аммиаком 2) хлором 3) серной кислотой 4) натрием
A 7. Вещество, формула которого
CH3 C2H5 CH3
CH3-C=C-CH-CH-C-CH3 называется
CH3 CH3 CH3
1) 2,3,5,6,6-пентаметил-4-моноэтилгептен-2 3) 2,2,3,5,6- пентаметил-4-моноэтилгептен-5
2) 2,3,4, 5,6,6-гексатаметилгептен-2 4) 2,2,3,4, 5,6- гексаметилгептен-5
А 8. Формула алкина молекулярная масса которого равна 82
C5H8 2) C6H10 3) C7H12 4) C6H6
В 1. При выполнении задания из предложенного перечня ответов выберите два правильных и запишите цифры, под которыми они указаны.
В ряду химических элементов Si –P - S
1) уменьшается атомный радиус
2) уменьшается электроотрицательность
3) возрастает число валентных электронов
4) увеличивается число энергетических уровней
5) уменьшаются кислотные свойства образуемых гидроксидов
В 2. Установите соответствие между схемой окислительно-восстановительной реакции и веществом-восстановителем в ней.
Схема реакции Восстановитель
А) Fe2(SO4)3 + SO2 +H2O→ FeSO4 + H2SO4 1) Fe2(SO4)3
Б) MnO2 + HBr → Br2 +MnBr2 + H2O 2) SO2
В) Fe + HBr → FeBr2 +H2 3) HBr
4) MnO2
5) Fe
В3. При выполнении задания из предложенного перечня ответов выберите два правильных
и запишите цифры, под которыми они указаны.
Для ацетилена верны следующие утверждения:
1) состав молекулы соответствует общей формуле CnH2n
2) является непредельным углеводородом
3) атомы углерода в молекуле соединены двойной связью
4) вступает с водой в реакцию присоединения
5) сгорает с образованием углерода и водорода
Ответ:
С 1. Осуществите превращения: CaC2→C2H2→C2H4→C2H5OH→CH3COH→CH3COOH
C2. Раствор соляной кислоты массой 116,8 г и массовой долей 10% добавили к избытку
сульфида магния. Вычислите объём (н. у.) выделившегося газа.
Тест (часть № 2)
1. Реакцией обмена является взаимодействие:
А) оксида металла и кислоты; Б) металла и кислоты;
В) металла и водорода; Г) оксида металла и водорода.
2. Какое из перечисленных веществ имеет молекулярную кристаллическую решетку:
А) графит; Б) алмаз; В) кварц; Г) олово.
3. Какие металлы входят в состав бронзы:
А) медь и свинец; Б) медь и олово; В) медь и железо; Г) медь и ртуть.
4. При взаимодействии какого металла с водой одним из продуктов реакции будет щелочь:
А) цинк; Б) железо; В) калий; Г) серебро.
5. Взаимодействие цинка с раствором серной кислоты относится к реакциям:
А) соединения; Б) разложения; В) замещения; Г) обмена.
6. Какой из этих ученых назвал кислород «oxygenium»:
А) К. Шееле; Б) А. Лавуазье; В) Д. Пристли; Г) А. Муассан.
7. Какая формула соответствует гидроксиду и оксиду лития:
А) LiOH и LiO; Б) Li(OH)2 и LiO; В) Li(OH)2 и Li2O; Г) Li(OH)2 и LiO2 .
8. Лакмус в растворе серной кислоты:
А) становится фиолетовым; Б) синеет; В) краснеет; Г) не изменяет окраску.
9. Кристаллическая решетка алюминия имеет:
А) металлическую связь; Б) неметаллическую связь;
В) ковалентную связь; Г) водородную связь.
10. Какое из перечисленных веществ сильно ядовито:
А) ортофосфорная кислота; Б) нитрат калия; В) оксид азота IV; Г) азот.
11. Сумма всех коэффициентов в уравнении реакции кальция с водой равна:
А) 3; Б) 5; В) 7; Г) 9.
12. Какую кристаллическую решетку имеет нитрат аммония:
А) атомную; Б) молекулярную; В) ионную; Г) металлическую.
13. Щелочные металлы относятся:
А) к s- элементам; Б) к p- элементам; В) к d- элементам; Г) к f- элементам.
14. Какая реакция в водном растворе не идет:
А)Fe+CuSO4; Б) Zn+HCl ; В) Cu+HCl ; Г) Cu+Hg(NO3)2
15. Какое соединение серы называется пиритом:
А) H2S; Б) ZnS; В)PbS ; Г) FeS2.
16. В состав любой кислоты обязательно входят атомы:
А) водорода; Б) кислорода; В) металла; Г) хлора.
17.С каким космическим телом ассоциировалось в древности золото:
А) Луна; Б) Венера; В) Солнце; Г) Марс.
18. Какой ученый впервые получил бром:
А) А. Баллар; Б) А. Муассан; В) К. Шееле; Г) Б. Куртуа