© 2021, Цыганкова Татьяна Геннадиевна 1287 5


СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока

Сборник практических задач по "Химии"
Данный сборник практических работ составлен по предмету «Химия».
Цель данного сборника – формирование базовых компетенций, развитие у обучаемых способности анализировать, творчески мыслить и использовать фундаментальные знания в процессе решения практических задач.
Просмотр содержимого документа
«Сборник практических задач по "Химии"»
|
| |
|
|
|
әдістемелік комиссиясының
Содержание
| № | Наименование | Стр. |
| 1 | Пояснительная записка | 4 |
| 2 | Раздел «Практические работы по неорганической химии» |
|
|
| №1 Решение экспериментальных задач по теме «Неметаллы» | 5 |
|
| №2 Решение экспериментальных задач по теме «Металлы» | 7 |
|
| №3 Решение экспериментальных задач по теме «Металлы и их соединения» | 9 |
|
| №4 Получение аммиака и изучение его свойств. | 11 |
|
| №5 Решение экспериментальных задач на качественные реакции на некоторые анионы. | 13 |
| 3 | Раздел «Практические работы по органической химии» |
|
|
| №6 Качественное определение углерода, водорода и хлора в органических веществах. | 15 |
|
| №7 Предельные углеводороды. Получение метана и опыты с ним. | 17 |
|
| №8 Непредельные углеводороды. Получение этилена и опыты с ним | 19 |
|
| №9 Предельные одноатомные спирты. Простые эфиры. | 21 |
|
| №10 Многоатомные спирты. Фенол. | 23 |
|
| №11 Синтез бромэтана из спирта. | 25 |
|
| №12 Альдегиды и кетоны. | 27 |
|
| №13 Получение и свойства карбоновых кислот. | 29 |
|
| №14 Экспериментальные задачи по распознаванию органических веществ. | 31 |
|
| №15 Сложные эфиры. Жиры. | 33 |
|
| №16 Мыла и моющие средства. | 35 |
|
| №17 Синтез этилового эфира уксусной кислоты (этилацетата). | 37 |
|
| №18 Исследование свойств глюкозы, сахарозы и крахмала. | 39 |
|
| №19 Экспериментальные задачи на получение и распознавание органических веществ. | 42 |
|
| №20 Качественные реакции на белки. | 43 |
|
| №21 Обобщающие экспериментальные задачи по неорганической и органической химии. | 46 |
| 4 | Критерии оценивания. | 49 |
| 5 | Инструкции (правила) по технике безопасности. | 50 |
| 6 | Список литературы. | 52 |
| 7 | Приложения. | 53 |
Пояснительная записка
Данный сборник практических работ составлен по предмету «Химия».
Цель данного сборника – формирование базовых компетенций, развитие у обучаемых способности анализировать, творчески мыслить и использовать фундаментальные знания в процессе решения практических задач.
Задачи:
- обобщение, систематизация, углубление, закрепление полученных теоретических знаний по конкретным темам изучаемого предмета;
- формирование умений применять полученные знания на практике, реализацию единства интеллектуальной и практической деятельности;
- развитие интеллектуальных, аналитических, проектировочных, конструктивных умений и др.;
- выработку при решении поставленных задач таких профессионально значимых качеств, как самостоятельность, ответственность, точность, творческая инициатива.
Данный сборник состоит из 2 разделов по неорганической и органической химии, в которые включены 21 практические работы.
Перед выполнением практической работы необходимо обучающихся ознакомить с техникой безопасности по данной теме, а также проверить готовность обучающихся к выполнению работы.
Проведение практических работ способствует более успешному усвоению учебного материала, приобретению умений и навыков по химии, с помощью которых можно познавать многообразие природы веществ, накапливать факты для сравнений, обобщений, выводов.
Порядок оформления практической работы:
Записать тему практической работы.
Записать цель работы.
Записать оборудование и реактивы.
Подготовить таблицу результатов протекания реакций.
Выполнить опыты в соответствии с порядком выполнения работы.
Записать наблюдения и выводы работы.
Ответить на вопросы.
ПРАКТИЧЕСКАЯ РАБОТА № 1
Тема: «Решение экспериментальных задач по теме «Неметаллы»».
Цель работы: с помощью качественных реакций на ионы определить состав солей, научиться применять знания на практике о неметаллах.
Оборудование и реактивы: растворы соляной кислоты, гидроксид натрия, карбонат натрия, сульфата аммония, натрия, нитрата бария, хлорида аммония, лакмус, фенолфталеин, карбоната калия, нитрат аммония, фосфат натрия, штатив с пробирками.
Ход работы:
Задача №1 осуществить превращения CuSO4 → Cu(OH)2 → CuCl2
| что делаю | наблюдения | уравнения реакций | вывод |
| К раствору сульфата меди (II) добавляю щелочь | Образуется ……… |
|
|
| К полученному осадку добавляю соляную кислоту | Осадок ……… |
|
|
Задача №2. Распознавание растворов Na2SO4, Na2CO3, NH4Cl.
| что делаю | наблюдения | уравнения реакций | вывод |
| В пробирки приливаем раствор гидроксида натрия | В одной пробирке ощущается запах ….. |
|
|
| В остальные две пробирке приливаю раствор хлорида бария | В одной из пробирок выпадает ……. |
|
|
| В оставшуюся пробирку приливаем раствор соляной кислоты | Выделяются …….. |
|
|
Задача №3 качественная реакция на (NH4)2SO4
| что делаю | наблюдения | уравнения реакций | вывод |
| К исследуемому раствору приливаю раствор щелочи | В пробирке ощущается запах …. |
|
|
| К исследуемому растворуприливаю раствор нитрата бария | В пробирке выпадает ……. |
|
|
Задача №4. Осуществить реакции по схемам Ca2+ + CO32– = CaCO3↓ 2H+ + CO32– = H2O + CO2↑
| что делаю | наблюдения | уравнения реакций | вывод |
| К раствору карбоната калия приливаю раствор соляной кислоты | Выделяются ……. |
|
|
| К раствору хлорида кальция приливаю раствор карбоната натрия | Происходит……… |
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Назовите характерные признаки строения атомов металлов и неметаллов.
2. Какие различия в свойствах металлов и неметаллов.
ПРАКТИЧЕСКАЯ РАБОТА №2
Тема: «Решение экспериментальных задач по теме «Металлы».
Цель работы: закрепление знаний о металлах и их кислородных соединениях, выработать умения правильно обращаться с приборами и реактивами при проведении практической работы, соблюдать правила техники безопасности, отработать и закрепить умения составлять уравнения реакций.
Оборудование и реактивы: цинк, железо, медь, сульфат цинка, хлорид меди (II), нитрат свинца, нитрат серебра и сульфат цинка, соляная кислота, гидроксид натрия, карбонат магния, пробирки, спиртовка, спички.
Ход работы:
| № задачи | Условие задачи | Что делаю | Что наблю даю | Уравнения реакций | Вывод |
| 1 | Определите, в какой пробирке находится раствор каждой из солей: хлорид железа(III), хлорид алюминия, хлорид кальция. |
|
|
|
|
| 2 | Определите, в какой из пробирок находится раствор каждой соли: сульфата железа(II), сульфата натрия, сульфата алюминия.
|
|
|
|
|
| 3 | Из оксида кальция получите хлорид кальция с помощью процессов, которые можно осуществить опытным путем: CaO → Ca(OH)2 → CaCl2
|
|
|
|
|
| 4 | С помощью одного реактива распознайте растворы хлорида железа(II), хлорида калия, хлорида алюминия. |
|
|
|
|
| 5. | Распознайте, в какой пробирке находятся растворы: хлорида железа(III), сульфата натрия, сульфата алюминия. |
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Получите тремя способами:
а) Хлорид железа(III)
б) Хлорид меди(II)
в) Нитрат алюминия.
2. Укажите, с какими веществами реагирует разбавленная серная кислота (напишите уравнения возможных реакций):
Cu, Al, NaCl, Cu(OH)2, ZnO, NaOH, Na2CO3.
ПРАКТИЧЕСКАЯ РАБОТА № 3
Тема: «Решение экспериментальных задач по теме «Металлы и их соединения»».
Цель работы: проверить ЗУН по пройденной теме «Металлы».
Оборудование и реактивы: пробирки, спиртовка, спички, штатив; гидроксид натрия, железо, хлор, сульфат алюминия, сульфит алюминия, аммиак, хлорид бария, азотная кислота.
Ход работы:
Задача №1. Свойства железа и его соединений.
Осуществите превращения по схеме:
Fe → Fe3O4 → Fe → FeCl3 → Fe(OH)3 → FeCl3
Оформите отчёт в виде таблицы:
| Название опыта | Что делали? | Что наблюдали? Выводы. | Уравнение химической реакции. |
| 1) Сгорание железа в кислороде |
|
| Запишите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель), процессы окисления (восстановления) Fe + O2 t˚C→
|
| 2) Получение железа алюминотермическим способом |
|
| Запишите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель), процессы окисления (восстановления) Fe3O4 + Al t˚C→
|
| 3) Взаимодействие хлора с железом |
|
| Запишите УХР, расставьте коэффициенты методом электронного баланса, укажите окислитель (восстановитель), процессы окисления (восстановления) Fe + Cl2 t˚C→ |
| 4) Получение гидроксида железа (III) и взаимодействие его с кислотами
|
|
| Запишите УХР в молекулярном полном и кратком ионном виде: FeCl3 + ? → Fe(OH)3 + ? Fe (OH) 3 +? → FeCl3 + ?
|
Задача №2. Определение качественного состава соли. Распознавание солей.
В двух неподписанных флаконах выданы растворы солей – сульфата алюминия и сульфита алюминия. Как при помощи характерных реакций распознать каждое из веществ?
Заполните таблицу:
| Определяемое вещество | Реактив, для качественного определения ионов | ||
| Раствор аммиака NH3·H2O (NH4OH) | Раствор хлорида барияBaCl2 | Раствор азотной кислотыHNO3 | |
| 1) Сульфат алюминия Al2(SO4)3 | Что наблюдали? | Что наблюдали? | Что наблюдали? |
| 2) Сульфит алюминия Al2(SO3)3 | Что наблюдали? | Что наблюдали? | Что наблюдали? |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Запишите УХР в молекулярном полном и кратком ионном виде:
Al2(SO4)3 + NH4OH →
Al2(SO3)3 + NH4OH →
Al2(SO4)3 + BaCl2 →
Al2(SO3)3 + BaCl2 →
Al2(SO3)3 + HNO3 →
ПРАКТИЧЕСКАЯ РАБОТА № 4
Тема: «Получение аммиака и изучение его свойств»
Цель работы: овладеть одним из способов получения аммиака реакцией ионного обмена, которая используется и как качественная реакция на соли аммония; совершенствовать умения собирать прибор для получения газа легче воздуха; изучить свойства водного раствора аммиака, закреплять умение наблюдать за явлениями, описывать их и делать умозаключения – выводы.
Оборудование и реактивы: прибор для получения аммиака, NH4CI, Ca (OH)2, H2O, cтеклянные палочки, чашки Петри, фенолфталеин, нагревательный прибор, штатив.
Ход работы:
| Что делали | Что наблюдали | Уравнения реакций в молекулярном, полном и сокращенном ионном виде | Выводы. |
| Получаем аммиак нагреванием смеси гидроксида кальция и хлорида аммония в пробирке
Собираем аммиак в пробирку дном ... | Разрыхление реакционной массы. | О выделении какого газа свидетельствуют наблюдения? Написать уравнение реакции: Ca(OH)2 + NH4Cl = ... + NH3↑ + ...
| Физические свойства аммиака: ......... Аммиак ... воздуха, поэтому сухая пробирка – приемник находится дном... .
Mr(NH3) = ...
|
| Сняв с газоотводной трубки прибора пробирку, помещаем её в химический стакан с водой. Убираем из стакана пробирку и в образовавшийся раствор добавляем фенолфталеин.
| Пробирка наполняется водой.
Раствор приобретает ... | Написать уравнение реакции, назвать образующееся вещество: NH3 + H2O ⇄
| Аммиак ... растворим в воде . Продукт взаимодействия аммиака с водой называется ... . Относится к классу ... . Механизм образования химической связи в катионе ... . Тип реакции ... . |
| В стакан с водным раствором аммиака в присутствии фенолфталеина вливают 1мл раствора серной кислоты |
| NH4OH + ... = ... + ... NH4OH + H+ + ... = NH4+ + ... + ... NH4OH + H+ = NH4+ + H2O | Почему исчезла первоначальная окраска раствора? Название продукта взаимодействия гидроксида аммония с соляной кислотой ... . К какому классу относится продукт реакции? ... Тип реакции ... |
|
|
| На основе электронного баланса написать уравнение реакции, определить окислитель и восстановитель:
а) Горение аммиак без катализатора
б) Горение аммиак в присутствии катализатора | Какие вещества образуются в процессе горения аммиака а) без катализатора; б) в присутствии катализатора? |
КОНТРОЛЬНЫЕ ВОПРОСЫ
1) Какая масса хлорида аммония получится при взаимодействии 3 моль аммиака с соляной кислотой?
2) Какой объем кислорода потребуется для сжигания 34 г аммиака?
ПРАКТИЧЕСКАЯ РАБОТА № 5
Тема: «Решение экспериментальных задач на качественные реакции на некоторые анионы»
Цель работы: сформировать представления о качественных реакциях на некоторые ионы, уметь распознавать их.
Оборудование и реактивы: пробирки, спиртовка, хлорид кальция, хлорид бария, хлорид калия, нитрат серебра, нитрат натрия, серная кислота, медные стружки, ортофосфорная кислота, г карбонат натрия, сульфат аммония, фенолфталеин.
Ход работы
| Что делали | Что наблюдали | Выводы. |
| 1Качественная реакция на хлорид-ион
| ||
| В три пробирки налили по 5-7 капель растворов следующих хлоридов: хлорида кальция, хлорида бария, хлорида калия. В каждую пробирку добавили по 2 капли раствора нитрата серебра. |
|
|
| 2Качественная реакция на сульфат-ион
| ||
| Налили в одну пробирку разбавленную серную кислоту, в другую сульфат натрия и добавили в каждую из них раствор хлорида бария |
|
|
| 3.Качественная реакция на нитрат-ион
| ||
| В пробирку поместили 0,5 г нитрата натрия, прилили раствор серной кислоты, затем добавили немного медных стружек и нагрели.
|
|
|
| 4.Качественная реакция на фосфат-ион
| ||
| В пробирку налили 1-2 мл раствора ортофосфорной кислоты и добавили такое же количество раствора нитрата серебра
|
|
|
| 5.Качественная реакция на карбонат-ион.
| ||
| В пробирку налили 1 мл раствора карбоната натрия и прилили раствор хлорида бария.
|
|
|
| 6.Качественная реакция на ион-аммония.
| ||
| В пробирку поместили 5-7 капель раствора сульфата аммония, добавили 1-2 капли конценрированного раствора щелочи, капнули фенолфталеин.
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
Задание 1. Могут ли одновременно находиться в растворе следующие пары
веществ:
1) KOH и NaOH 2) CuSO4 и BaCl2
3) HNO3 и Na2CO3 4) HNO3 и H2SO4
5) AlCl3 и NaOH 6) Cu (NO3)2 и NaOH
Задание 2. Могут ли одновременно находиться в растворе следующие ионы:
Ba2+, OH-, SO42-, Na+, Cu2+, K+, Al3+
Какие реакции будут происходить между некоторыми из них?
ПРАКТИЧЕСКАЯ РАБОТА № 6
Тема: «Качественное определение углерода, водорода и хлора в органических веществах»
Цель работы: научиться определять некоторые химические элементы, входящие в состав органических веществ.
Оборудование и реактивы: металлическая ложка для сжигания, стеклянная палочка, спиртовка, металлический штатив, газоотводная трубка, пробирки, медная проволока со спиралью; мука, толуол, сахарный песок, известковая вода, порошок оксида меди (II), безводный сульфат меди (II).
Ход работы:
Присутствие углерода в органических веществах может быть обнаружено:
1. По обугливанию органических веществ при их нагревании.
2. По появлению копоти при сгорании некоторых веществ.
3. При окислении вещества каким-либо окислителем, чаще – оксидом меди (II). При этом углерод окисляется до оксида углерода (IV), который образует осадок при его пропускании в раствор известковой воды.
Присутствие водорода обнаруживается по появлению капель воды на стенках пробирки при окислении органического вещества оксидом меди (II).
Присутствие элемента хлора в органическом веществе можно установить при нагревании его с оксидом меди (II) в качестве окислителя; при этом образуется хлорид меди, окрашивающий пламя в зеленый цвет.
ОПЫТ 1. Обнаружение углерода.
1.1. Металлическую ложку для сжигания наполните на половину ее объема мукой и нагрейте на пламени спиртовки до образования черного остатка. Наблюдайте, какие изменения претерпевает мука в процессе нагревания.
Задания: 1. Запишите наблюдения.
2. Сделайте вывод о том, какой химический элемент входит в состав органических веществ муки.
1.2. Опыт проводится в вытяжном шкафу!
Конец стеклянной палочки обмакните в толуол и внесите в пламя спиртовки. Обратите внимание на характер горения, внешний вид пламени и образование твердых продуктов сгорания на стеклянной палочке.
Задания: 1. Запишите наблюдения.
2. Сделайте вывод о том, какой элемент входит в состав толуола.
ОПЫТ 2. Обнаружение углерода и водорода.
С оберите прибор, как показано на рисунке 1. В сухую пробирку А поместите очень немного (на кончике шпателя) испытуемого твердого вещества и в 2-3 раза больше оксида меди (II). Тщательно перемешайте, встряхивая пробирку. Пробирку закрепите в штативе в горизонтальном положении и поместите недалеко от ее открытого конца немного безводного сульфата меди (II).
оберите прибор, как показано на рисунке 1. В сухую пробирку А поместите очень немного (на кончике шпателя) испытуемого твердого вещества и в 2-3 раза больше оксида меди (II). Тщательно перемешайте, встряхивая пробирку. Пробирку закрепите в штативе в горизонтальном положении и поместите недалеко от ее открытого конца немного безводного сульфата меди (II).
Пробирку плотно закройте пробкой с газоотводной трубкой, конец которой опустите в пробирку Б, заполненную на 1/3 объема известковой водой так, чтобы конец газоотводной трубки был погружен в известковую воду.
Смесь органического вещества с оксидом меди (II) нагрейте сначала осторожно, а затем сильнее. Что происходит с известковой водой? Что замечаете на стенках пробирки А? Какие изменения происходят с сульфатом меди (II)?
Осторожно уберите газоотводную трубку из известковой воды, прекратите нагревание и обратите внимание на цвет оксида меди (II).
Задания: 1. Зарисуйте прибор, который Вы использовали при проведении опыта и укажите содержимое пробирок А и Б.
2. Запишите кратко изменения, происходящие в пробирках А и Б. Какое вещество образовалось из оксида меди (II)? Как изменилась окраска сульфата меди (II)? Какой газ вызвал помутнение известковой воды? Приведите уравнения соответствующих реакций.
3. Какой вывод можно сделать о качественном составе органического вещества?
ОПЫТ 3. Обнаружение хлора.
Поместите спираль из медной проволоки в пламя спиртовки и прокалите ее до прекращения окрашивания пламени. Почерневшей спиралью (вследствие чего?) наберите каплю или несколько крупинок исследуемого вещества и снова внесите в пламя спиртовки.
В присутствии галогенов пламя принимает зеленую окраску.
Задания: 1. Кратко запишите ход эксперимента.
2. Определите, содержится ли хлор в другом выданном Вам образце.
Сделайте вывод о том, какие элементы в составе органических веществ Вы обнаружили при проведении данной лабораторной работы.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. По каким продуктам реакции можно судить о наличии в органическом веществе элементов углерода и водорода?
2. В состав молекулы предельного углеводорода входит 10 атомов углерода. Напишите уравнение реакции полного окисления этого вещества оксидом меди (II).
ПРАКТИЧЕСКАЯ РАБОТА № 7
Тема: «Предельные углеводороды. Получение метана и опыты с ним.»
Цель работы: 1. Научиться получать метан.
2. Проверить его физические и химические свойства.
Оборудование и реактивы: прибор для получения метана с газоотводной трубкой, фарфоровая ступка с пестиком, кристаллизатор, шпатель, спиртовка, пробирки, безводный ацетат натрия, натронная известь, раствор KMnO4, бромная вода.
Ход работы:
ОПЫТ 1. Получение метана.
С оберите прибор, как показано на рис. 4. В фарфоровую ступку насыпьте один шпатель безводного ацетата натрия и примерно в три раза большее количество натронной извести. Смесь перемешайте и измельчите до однородного состояния. Затем всыпьте ее в пробирку А, закройте пробирку пробкой с газоотводной трубкой и укрепите в зажиме штатива (см. рис. 4).
оберите прибор, как показано на рис. 4. В фарфоровую ступку насыпьте один шпатель безводного ацетата натрия и примерно в три раза большее количество натронной извести. Смесь перемешайте и измельчите до однородного состояния. Затем всыпьте ее в пробирку А, закройте пробирку пробкой с газоотводной трубкой и укрепите в зажиме штатива (см. рис. 4).
Кристаллизатор наполните на 1/3 водой, в него опустите наполненную до краев водой пробирку Б для сбора метана (в пробирке не должно быть пузырьков воздуха). Опустите конец газоотводной трубки в кристаллизатор с водой так, чтобы он почти касался дна.
Испытайте прибор на герметичность: зажмите в руке пробирку А и проследите, будет ли из газоотводной трубки выходить пузырек воздуха. В противном случае проверьте, плотно ли входит трубка в пробирку и плотно ли пробка закрывает отверстие пробирки. Затем приступайте к получению метана.
Для этого сначала хорошо прогрейте всю пробирку А, а затем продолжите нагревать ее, начиная от дна, постепенно перемещая по мере разложения смеси язычок пламени спиртовки к ее отверстию. В начале нагревания из пробирки А будет выделяться воздух, а затем начнется разложение смеси, сопровождающееся равномерным и достаточно быстрым выделением пузырьков метана из отверстия газоотводной трубки.
Для того, чтобы собрать метан в пробирку Б, подведите конец газоотводной трубки к ее отверстию и дождитесь полного вытеснения воды из пробирки Б. После этого уберите конец газоотводной трубки из кристаллизатора и погасите спиртовку. Пробирку Б оставьте перевернутой вверх дном в кристаллизаторе или сразу же приступите к выполнению опыта № 2.
Задания: 1. Зарисуйте прибор для получения метана, указав содержимое пробирок А и Б.
2. Запишите уравнение реакции получения метана, укажите условия ее протекания.
3. Запишите наблюдения происходивших изменений в пробирках А и Б.
4. Ответьте на вопросы:
4.1. На каких физических свойствах основано получение метана в лаборатории?
4.2. Какие правила техники безопасности следует соблюдать при выполнении опыта?
ОПЫТ 2. Горение метана.
Закройте пробирку с собранным метаном под водой пальцем, выньте из кристаллизатора. Перевернув ее отверстием кверху, уберите палец и одновременно поднесите к отверстию горящую спичку. Каким пламенем горит метан?
Задания: 1. Запишите уравнение реакции горения метана.
2. Укажите наблюдения.
3. Ответьте на вопрос: при каких объемных соотношениях смесь метана с кислородом и воздухом взрывоопасна?
ОПЫТ 3. Пропускание метана через раствор перманганата калия и бромную воду.
Налейте в одну пробирку на 1/3 ее объема раствор KMnO4, а в другую – столько же бромной воды. Снимите с прибора изогнутый конец газоотводной трубки и опустите ее в раствор одного из веществ. Вновь зажгите спиртовку, сильно нагрейте смесь в пробирке А. Пропустите выделяющиеся пузырьки метана через раствор KMnO4, а затем – через бромную воду. Происходят ли изменения в растворах?
Задание: Напишите уравнения реакций, имевших место в данном опыте, запишите наблюдения и объясните их.
1. Какие углеводороды называются предельными? Почему их так называют?
2. Что такое гомологический ряд и гомологическая разница?
ПРАКТИЧЕСКАЯ РАБОТА № 8
Цель работы: 1. Научиться получать этилен.
2. Проверить его физические и химические свойства.
Оборудование и реактивы: прибор для получения этилена с газоотводной трубкой, кристаллизатор, спиртовка, пробирки, смесь одного объема этилового спирта и трех объемов концентрированной серной кислоты, раздробленный кирпич, раствор KMnO4, бромная вода.
Ход работы:
ОПЫТ 1. Получение этилена.
С оберите прибор, как показано на рис. 5. Налейте в пробирку А 2 мл смеси этилового спирта с концентрированной серной кислотой. Поместите в смесь на кончике шпателя раздробленный кирпич для равномерного кипения жидкости. Закрепите пробирку А в штативе, как показано на рисунке.
оберите прибор, как показано на рис. 5. Налейте в пробирку А 2 мл смеси этилового спирта с концентрированной серной кислотой. Поместите в смесь на кончике шпателя раздробленный кирпич для равномерного кипения жидкости. Закрепите пробирку А в штативе, как показано на рисунке.
Кристаллизатор наполните на 1/3 водой, в него опустите наполненную до краев водой пробирку Б для сбора этилена (в пробирке не должно быть пузырьков воздуха). Опустите конец газоотводной трубки в кристаллизатор с водой так, чтобы он почти касался дна.
Испытайте прибор на герметичность: зажмите в руке пробирку А и проследите, будет ли из газоотводной трубки выходить пузырек воздуха. В противном случае проверьте, плотно ли входит трубка в пробирку и плотно ли пробка закрывает отверстие пробирки. Затем приступайте к получению этилена.
Сначала хорошо прогрейте всю пробирку А, а затем осторожно нагревайте смесь до ее потемнения.
Для того, чтобы собрать этилен в пробирку Б, подведите конец газоотводной трубки к ее отверстию и дождитесь полного вытеснения воды из пробирки Б. После этого уберите конец газоотводной трубки из кристаллизатора и погасите спиртовку. Пробирку Б оставьте перевернутой вверх дном в кристаллизаторе или сразу же приступите к выполнению опыта № 2.
Задания: 1. Зарисуйте прибор для получения этилена, указав содержимое пробирок А и Б.
2. Запишите уравнение реакции получения этилена, укажите условия ее протекания. Какую роль играет концентрированная серная кислота в этом эксперименте?
3. Запишите наблюдения происходивших изменений в пробирках А и Б.
4. На каких физических свойствах основано получение этилена в лаборатории?
ОПЫТ 2. Горение этилена.
Закройте пробирку с собранным этиленом под водой пальцем, выньте из кристаллизатора, слегка наклоните вниз дном, уберите палец и одновременно поднесите к отверстию горящую спичку. Каким пламенем горит этилен?
Задания: 1. Напишите уравнение реакции горения этилена и запишите наблюдения.
ОПЫТ 3. Взаимодействие этилена с раствором перманганата калия и бромной водой.
Вновь нагрейте смесь в пробирке А и пропустите выделяющийся этилен через растворы бромной воды и KMnO4.
Задания: 1. Напишите уравнения реакций взаимодействия этилена с бромной водой и раствором KMnO4.
2. Запишите наблюдения и дайте им объяснение.
Сделайте вывод о свойствах алкенов.
1. Напишите структурные формулы всех алкенов состава С8Н16, образующихся при каталитическом дегидрировании 2,2,4-триметилпентена, и назовите их по систематической номенклатуре.
2. Напишите структурную формулу алкена состава С6Н12, имеющего один четвертичный атом углерода, и назовите его по систематической номенклатуре.
ПРАКТИЧЕСКАЯ РАБОТА № 9
Тема: «Предельные одноатомные спирты. Простые эфиры».
Цель работы: 1. Изучить некоторые физические и химические свойства предельных одноатомных спиртов и объяснить, чем они обусловлены.
2. Получить простой эфир и исследовать его физические и химические свойства.
Оборудование и реактивы: спиртовка, пробирки, дистиллированная вода, этиловый спирт, изоамиловый спирт, лакмус, фенолфталеин, концентрированная серная кислота, натрий металлический.
Ход работы:
ОПЫТ 1. Растворимость спиртов в воде.
В две пробирки налейте по 2-3 мл воды и добавьте в первую 1 мл этилового, а во вторую – 1 мл изоамилового спирта. Полученные смеси в пробирках встряхните и дайте постоять. Полученные растворы спиртов используйте в опыте № 2.
Задания: 1. Занесите в тетрадь результаты эксперимента.
2. Сделайте вывод о растворимости спиртов.
ОПЫТ 2. Отношение спиртов к индикаторам.
Каждый из спиртовых растворов, приготовленных в опыте № 1, разделите на две части. Испытайте полученные растворы спиртов на лакмус и фенолфталеин.
Задания: 1. Результаты эксперимента запишите в тетрадь в виде таблицы.
2. Сделайте вывод о степени кислотности или щелочности спиртов.
ОПЫТ 3. Образование и гидролиз алкоголята.
В обезвоженный этиловый спирт бросьте свежеотрезанный, очищенный от корочек и высушенный фильтровальной бумагой кусочек натрия величиной с небольшую горошину. Для предотвращения выкипания спирта в случае бурного протекания реакции охлаждайте пробирку в стакане с холодной водой. Когда выделение газа станет спокойным, подожгите его. Что наблюдаете? Если выделение газа почти прекратилось, а натрий полностью не растворился, осторожно нагрейте загустевшую смесь и удалите оставшийся кусочек натрия при помощи изогнутой проволочки. Затем к содержимому пробирки добавьте 5-6 мл воды и каплю фенолфталеина. Как изменяется окраска индикатора? Почему этиловый спирт предварительно подвергали обезвоживанию?
Задания: 1. Составьте уравнения реакций образования и гидролиза алкоголята натрия.
2. Запишите наблюдения.
3. Ответьте на вопросы, поставленные в тексте эксперимента.
Сделайте вывод о том, какие свойства характерны для спиртов и как эти свойства связаны с их строением.
ОПЫТ 4. Получение диэтилового эфира.
К 0,5 мл этилового спирта осторожно добавьте столько же концентрированной серной кислоты. Приливание кислоты производите небольшими порциями при взбалтывании. Смесь осторожно нагрейте до начала кипения. Удалив нагретую пробирку от спиртовки, добавьте к смеси 3-5 капель спирта (осторожно!). При этом появляется запах эфира. Снова нагрейте реакционную смесь и зажгите выделяющиеся пары эфира. Сравните цвет пламени эфира и спирта.
Задания: 1. Напишите уравнения реакций получения эфира и его горения.
2. Запишите наблюдения.
1. Какие органические вещества относятся к классу спиртов? На какие группы они делятся? Какой общей формулой определяется состав молекул предельных одноатомных спиртов?
2. Почему спирты имеют более высокие температуры кипения, чем углеводороды с такой же молекулярной массой, как у спиртов?
ПРАКТИЧЕСКАЯ РАБОТА № 10
Тема: «Многоатомные спирты. Фенол».
Цель работы: 1. Проверить физические и химические свойства фенола и многоатомных спиртов на примере глицерина.
2. Выполнить качественные реакции на эти вещества.
3. Сравнить свойства одно-, многоатомных спиртов и фенола, объяснив черты сходства и различия в свойствах на основании строения молекул этих веществ.
Оборудование и реактивы: пробирки, дистиллированная вода, глицерин, раствор сульфата меди (II), раствор гидроксида натрия, фенол, бромная вода, раствор хлорида железа (III), раствор серной кислоты.
Ход работы:
ОПЫТ 1. Растворение глицерина в воде.
К 1 мл воды прибавьте 2-3 капли глицерина. Взболтайте. Обратите внимание на растворимость глицерина в воде. Раствор сохраните для следующего опыта.
Задание: Запишите наблюдения, объясните растворимость глицерина с точки зрения строения молекулы этого вещества.
ОПЫТ 2. Взаимодействие глицерина с гидроксидом меди (II).
К 1 мл раствора сульфата меди (II) прибавьте 1,5-2 мл гидроксида натрия до выпадения осадка. К осадку прилейте раствор глицерина, полученный в опыте № 1, и взболтайте. Обратите внимание на цвет образовавшегося глицерата меди (II).
Задания: 1. Напишите уравнения реакции образования осадка гидроксида меди (II).
2. Напишите уравнение реакции взаимодействия глицерина с гидроксидом меди (II).
3.Запишите наблюдения, соответствующие происходящим изменениям. Какие химические свойства проявляет глицерин?
ОПЫТ 3. Растворение фенола в воде.
Внимание: фенол очень ядовит. Обращаться с ним очень осторожно!
К 3-4 мл воды прибавьте столько кристаллического фенола, чтобы при взбалтывании образовалась мутная жидкость. Пробирку при этом закрывать пробкой. Раствор сохранить для опытов 4-6.
Задание: Запишите наблюдения и сделайте вывод о растворимости фенола в воде, связав это свойство со строением молекулы фенола.
ОПЫТ 4. Взаимодействие фенола со щелочью и выделение фенола из образовавшегося фенолята.
Отлейте в пробирку 1 мл раствора фенола, полученного в опыте 3. Прибавьте раствор щелочи до исчезновения мути и взболтайте.
Задание: Напишите уравнение реакции получения фенолята, укажите наблюдения.
К полученному в предыдущем опыте прозрачному раствору прибавьте раствор серной кислоты до помутнения раствора.
Задания: 1. Напишите уравнение реакции разложения фенолята кислотой, укажите наблюдения.
2. Объясните наблюдаемые в опыте 4 явления.
ОПЫТ 5. Бромирование фенола.
К 1 мл водного раствора фенола, полученного в опыте 3, добавьте по каплям бромную воду до образования осадка. Обратите внимание на цвет осадка и запах образовавшегося вещества.
Задание: Напишите уравнение реакции взаимодействия фенола с бромной водой. Запишите наблюдения. Объясните, почему фенол, в отличие от бензола, легко реагирует с галогенами.
ОПЫТ 6. Взаимодействие фенола с хлоридом железа (III).
В пробирку с 1 мл водного раствора фенола, полученного в опыте 3, прибавьте 2-3 капли раствора хлорида железа (III). В какой цвет окрашивается раствор?
Задание: Напишите уравнение реакции взаимодействия фенола с хлоридом железа (III). Запишите наблюдения.
Сделайте на основании проведенных опытов вывод о свойствах многоатомных спиртов и фенола, сравнив их со свойствами одноатомных спиртов.
1. Какие соединения называются многоатомными спиртами? Фенолами? Ароматическими спиртами?
2. Чем объяснить, что этиленгликоль и глицерин – жидкости, сравнительно высоко кипящие и хорошо растворимые в воде?
ПРАКТИЧЕСКАЯ РАБОТА № 11
Тема: «Синтез бромэтана из спирта».
Цель работы: Научиться получать бромэтан.
Оборудование и реактивы: металлический штатив с лапкой, спиртовка, газоотводная трубка с пробкой, пробирки, стаканчик, смесь этилового спирта с концентрированной серной кислотой (на один объем спирта один объем серной кислоты), бромид калия.
Ход работы:
С оберите прибор, как показано на рис. 6. В пробирку А налейте 2 мл смеси этилового спирта и серной кислоты, прибавьте 2 г бромида калия. Присоединив газоотводную трубку, укрепите пробирку наклонно в лапке штатива. Конец газоотводной трубки погрузите в другую пробирку Б – приемник, содержащую 1 мл воды и помещенную в стаканчик с холодной водой.
оберите прибор, как показано на рис. 6. В пробирку А налейте 2 мл смеси этилового спирта и серной кислоты, прибавьте 2 г бромида калия. Присоединив газоотводную трубку, укрепите пробирку наклонно в лапке штатива. Конец газоотводной трубки погрузите в другую пробирку Б – приемник, содержащую 1 мл воды и помещенную в стаканчик с холодной водой.
Реакционную смесь осторожно (кислота!) нагревают до кипения. Перегонку ведут до прекращения выделения тяжелых капель бромистого этила.
Задания: 1. Зарисуйте прибор для получения бромистого этила, указав содержимое пробирок А и Б.
2. Запишите уравнения реакций между этиловым спиртом, серной кислотой и бромидом калия, укажите условия их протекания.
3. Запишите наблюдения происходивших изменений в пробирках А и Б.
4. Какова роль серной кислоты в реакции?
1. Какие органические соединения называют галогенпроизводными углеводородов? Как классифицируют эти соединения?
2. Напишите структурные формулы всех изомерных галогеналкилов состава С4Н9Cl.
ПРАКТИЧЕСКАЯ РАБОТА № 12
Тема: «Альдегиды и кетоны».
Цель работы: 1. Получить уксусный альдегид.
2. Изучить химические свойства альдегидов и кетонов и объяснить, чем они обусловлены.
Оборудование и реактивы: пробирки, спиртовка, водяная баня, медная спираль, этиловый спирт, 5 % раствор К2Cr2О7, 20 % раствор серной кислоты, водный раствор формальдегида, свежеприготовленный аммиачный раствор оксида серебра (I), ацетон, раствор сульфата меди (II), раствор гидроксида натрия, свежеприготовленный концентрированный раствор гидросульфита натрия, фуксинсернистая кислота (для ее приготовления следует в 0,1-0,005 % водный раствор фуксина пропустить сернистый газ до обесцвечивания раствора. Сернистый газ получают нагреванием кусочков меди с концентрированной серной кислотой в круглодонной колбе. Полученный реактив хранят в хорошо закрытом сосуде в темноте. Чем меньший избыток сернистого газа соединится в реактиве, тем он чувствительнее).
Ход работы:
ОПЫТ 1. Окисление этилового спирта оксидом меди (II).
Налейте в пробирку 3-4 мл этилового спирта, накалите медную спираль в пламени спиртовки так, чтобы медь покрылась черным налетом оксида меди (II), раскаленную спираль быстро опустите в пробирку со спиртом. Повторите эту операцию несколько раз. Обратите внимание на запах образующегося альдегида и на изменения, происходящие со спиралью.
Задания: 1. Напишите уравнения реакций окисления меди и окисления этилового спирта.
2. Запишите наблюдения.
ОПЫТ 2. Окисление этилового спирта хромовой смесью.
К 2 мл 5 % раствора К2Cr2О7 прилейте 1 мл 20 % раствора серной кислоты и 0,5 мл этилового спирта. Осторожно нагрейте на спиртовке полученную смесь. Что наблюдается? Какой ощущается запах?
Задания: 1. Напишите уравнение происходящей реакции.
2. Запишите наблюдения.
ОПЫТ 3. Взаимодействие формальдегида с аммиачным раствором оксида серебра (I) (реакция «серебряного зеркала»).
1 мл формальдегида налейте в чистую пробирку (вымытую щелочью, затем хромовой смесью и дистиллированной водой) и добавьте 1 мл свежеприготовленного аммиачного раствора оксида серебра. Смесь осторожно нагрейте на водяной бане. Что наблюдается? То же проделайте с ацетоном.
Задания: 1. Напишите уравнение реакции взаимодействия альдегида с аммиачным раствором оксида серебра и наблюдения изменений, происходящих в обеих пробирках.
2. Почему ацетон не вступил в реакцию окисления?
ОПЫТ 4. Окисление альдегидов свежеосажденным гидроксидом меди (II).
К 0,5 мл раствора сульфата меди (II) прилейте 1 мл раствора гидроксида натрия до образования осадка. Взболтайте и к полученной жидкости с осадком гидроксида меди (II) прилейте 5-10 капель формальдегида. Смесь нагрейте на водяной бане, наблюдая за изменением окраски. Аналогичную реакцию проведите с ацетоном.
Задание: Напишите уравнения реакций, происходящих в обеих пробирках, и соответствующие наблюдения.
ОПЫТ 5. Взаимодействие формальдегида с фуксинсернистой кислотой.
В пробирку поместите 0,5 мл раствора фуксинсернистой кислоты, добавьте 2-3 капли раствора формальдегида. Что наблюдается?
Запомните: фуксинсернистая кислота является чувствительным реактивом на альдегиды.
Задание: Запишите соответствующие наблюдения, уравнение реакции записывать не нужно.
ОПЫТ 6. Реакция ацетона с гидросульфитом натрия.
К 1-1,5 мл ацетона прибавьте, не взбалтывая, 1 мл концентрированного свежеприготовленного раствора гидросульфита натрия NaHSO3 до образования осадка в виде кольца.
Задания: 1. Напишите уравнение реакции взаимодействия ацетона с гидросульфитом натрия и наблюдения.
2. Будут ли вступать в эту реакцию альдегиды?
Сделайте вывод о том, какие типы химических реакций характерны для альдегидов и кетонов, и объясните причины проявления ими данных свойств.
1. Какие соединения относятся к альдегидам и кетонам? Приведите общие формулы альдегидов и кетонов.
2. Сравните строение альдегидов и кетонов. На основании сравнения сделайте вывод о том, какие общие свойства они имеют и какими свойствами они отличаются.
ПРАКТИЧЕСКАЯ РАБОТА № 13
Тема: «Получение и свойства карбоновых кислот».Цель работы: 1. Получить уксусную кислоту и исследовать некоторые ее физические и химические свойства.
2. Исследовать химические свойства некоторых карбоновых кислот.
Оборудование и реактивы: металлический штатив, газоотводная трубка с пробкой, пробирки, спиртовка, химический стакан, ватный тампон; ацетат натрия, концентрированная серная кислота, раствор серной кислоты (1:5), лакмус, раствор гидроксида натрия, стружки магния, порошок оксида меди (II), раствор уксусной кислоты, раствор карбоната натрия, раствор муравьиной кислоты, олеиновая кислота (водно-спиртовой раствор), раствор перманганата калия, известковая вода, бромная вода.
Ход работы:
ОПЫТ 1. Получение уксусной кислоты.
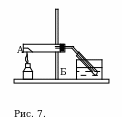 Соберите прибор, как показано на рис. 7. Поместите в пробирку А 0,5 г ацетата натрия и прибавьте немного концентрированной серной кислоты так, чтобы она только смочила соль. Пробирку закройте пробкой с газоотводной трубкой, свободный конец которой опустите в пустую пробирку Б, находящуюся в стакане с холодной водой. Пробирку Б закройте ватным тампоном. Нагревайте смесь веществ на пламени спиртовки до тех пор, пока в пробирке-приемнике соберется немного уксусной кислоты. Поднимите ватный тампон и обнаружьте запах кислоты. Полученную кислоту используйте для следующего опыта.
Соберите прибор, как показано на рис. 7. Поместите в пробирку А 0,5 г ацетата натрия и прибавьте немного концентрированной серной кислоты так, чтобы она только смочила соль. Пробирку закройте пробкой с газоотводной трубкой, свободный конец которой опустите в пустую пробирку Б, находящуюся в стакане с холодной водой. Пробирку Б закройте ватным тампоном. Нагревайте смесь веществ на пламени спиртовки до тех пор, пока в пробирке-приемнике соберется немного уксусной кислоты. Поднимите ватный тампон и обнаружьте запах кислоты. Полученную кислоту используйте для следующего опыта.
Задания: 1. Зарисуйте схему прибора, укажите содержимое пробирок А и Б.
2. Напишите уравнение реакции получения уксусной кислоты, укажите условия ее протекания. 3. Запишите наблюдения.
ОПЫТ 2. Исследование свойств уксусной кислоты.
а) Собранную в опыте 1 уксусную кислоту разбавьте дистиллированной водой до объема 1 мл и разделите на две части. Одну часть испытайте раствором лакмуса и нейтрализуйте раствором щелочи.
Задания: 1. Как и почему изменяется окраска лакмуса в растворе уксусной кислоты? Запишите уравнение реакции, объясняющее изменения.
2. Составьте уравнение реакции взаимодействия уксусной кислоты со щелочью. Запишите наблюдения. б) Во вторую часть раствора поместите стружку магния. Что наблюдается? Какой газ выделяется? Как его обнаружить? Задание: Составьте уравнение реакции, запишите наблюдения.
в) Насыпьте в чистую пробирку на кончике шпателя оксида меди (II), прилейте 1,5-2 мл раствора уксусной кислоты. Пробирку нагрейте на пламени спиртовки. Какой цвет приобретает раствор?
Задание: Составьте уравнение реакции, запишите наблюдения.
г) В пробирку с 1 мл раствора карбоната натрия прилейте 2 мл раствора уксусной кислоты. Что происходит? Почему идет реакция уксусной кислоты с солями угольной кислоты? Будет ли реагировать уксусная кислота с растворами солей серной и соляной кислот? Почему?
Задания: 1. Составьте уравнение реакции взаимодействия уксусной кислоты с карбонатом натрия. Запишите наблюдения.
2. Ответьте на вопросы в тексте опыта.
ОПЫТ 3. Отношение одноосновных предельных кислот к окислителям.
С оберите прибор, как показано на рис. 8. Поместите в пробирку А 4 капли раствора муравьиной кислоты, 4 капли перманганата калия и 2 капли раствора серной кислоты (1:5). К пробирке присоедините трубку с газоотводной трубкой, конец которой погрузите в пробирку Б с 0,5 мл известковой воды. Смесь нагрейте. Что наблюдаете? Как только помутнеет известковая вода, выньте газоотводную трубку и прекратите нагревание. Почему изменяется окраска раствора? Что происходит с муравьиной кислотой? Аналогичный опыт проделайте с раствором уксусной кислоты. Происходят ли изменения в этом случае? Дайте объяснения.
оберите прибор, как показано на рис. 8. Поместите в пробирку А 4 капли раствора муравьиной кислоты, 4 капли перманганата калия и 2 капли раствора серной кислоты (1:5). К пробирке присоедините трубку с газоотводной трубкой, конец которой погрузите в пробирку Б с 0,5 мл известковой воды. Смесь нагрейте. Что наблюдаете? Как только помутнеет известковая вода, выньте газоотводную трубку и прекратите нагревание. Почему изменяется окраска раствора? Что происходит с муравьиной кислотой? Аналогичный опыт проделайте с раствором уксусной кислоты. Происходят ли изменения в этом случае? Дайте объяснения.
Задания: 1. Зарисуйте схему прибора, указав содержимое пробирок А и Б.
2. Напишите уравнения реакций, происходящих в пробирках А и Б. Укажите условия протекания реакций. 3. Запишите наблюдения. 4. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 4. Исследование свойств олеиновой кислоты. В пробирку налить 0,5 мл бромной воды, добавить 3-4 капли раствора олеиновой кислоты и энергично взболтать. Что наблюдается?
Задание: Напишите уравнение реакции взаимодействия олеиновой кислоты с бромной водой. Отметьте наблюдения. Какой характер олеиновой кислоты доказывает данная реакция? Сделайте вывод о том, какие физические и химические свойства характерны для карбоновых кислот, как эти свойства связаны со строением этих веществ.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие органические вещества относятся к классу карбоновых кислот? 2. Изобразите электронную формулу уксусной кислоты и поясните, как происходит перекрывание и сдвиг электронных облаков при образовании химических связей в карбоксильной группе
ПРАКТИЧЕСКАЯ РАБОТА № 14
Тема: «Экспериментальные задачи по распознаванию органических веществ».
Цель работы: Определить, используя характерные реакции, какое вещество находится в каждой пробирке.
Оборудование и реактивы: пробирки, водяная баня, растворы уксусной кислоты, фенола, глицерина, формальдегида, лакмус, стружки магния, бромная вода, раствор хлорида железа (III), раствор сульфата меди (II), раствор гидроксида натрия, аммиачный раствор оксида серебра (I).
Ход работы:
В четырех пробирках даны растворы уксусной кислоты, фенола, глицерина и формальдегида.
Используя характерные реакции, определите, какое вещество находится в каждой пробирке. Составьте в тетради план решения задачи в виде таблицы, куда запишите свои наблюдения.
|
Реактив |
|
|
|
|
|
|
|
|
|
|
| Формула исследуемого вещества |
|
|
|
|
Под таблицей напишите уравнения реакций. Назовите все полученные органические вещества. Сделайте вывод о том, в какой пробирке находится каждое из предложенных веществ.
1. Приведите уравнения характерных реакций на фенол, глицерин и альдегид. Укажите условия протекания реакций.
2. В четырех пробирках находятся: глицерин, формальдегид, муравьиная и уксусная кислоты. Распознайте данные вещества, приведите уравнения соответствующих реакций.
ПРАКТИЧЕСКАЯ РАБОТА № 15
Тема: «Сложные эфиры. Жиры»
Цель работы: 1. Изучить некоторые физические и химические свойства жиров.
2. Получить сложные жиры карбоновых кислот и исследовать их физические свойства.
Оборудование и реактивы: спиртовка, водяная баня, колба с обратным холодильником, стеклянная палочка, химические стаканы; твердый жир, 15 % спиртовой раствор щелочи, этиловый спирт, концентрированная уксусная кислота, концентрированная серная кислота, раствор растительного масла (2 капли масла на 1 мл гексана или очищенного керосина), бромная вода, насыщенный раствор поваренной соли, 5 % раствор соды, раствор мыла, раствор белка, бензин, толуол, 5 % раствор КОН, 5 % раствор Na2CO3.
Ход работы:
ОПЫТ 1. Получение сложных жиров карбоновых кислот.
В пробирку налейте 1 мл этилового спирта, 1 мл концентрированной уксусной кислоты и 0,5-1 мл концентрированной серной кислоты. Смесь в пробирке осторожно перемешайте и нагрейте на водяной бане, не доводя до кипения. Окончание реакции определите по появлению запаха сложного эфира, отличного от запаха карбоновой кислоты и спирта, взятых для синтеза. Дайте жидкости остыть и вылейте ее в стаканчик с насыщенным раствором поваренной соли. Какой ощущается запах? Где собирается эфир? Какова его растворимость? Какую консистенцию он имеет? Для чего используется кислота в процессе синтеза сложного эфира?
Задания: 1. Составьте в структурном виде уравнение реакции получения сложного эфира, укажите условия ее протекания.
2. Опишите физические свойства полученного эфира, ответьте на вопросы, поставленные в тексте эксперимента.
ОПЫТ 2. Омыление жиров в водно-спиртовом растворе.
С оберите прибор, как показано на рис. 9. В круглодонную колбу вместимостью 20 мл поместите 3-4 г измельченного твердого жира и налейте 8 мл 15 % спиртового раствора NaOH.
оберите прибор, как показано на рис. 9. В круглодонную колбу вместимостью 20 мл поместите 3-4 г измельченного твердого жира и налейте 8 мл 15 % спиртового раствора NaOH.
Перемешайте смесь стеклянной палочкой, колбу со смесью закройте обратным холодильником, опустите в водяную баню, закрепив в лапке штатива, нагрейте в течение 15-20 минут. Омыление жира следует проводить до тех пор, пока содержимое колбы не станет однородным. Оно обычно заканчивается образованием плотной твердой пленки на дне колбы. Затем колбу извлеките из водяной бани, дайте ей остыть, и добавьте в нее воды, хорошо взболтайте. Сравните растворимость полученного вещества с растворимостью жира, из которого оно было получено.
Задания: 1. Составьте уравнение реакции щелочного омыления твердого тристеарина, укажите условия ее протекания и наблюдения.
2. Как доказать, что продуктом данной реакции является мыло?
ОПЫТ 3. Физические свойства жиров.
а) Растворимость жиров в различных растворителях.
В 4 пробирки поместите 1-2 капли растительного масла. Прилейте в первую пробирку 1 мл этилового спирта, во вторую – 1 мл бензина, в третью – 1 мл воды, в четвертую – 1 мл толуола.
Взболтайте содержимое пробирок и дайте постоять. В каждой ли пробирке растворился жир? Какие вещества являются хорошими растворителями жиров, а какие – плохими? Почему?
Задания: 1. Результаты эксперимента оформите в виде таблицы.
2. Сделайте вывод о растворимости жиров на основании опыта.
б) Эмульгирование жиров.
Если жиры хорошо взболтать с водой, то они образуют эмульсию, т.е. систему, в которой мелкие капельки жира взвешены в воде. Эмульсия масла в воде быстро разрушается, т.к. капельки жира, сталкиваясь друг с другом, образуют крупные капли, создающие слой жира на поверхности воды. Есть вещества, которые, адсорбируясь на поверхности капель, не дают соединиться каплям жира в более крупные, т.е. повышают устойчивость эмульсии – эмульгаторы.
В 5 пробирок налейте по 3-4 капли растительного масла. Добавьте в первую пробирку 5 мл воды, во вторую – 5 мл 5 % раствора КОН, в третью – 5 мл 5 % раствора соды, в четвертую – 5 мл раствора мыла, в пятую – 5 мл раствора белка. Сильно встряхните содержимое каждой пробирки и наблюдайте образование эмульсии.
Задания: 1. Результаты эксперимента оформите в виде таблицы.
2. Сделайте вывод об эмульгирующих свойствах различных веществ.
Сделайте вывод о физических и химических свойствах сложных эфиров и жиров.
1. Приведите три уравнения реакций, приводящих к образованию одного и того же эфира.
2. Чем отличаются по химическому строению жидкие жиры от твердых? Приведите примеры.
ПРАКТИЧЕСКАЯ РАБОТА № 16
Тема: «Мыла и моющие средства»
Цель работы: Сравнить свойства мыла и синтетических моющих средств.
Оборудование и реактивы: конические колбы с пробками, мерные цилиндры, навески мыла и синтетического моющего средства, пробирки, разбавленные растворы соляной или серной кислот, раствор гидроксида натрия или калия, раствор ацетата свинца, сульфат меди (II), фенолфталеин, жесткая вода.
Ход работы:
ОПЫТ 1. Выделение жирных кислот.
а) Рассчитайте необходимый объем дистиллированной воды для приготовления 1 % растворов из выданных навесок мыла и синтетического моющего средства (СМС). Приготовьте растворы.
б) Налейте в пробирку 1 мл приготовленного раствора мыла и прибавьте разбавленной соляной или серной кислоты до образования хлопьев. Что собой представляет этот осадок? Проверьте, растворяется ли осадок в растворе щелочи. Объясните это явление.
Задания: 1. Составьте уравнения соответствующих реакций, запишите наблюдения.
2. Ответьте на вопросы, поставленные в тексте эксперимента.
ОПЫТ 2. Получение нерастворимых солей жирных кислот.
В две пробирки налейте по 1 мл мыльного раствора, добавьте в них соответственно растворы ацетата свинца Pb(CH3COO)2 и сульфата меди (II) CuSO4.
Задание: Объясните изменения, происходящие в каждой пробирке, запишите уравнения соответствующих реакций и наблюдения.
ОПЫТ 3. Сравнение свойств мыла и синтетических моющих средств.
а) Влейте по 2-3 мл растворов мыла и СМС в пробирки, добавьте к ним 2‑3 капли раствора фенолфталеина. Каков цвет раствора? Почему?
Задания: 1. Напишите уравнение реакции гидролиза мыла, запишите наблюдения.
2. Ответьте на вопросы, поставленные в тексте эксперимента.
б) В 2 пробирки влейте по 4-5 мл жесткой воды, содержащей ионы Са2+ и Mg2+. В первую пробирку при встряхивании добавьте раствор мыла, во вторую – раствор синтетического моющего средства. В каком случае приходится прибавлять больше раствора до образования устойчивой пены? Какой препарат не утрачивает моющего действия в жесткой воде? Почему?
Задания: 1. Напишите уравнение реакции, происходящей в растворе мыла.
2. Запишите наблюдения явлений, происходящих в обеих пробирках, объясните их причину.
На основании проделанных опытов сделайте вывод о преимуществах и недостатках мыла и СМС.
1. Что такое мыла? Как они получаются? Что такое синтетические моющие средства? Какие ценные продукты они заменяют?
2. Укажите жидкое мыло:
1) С17H35COONa; 4) CH3COOK;
2) С17H35COOK; 5) С17H35COOH;
3) CH3COONa; 6) CH3COOH.
ПРАКТИЧЕСКАЯ РАБОТА № 17
Тема: «Синтез этилового эфира уксусной кислоты (этилацетата)»
Цель работы: Получить этиловый эфир уксусной кислоты, исследовать его физические свойства.
Оборудование и реактивы: металлический штатив, спиртовка, газоотводная трубка с пробкой, пробирки, химический стакан, ватный тампон, тертый кирпич; смесь этилового спирта, уксусной кислоты и серной кислоты (на один объем спирта один объем концентрированной серной кислоты и один объем концентрированной уксусной кислоты), насыщенный раствор хлорида натрия, кусочки льда.
Ход работы:
С оберите прибор, как показано на рис. 10. В пробирку А налейте 2 мл смеси этилового спирта, уксусной и серной кислот и для равномерного кипения жидкости добавьте немного тертого кирпича. Пробирку А с помощью пробки с газоотводной трубкой присоедините к пробирке Б. В пробирку Б налейте 2‑3 мл насыщенного раствора хлорида натрия. Пробирку Б поместите в химический стакан с холодной водой и кусочками льда. Отверстие пробирки закройте ватным тампоном.
оберите прибор, как показано на рис. 10. В пробирку А налейте 2 мл смеси этилового спирта, уксусной и серной кислот и для равномерного кипения жидкости добавьте немного тертого кирпича. Пробирку А с помощью пробки с газоотводной трубкой присоедините к пробирке Б. В пробирку Б налейте 2‑3 мл насыщенного раствора хлорида натрия. Пробирку Б поместите в химический стакан с холодной водой и кусочками льда. Отверстие пробирки закройте ватным тампоном.
Реакционную смесь нагревайте в пробирке на слабом пламени спиртовки. При этом можно заметить, что в пробирке Б образуется тонкий слой эфира на поверхности раствора. Закончив нагревание, выньте ватный тампон. Ощущается ли запах эфира?
Задания: 1. Зарисуйте прибор, указав содержимое пробирок А и Б.
2. Напишите уравнение протекающей реакции, отметьте наблюдения.
3. Какова роль серной кислоты в реакции этерификации?
1. Составьте уравнение реакции этерификации в общем виде.
2. Приведите три уравнения реакций, приводящих к образованию одного и того же сложного эфира.
ПРАКТИЧЕСКАЯ РАБОТА № 18
Тема: «Исследование свойств глюкозы, сахарозы и крахмала»
Цель работы: Исследовать химические свойства углеводов и объяснить причины, обуславливающие эти свойства.
Оборудование и реактивы: металлический штатив, спиртовка, пробирки, стеклянная палочка, химический стакан вместимостью 50 мл, электроплитка, водяная баня; 1 % раствор глюкозы, 1 % растворы сахарозы, лактозы, фруктозы; крахмал, спиртовой раствор иода, раствор сульфата меди (II), раствор гидроксида натрия (10-12 %), раствор серной кислоты (1:5), аммиачный раствор оксида серебра (I).
Ход работы:
ОПЫТ 1. Свойства глюкозы. Внесите в пробирку 3 капли раствора глюкозы, одну каплю раствора соли меди и прибавьте при взбалтывании несколько капель гидроксида натрия до образования светло-синего раствора (щелочь должна быть в избытке). Что доказывает появление такой окраски раствора? Вспомните реакцию образования глицерата меди.
Полученный раствор нагрейте. Что наблюдается? Наличие какой функциональной группы в молекуле глюкозы подтверждает этот опыт?
Задания: 1. Напишите уравнение реакции взаимодействия глюкозы с гидроксидом меди (II) при комнатной температуре. Укажите наблюдения. На наличие каких функциональных групп указывает эта реакция?
2. Напишите уравнение реакции взаимодействия глюкозы с гидроксидом меди (II) при нагревании. Что наблюдается? Наличие какой функциональной группы в молекуле глюкозы подтверждает этот опыт?
ОПЫТ 2. Взаимодействие сахаров с гидроксидом меди (II). Опыт проводят одновременно с растворами различных сахаров.
К 2 мл раствора сахара добавьте 1 мл разбавленного раствора щелочи и 3‑4 капли раствора сульфата меди (II). Встряхните пробирку и перемешайте содержимое пробирки стеклянной палочкой до растворения осадка. Жидкость при этом окрашивается в интенсивно-синий цвет.
Затем поместите все пробирки в нагретую водяную баню. Если сахар окисляется, то, вынув пробирку через 2-3 минуты, вы увидите изменения окраски и появление красного или коричневого осадка.
Задание: Заполните следующие таблицы: Результаты опыта, проведенного при нормальных условиях
| Углевод | Что наблюдается? | Как объясняется? |
Результаты опыта, проведенного при нагревании
| Углевод | Что наблюдается? | Как объясняется? |
ОПЫТ 3. Взаимодействие сахаров с аммиачным раствором оксида серебра (I).
Опыт проводят одновременно с растворами различных сахаров.
Налейте в тщательно вымытые и высушенные пробирки по 1 мл аммиачного раствора оксида серебра (I) и по 1 мл раствора сахара. Пробирки поместите на несколько минут в горячую водяную баню.
Задание: Заполните следующую таблицу: Результаты опыта, проведенного при нагревании
| Углевод | Что наблюдается? | Как объясняется? |
Запишите уравнение соответствующей реакции для глюкозы.
ОПЫТ 4. Гидролиз сахарозы.
В пробирку с 5 каплями раствора сахарозы добавьте 1 каплю разбавленного раствора серной кислоты (1:5) и смесь нагрейте на пламени спиртовки. После этого прибавьте 1 каплю раствора сульфата меди (II) и избыток раствора гидроксида натрия. Зачем нужно добавлять именно избыток щелочи? Что наблюдается? Что произошло с сахарозой?
Задания: 1. Ответьте на вопросы, поставленные в тексте опыта.
2. Составьте уравнение реакции гидролиза сахарозы.
3. Опишите все наблюдаемые явления.
4. Напишите все уравнения протекающих реакций.
ОПЫТ 5. Отношение крахмала к воде.
В пробирку с 1 мл воды поместите на кончике шпателя сухого крахмала. Содержимое пробирки взболтайте. Растворяется ли крахмал в воде при комнатной температуре?
Содержимое пробирки порциями залейте при перемешивании в стакан с 5 мл горячей воды. При этом образуется крахмальный клейстер.
Задание: Отметьте наблюдения, происходящие в данном опыте. Сделайте вывод о растворимости крахмала в холодной и горячей воде.
ОПЫТ 6. Взаимодействие крахмала с иодом. В пробирку внесите 5-6 капель крахмального клейстера и одну каплю спиртового раствора иода. Что при этом наблюдается?
Задание: Отметьте наблюдения, происходящие в данном опыте. Объясните происходящие явления.
ОПЫТ 7. Отношение крахмала к гидроксидам металлов.
В пробирку внесите 5 капель крахмального клейстера, одну каплю сульфата меди (II) и 5 капель раствора гидроксида натрия. Смесь нагрейте на пламени спиртовки, не доводя до кипения. Что при этом наблюдается? Задания: 1. Отметьте наблюдаемые явления, происходящие в этом опыте.2. Какой можно сделать при этом вывод?
3. Происходит ли окисление крахмала гидроксидом меди (II)?
ОПЫТ 8. Кислотный гидролиз крахмала.
Налейте в химический стакан 3-5 мл крахмального клейстера и 0,5-1 мл раствора серной кислоты. Стакан поставьте на электроплитку и кипятите 4-5 минут. Следите за тем, чтобы не произошло обугливание. Для определения, прошел ли гидролиз, отберите пипеткой 3-4 капли раствора (гидролизата) в пробирку и прибавьте каплю раствора иода. Если получился раствор желтоватого цвета, гидролиз крахмала закончен.
Теперь необходимо определить конечный продукт гидролиза – глюкозу.
В пробирку внесите 5 капель гидролизата, 2 капли раствора сульфата меди (II) и несколько капель раствора щелочи до появления синей окраски раствора. Смесь слегка нагрейте на пламени спиртовки. Что наблюдается?
Задания: 1. Отметьте наблюдаемые явления, происходящие в этом опыте.
2. Напишите схему гидролиза крахмала.
3. Объясните все происходящие явления.
4. Напишите уравнение реакции качественного определения глюкозы.
ОПЫТ 9. Ферментативный гидролиз крахмала.
Под действием фермента слюны амилазы (птиамина) происходит гидролиз крахмала.
Разжуйте хорошо маленький кусочек черного хлеба и поместите его в пробирку. Внесите в нее 1 каплю раствора сульфата меди (II) и несколько капель раствора гидроксида натрия до образования раствора слабо-голубого цвета. Пробирку с содержимым нагрейте на пламени спиртовки. Что наблюдается?
Задания: 1. Опишите наблюдения, происходящие в опыте.
2. Запишите уравнения протекающих реакций.
3. Сравните условия ферментативного и кислотного гидролиза крахмала.
ОПЫТ 10. Качественная реакция на крахмал (иодная проба).
К 1-1,5 мл раствора крахмала добавьте 1 каплю иодной воды. Что наблюдается? Полученную жидкость нагрейте на пламени спиртовки. Какие происходят изменения? Затем охладите содержимое пробирки под струей холодной воды. Что наблюдается?
Задание: Запишите все происходящие наблюдения. Оформите наблюдения в виде схемы.
1. Какие органические вещества относятся к классу углеводов? Откуда возникло это название?
2. На какие группы делятся углеводы?
ПРАКТИЧЕСКАЯ РАБОТА № 19
Тема: «Экспериментальные задачи на получение и распознавание органических веществ»Цель: повторить и закрепить знания об основных классах органических веществ.
Ход работы:
Данная работа охватывает кислородсодержащие соединения: спирты, альдегиды, кислоты, углеводы.
Для успешного выполнения работы необходимо повторить сведения об этих соединениях и провести предварительный анализ предлагаемых ниже задач. Из приведенного ниже списка каждый учащийся должен решить не менее трех экспериментальных задач, номера которых задаются учителем.
Задача 1. Исходя из ацетата натрия или калия, получите уксусную кислоту. Докажите опытным путем, что это кислота.
Задача 2. Исходя их этилового спирта, получите ацетальдегид. Докаж9те его принадлежность к классу альдегидов. Из полученного ацетальдегида получите соответствующую кислоту и докажите опытным путем ее принадлежность к классу кислот.
Задача 3. Выданы 4 пробирки (под номерами) с растворами этилового спирта, формальдегида, глицерина и глюкозы. Определите каждое вещество с помощью одних и тех же реактивов.
Задача 4. Исходя из мыла, получите жирные кислоты.
Задача 5. Докажите опытным путем, что в состав глюкозы и сахарозы входят углерод и водород.
Задача 6. Докажите опытным путем, что сырой картофель, белый хлеб и рис содержат крахмал.
Задача 7. Докажите опытным путем, что в спелых яблоках (или других фруктах) содержится глюкоза.
Задача 8. Докажите опытным путем, что в результате гидролиза крахмала образуется глюкоза.
Задача 9. В трех пробирках под номерами даны растворы крахмала, сахарозы и глицерина. Определите каждое вещество с помощью характерных реакций.
Задача 10. В четырех пробирках под номерами даны растворы сахарозы, глюкозы, уксусной кислоты и глицерина. Определите каждое вещество с помощью характерных реакций.
Задача 11. В четырех пробирках под номерами даны растворы глицерина, формальдегида, уксусной кислоты и глюкозы. Распознайте все вещества с помощью одного реактива. Напишите уравнения соответствующих реакций.
ПРАКТИЧЕСКАЯ РАБОТА № 20
Тема: «Белки»
Цель работы: 1. Изучить химические свойства белков.
2. Выполнить и запомнить качественные реакции на белки.
Оборудование и реактивы: спиртовка, держатель для пробирок, пробирки, раствор гидроксида натрия (10-12 %), раствор сульфата меди (II) (0,5 моль/л), водный раствор яичного белка (готовится из расчета 1 мл белка на 5 мл насыщенного раствора поваренной соли), насыщенный раствор ацетата свинца, насыщенный раствор сульфата меди (II), концентрированная азотная кислота, концентрированная соляная кислота, концентрированная серная кислота, насыщенный раствор сульфата аммония, этиловый спирт, концентрированный раствор гидроксида натрия, концентрированный раствор аммиака, раствор ацетата свинца (0,5 моль/л).
Ход работы:
ОПЫТ 1. Свертывание белков при нагревании.
2-3 мл раствора белка налейте в пробирку и нагрейте в пламени спиртовки до кипения. Что при этом наблюдается? Чем можно объяснить это явление? Содержимое пробирки разбавьте водой. Растворяется ли осадок, если нет, то почему?
Задания: 1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 2. Осаждение белков солями тяжелых металлов.
В две пробирки налейте по 1-2 мл раствора белка и медленно, по каплям, при встряхивании прилейте в одну из них насыщенный раствор сульфата меди (II), а в другую – насыщенный раствор ацетата свинца. Что наблюдается? Затем содержимое пробирок разбавьте большим количеством воды. Что наблюдается при этом?
Задания: 1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте. Сделайте вывод о действии солей тяжелых металлов на белок.
ОПЫТ 3. Осаждение белков минеральными кислотами.
Налейте в одну пробирку 1 мл концентрированной азотной кислоты, в другую – 1 мл концентрированной соляной кислоты, в третью – 1 мл концентрированной серной кислоты. Каждую пробирку наклоните и осторожно влейте в нее по стенке 1-1,5 мл раствора белка так, чтобы он не смешивался с более тяжелым слоем кислоты, затем пробирку поставьте в штатив. Что наблюдается на границе раздела двух жидкостей?
Затем пробирки встряхните. Какие изменения происходят при этом в пробирках?
Задания: 1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте. Сделайте вывод об отношении белка к концентрированным кислотам.
ОПЫТ 4. Высаливание белков сульфатом аммония.
В пробирку налейте 1-1,5 мл раствора белка, прилейте равный объем насыщенного раствора сульфата аммония. Смесь слегка встряхните. Что наблюдается? Что происходит с белком?
Смесь разбавьте большим количеством воды. Что происходит с осадком? Какой вид свертывания белка наблюдается?
Задания: 1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 5. Осаждение белков этиловым спиртом.
В пробирку налейте 1-1,5 мл раствора белка, прилейте 2-3 мл этанола. Что наблюдается? Проверьте, растворяется ли осадок в воде. Какой вид свертывания белка наблюдается?
Задания: 1. Запишите в виде схемы ход эксперимента и соответствующие наблюдения.
2. Ответьте на вопросы, поставленные в тексте.
ОПЫТ 6. Цветные реакции на белки.
а) Ксантопротеиновая реакция.
К 1 мл раствора белка добавьте 5-6 капель концентрированной азотной кислоты до появления белого осадка или мути от свертывания белка. Реакционную смесь нагрейте до окрашивания осадка в желтый цвет. В процессе гидролиза, происходящем при этом, осадок может частично растворяться. Смесь охладите и добавьте к ней осторожно, по каплям, избыток концентрированного раствора аммиака. Окраска при этом переходит в оранжевую. Данная реакция является качественной на белки.
Задания: 1. Запишите соответствующие наблюдения.
2. Ответьте на вопрос: какие группы атомов, остатки молекул каких органических веществ позволяют обнаружить эта реакция?
б) Биуретовая реакция.
В пробирку налейте 1-2 мл раствора белка, равный объем концентрированного раствора щелочи и 2-3 капли разбавленного раствора сульфата меди (II). Содержимое пробирки тщательно перемешайте. Жидкость при этом окрашивается в ярко-фиолетовый цвет. Эта реакция также является качественной на белки.
Задания: 1. Запишите соответствующие наблюдения.
2. Ответьте на вопрос: какие группы атомов, остатки молекул каких органических веществ позволяют обнаружить эта реакция?
в) Сульфгидрильная реакция.
В пробирку налейте 0,5 мл раствора ацетата свинца и 2 мл раствора гидроксида натрия до растворения образовавшегося осадка гидроксида свинца (II). В результате получается плюмбит натрия Na2PbO2. В другую пробирку налейте 2 мл белка и прилейте из первой пробирки столько же плюмбита натрия.
Смесь нагрейте до кипения. При нагревании белок гидролизуется, и образуется сероводород, который вступает во взаимодействие с раствором Na2PbO2 с образованием черного или черно-коричневого осадка сульфида свинца PbS.
Задания: 1. Запишите все соответствующие наблюдения.
2. Напишите уравнения реакций образования гидроксида свинца (II) и плюмбита натрия.
3. Что позволяет обнаружить данная реакция в белке?
1. Что называется белками? Охарактеризуйте строение белковых молекул.
2. Почему существует выражение, что «жизнь есть способ существования белковых тел»?
ПРАКТИЧЕСКАЯ РАБОТА № 21
Тема: «Обобщающие экспериментальные задачи по неорганической и органической химии»
Цель работы: Систематизировать знания по неорганической и органической химии, выполнить одну из задач на распознавание неорганических и органических веществ.
Оборудование и реактивы: пробирки, спиртовка, держатель для пробирок, набор необходимых реактивов для распознавания неорганических и органических веществ, исследуемые неорганические и органические вещества.
Ход работы:
В данной практической работе необходимо выполнить одну из экспериментальных задач.
Задача 1. В шести пронумерованных пробирках содержатся водные растворы веществ: FeSO4, Pb(NO3)2, Mn(NO3)2, H2O2, H2SO4, NaOH. Определите содержимое каждой пробирки с помощью только растворов указанных веществ, не пользуясь другими реактивами. Напишите уравнения реакций, которые могут быть использованы для идентификации этих веществ. Ответ оформите в виде таблиц (см. табл. 3 и табл. 4). В графах этих таблиц укажите характерные признаки продукта реакции, образующегося при взаимодействии каждого из шести предложенных веществ с каждым другим веществом.
Таблица 3 – Форма записи результатов по идентификации веществ в задаче 1
Мысленный эксперимент
| Вещество | FeSO4 | Pb(NO3)2 | Mn(NO3)2 | H2O2 | H2SO4 | NaOH |
| FeSO4 | х |
|
|
|
|
|
| Pb(NO3)2 |
| х |
|
|
|
|
| Mn(NO3)2 |
|
| х |
|
|
|
| H2O2 |
|
|
| х |
|
|
| H2SO4 |
|
|
|
| х |
|
| NaOH |
|
|
|
|
| х |
Таблица 4 – Форма записи результатов по идентификации веществ в задаче 1
Реальный эксперимент
| Номер пробирки | 1 | 2 | 3 | 4 | 5 | 6 | Вывод |
| 1 | х |
|
|
|
|
|
|
| 2 |
| х |
|
|
|
|
|
| 3 |
|
| х |
|
|
|
|
| 4 |
|
|
| х |
|
|
|
| 5 |
|
|
|
| х |
|
|
| 6 |
|
|
|
|
| х |
|
Задача 2. В восьми пронумерованных пробирках находятся водные растворы веществ AgNO3, AlCl3, Na2S, BaCl2, KNO3, K3PO4, H2SO4, HCl. Определите содержимое каждой пробирки с помощью только растворов указанных веществ, не пользуясь другими реактивами. Напишите уравнения реакций, которые могут быть использованы для идентификации этих веществ. Ответ оформите в виде таблиц (см. табл. 5 и табл. 6). В графах этих таблиц укажите характерные признаки продукта реакции, образующегося при взаимодействии каждого из восьми предложенных веществ с каждым другим веществом.
Таблица 5 – Форма записи результатов по идентификации веществ в задаче 2
Мысленный эксперимент
| Вещество | AgNO3 | AlCl3 | Na2S | BaCl2 | KNO3 | K3PO4 | H2SO4 | HCl |
| AgNO3 | х |
|
|
|
|
|
|
|
| AlCl3 |
| х |
|
|
|
|
|
|
| Na2S |
|
| х |
|
|
|
|
|
| BaCl2 |
|
|
| х |
|
|
|
|
| KNO3 |
|
|
|
| х |
|
|
|
| K3PO4 |
|
|
|
|
| х |
|
|
| H2SO4 |
|
|
|
|
|
| х |
|
| HCl |
|
|
|
|
|
|
| х |
Таблица 6 – Форма записи результатов по идентификации веществ в задаче 2
Реальный эксперимент
| Номер пробирки | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | Вывод |
| 1 | х |
|
|
|
|
|
|
|
|
| 2 |
| х |
|
|
|
|
|
|
|
| 3 |
|
| х |
|
|
|
|
|
|
| 4 |
|
|
| х |
|
|
|
|
|
| 5 |
|
|
|
| х |
|
|
|
|
| 6 |
|
|
|
|
| х |
|
|
|
| 7 |
|
|
|
|
|
| х |
|
|
| 8 |
|
|
|
|
|
|
| х |
|
Задача 3. В семи пронумерованных пробирках находятся растворы следующих веществ: AlCl3, Na2CO3, H2SO4, K2SO4, BaCl2, NaOH и лакмуса. Используя в качестве реактивов только эти растворы, определите, под каким номером находится каждое из названных веществ. Предложите план анализа и напишите уравнения проводимых реакций.
Задача 4. В пробирках № 1 и № 2 содержатся по одному из следующих веществ: глюкоза, сахароза, карбамид (мочевина), ацетат натрия, щавелевая кислота. Определите содержимое каждой пробирки с помощью следующих реактивов: H2SO4 (конц.), NaOH (2 М), CuSO4 (1 М), фенолфталеин, метиловый оранжевый. Напишите уравнения соответствующих реакций. Сделайте вывод.
Задача 5. В четырех пронумерованных пробирках находятся: соль карбоновой кислоты, фенол, углевод, амид карбоновой кислоты. Определите содержимое каждой пробирки, выбрав для анализа подходящие реактивы. Напишите уравнения соответствующих реакций. Сделайте вывод.
Задача 6. В пронумерованных пробирках, плотно закрытых пробками, содержится по одному ароматическому соединению. Одно из них – углеводород, другое – фенол, третье – альдегид. Определите, к какой группе соединений относится каждый пронумерованный образец, используя подходящие реактивы. Запишите уравнения соответствующих реакций. Сделайте вывод.
Критерии оценки:
Все практические работы оцениваются по 5-бальной шкале. Элементы, которые обязательны для всех практических работ (цель работы, оборудование и материалы, вывод) оцениваются по 1 баллу. Оставшиеся 4 балла даются за описание хода работы и результатов. Баллы распределяются по отдельным элементам в зависимости от цели работы, объема работы, заданий, предложенных автором, количества экспериментов и химических уравнений.
Учитель оставляет за собой право снять 1 балл в том случае, если были нарушены правила техники безопасности, эксперимент выполнялся небрежно, неточно.
| Компоненты оформленной в тетради практической работы | Баллы | Критерии |
| Цель работы и оборудование, реактивы | 1 | Сформулирована лаконично, с опорой на название практической работы. Указан полный перечень оборудования и реактивов, используемый при проведении ПР. Названия химической посуды и веществ записаны без ошибок. |
| Всего: 1 |
| |
| Наблюдения | 1 | Правильно описаны все признаки реакции, подмечены особенности ее протекания и т.д. |
| Уравнения реакций | 1 | Уравнения реакций записаны без ошибок, с расстановкой коэффициентов. Если того требует работа, приведены ионные уравнения реакций, метод электронного баланса и т.д. |
| Объяснения результатов, выполнение заданий | 1 | Дан полный комментарий к результатам эксперимента. Даны ответы на все вопросы, если таковые предложены в тексте практической работы. |
| Всего: 4 |
| |
| Вывод | 1 | Соотнесен с целью работы. Краткий (1-2 предложения) и не повторяет описание хода практической работы, наблюдения и т.д. |
| Итого | 5 | 5 баллов отметка «5» 4 балла отметка «4» 3 балла отметка «3» 2 балла отметка «2» |
Инструкции (правила) по технике безопасности
При работе в химической лаборатории существуют общие правила, которые необходимо строго соблюдать.
1. Перед каждой лабораторной работой следует изучить по учебнику относящийся к ней теоретический материал. Тогда лабораторные занятия будут полезными и продуктивными.
2. Начинать опыты, только внимательно прочитав полное описание работы и уяснив технику ее выполнения.
3. Все лабораторные работы выполнять индивидуально или парами по указанию преподавателя.
4. Приступать к выполнению задания только после разрешения преподавателя.
5. Внимательно прочесть надпись на этикетке, прежде чем взять вещество.
6. Не брать реактивы в большем количестве, чем требуется для опыта.
7. Опыт производить всегда в чистой посуде.
8. Нельзя выливать избыток реактива из пробирки обратно в реактивную склянку.
9. Не следует путать пробки от разных склянок, а также пипетки для взятия реактивов. Чтобы внутренняя сторона пробки оставалась чистой, пробку кладут на стол внешней поверхностью.
10. Не уносить реактивы общего пользования на свое рабочее место. Принять за правило: каждый предмет или реактив возвращать на место немедленно после использования.
11. Все работы с вредными веществами проводить только под тягой. Под тягой наливать концентрированные кислоты и щелочи и не переносить их на рабочее место.
12. Все опыты, сопровождающиеся выделением ядовитых летучих и дурно пахнущих веществ, проводить только в вытяжном шкафу.
13. Нагревая пробирки, не держать их отверстием к себе или в сторону находящихся рядом товарищей.
14. Нюхать выделяющиеся газы издали, помахивая рукой от сосуда к себе.
15. Реактивы не пробовать на вкус.
16. При работе с газоотводной трубкой убирать спиртовку из-под пробирки с реакционной смесью нужно лишь тогда, когда конец газоотводной трубки, опущенный в жидкость, удален из нее. В противном случае жидкость засосет в реакционную пробирку, и может произойти растрескивание пробирки.
17. Осторожно пользоваться спиртовками. Спиртовку нельзя зажигать, наклоняя ее к другой горящей спиртовке. Чтобы погасить спиртовку следует накрыть ее сверху колпачком.
18. Реактивы не брать руками. После окончания эксперимента руки тщательно вымыть.
19. Не загромождать свое рабочее место лишними предметами, содержать рабочее место в чистоте.
ПЕРВАЯ ПОМОЩЬ ПРИ НЕСЧАСТНЫХ СЛУЧАЯХ
В лаборатории бывают случаи, требующие неотложной медицинской помощи, – порезы рук стеклом, ожоги горячими предметами, кислотами, щелочами. В особо серьезных случаях необходимо немедленно обратиться к врачу.
Для оказания первой помощи в лаборатории имеется аптечка.
Основные правила первой помощи сводятся к следующему:
1. При ранении стеклом удалите осколки из раны, смажьте рану раствором иода и перевяжите бинтом.
2. При ожоге рук или лица реактивом смойте реактив большим количеством воды, затем либо раствором соды (в случае ожога кислотой), либо разбавленной уксусной кислотой (в случае ожога щелочью), а затем опять водой.
3. При ожоге горячей жидкостью или горячим предметом обожженное место обработайте свежеприготовленным раствором перманганата калия, смажьте обожженное место мазью от ожога или вазелином. Можно присыпать ожог питьевой содой и забинтовать.
4. При попадании кислоты или щелочи в глаза необходимо промыть их большим количеством воды, а затем промыть разбавленным раствором питьевой соды (при попадании кислоты) или 1 % раствором борной кислоты (при попадании щелочи).
После ознакомления с правилами техники безопасности при работе в химической лаборатории каждый учащийся должен расписаться в журнале по технике безопасности.
Список литературы
1. Комплект лабораторных работ по органической химии для учащихся 10 класса с углубленным изучением химии. Составитель: А.И.Малышев. ОТИ МИФИ, 1991.
2. Методические разработки к лабораторным работам по курсу органической химии. Составитель: Н.Ф.Минеева. ЮУПК, 1999.
3. Некрасов В.В. Руководство к малому практикуму по органической химии. М.: Химия, 1975.
4. Кузьменко Н., Еремин В., Попков В. Химия для школьников старших классов и поступающих в вузы. М.: Дрофа, 1997.
5. Сорокин В.В., Свитанько И.В., Сычев Ю.Н., Чуранов С.С. Химия. Сборник задач с решениями и ответами. 10-11 классы. М.: Астрель, 2001.
6. Артеменко А.И. Органическая химия. Теоретические основы. Углубленный курс. М.: Просвещение, 1997.
4





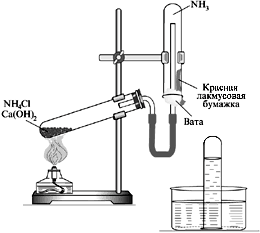
 Номер пробирки
Номер пробирки









