
семинар «Химические реакции»
Петракова Е.А.

1. Первый закон термодинамики.
- Энергия не возникает из ничего и не исчезает бесследно, а только переходит из одной формы в другую.

1) H2 (г.) + I2 (г.) → HI (г.) )+Q;
2) NO2 (г.) → N2O4 -Q (г.);
3) NO (г.) + Сl2 (г.) → NOCl (г.) +Q;
4) NO (г.) + О2 (г.) → NO2 (г.) +Q;
5) С (тв.) + Н2О (г.) → СO (г.) + H2 (г.) -Q;
6) NO2 (г.) → NO (г.) + O2 (г.) )+Q;
7) FeO (тв.) + СО (г.) → Fe (тв.) + CO2 (г.) +Q;
8) N2O4 (г.) → NO2 (г.) -Q.
9) C(т) + N2O(г) ↔ CO2(г) + N2(г)-Q
10) CH4(г) + S(т) ↔CS2(г) + Н2S(г)
11) CO(г) ↔ C(т) + O2(г)-Q
12) H2S(г) + I2(т) ↔ S8(т) + HI(г)-Q
13) CO2(г) + SO3(г) ↔ CS2(г) + O2(г) -Q
14) C(т) + Cl2(г) ↔ CCl4(г)+Q
15) N2H4(г) + O2(г) ↔ N2(г) + H2O(г)
16) I2(т) + CO2(г) ↔I2O5(т) + CO(г)-Q
17) CO(г) + O2(г) ↔ CO2(г)+Q
18) CuO(т) + CO2(г) + H2O(г) ↔ Cu2CO3(OH)2(т) +Q

Определить тепловой эффект реакции получения хлороводорода синтезом хлора и водорода, если энергия связи Н-Н = 436 кДж/моль, энергия связи Сl-Сl = 240 кДж/моль, энергия связи Н-Сl = 430 кДж/моль.
436 кДж/моль 240 кДж/моль 430кДж/моль
Н-Н Сl-Cl H-Cl
Н 2 + Сl 2 → 2HCl
1 моль 1моль 2 моль
Q = 2 моль· 430 кДж/моль – (436 кДж/моль+240 кДж/моль) = 184 кДж/моль, где Q – тепловой эффект
∆ H = - 184 кДж/моль – энтальпия реакции

Теплота образования соединения
– тепловой эффект реакции образования одного моля соединения из простых веществ, устойчивых в стандартных условиях (теплота образования простого вещества равна нулю).
2N 2 газ + O 2 газ = 2N 2 Oгаз –82,0 кДж
N 2 газ + 1/2O 2 газ = N 2 Oгаз –82,0 кДж, значит ∆H образования = +82 кДж/моль

Закон Гесса
Тепловой эффект химических реакций не зависит от промежуточных стадий (при условии, что исходные вещества и продукты реакции одинаковы).
Следствие из закона Гесса.
Тепловой эффект химической реакции равен сумме теплот образования продуктов за вычетом суммы теплот образования реагентов.


Закон Вант-гоффа
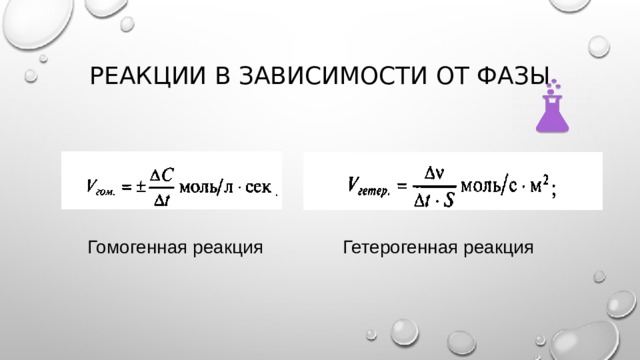
Реакции в зависимости от фазы
Гомогенная реакция
Гетерогенная реакция

![2NO + O 2 = 2NO 2 С (NO) = 0,5моль/л; С (O2) = 0,7 моль/л V = [NO] [NO] [O2] V= 0,5*0,5*0,7 = 0,175 моль/л*сек](https://fsd.multiurok.ru/html/2020/05/16/s_5ebfb2de51166/img10.jpg)
2NO + O 2 = 2NO 2
С (NO) = 0,5моль/л; С (O2) = 0,7 моль/л
V = [NO] [NO] [O2]
V= 0,5*0,5*0,7 = 0,175 моль/л*сек

Как изменится скорость реакции, имеющей кинетическое уравнение v= k C A 2 C B , если А) концентрацию вещества А увеличить в 3 раза; Б) концентрацию обоих веществ увеличить в 2 раза

Свяжитесь с нами
[email protected]

Принцип Ле-шателье

Вариант 1
1.На основании принципа Ле-Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении температуры:
C (т) + 2 N 2 O (г) ↔ CO 2(г) + 2 N 2(г) -Q Напишите выражение константы равновесия
2 На основании принципа Ле-Шателье определите, в каком направлении сместится равновесие в следующих системах при повышении давления ( Т = const):
CH 4(г) + 4 S (т) ↔CS 2(г) + 2 Н 2 S (г)
3 На основании принципа Ле-Шателье определите, увеличится ли выход продуктов при одновременном понижении температуры и давления в системах:
2 CO (г) ↔ 2 C (т) + O 2(г) -Q Напишите выражение константы скорости прямой реакции
4. На основании принципа Ле-Шателье определите, увеличится ли выход продуктов при повышении температуры и понижении давления одновременно:
8 H 2 S (г) + 8 I 2(т) ↔ S 8(т) + 16 HI (г) -Q
5. Предложите оптимальное изменение для увеличения выхода продуктов в системе.:
CO 2(г) + 2 SO 3(г) ↔ CS 2(г) + 4 O 2(г) -Q

Элементы
Атомы
Тестирование
Формулы
16















![2NO + O 2 = 2NO 2 С (NO) = 0,5моль/л; С (O2) = 0,7 моль/л V = [NO] [NO] [O2] V= 0,5*0,5*0,7 = 0,175 моль/л*сек](https://fsd.multiurok.ru/html/2020/05/16/s_5ebfb2de51166/img10.jpg)















