Нацелен на повторение типов механизмов реакций в Органической химии, полезен для подготовки к коллоквиуму, зачету, экзамену.
Просмотр содержимого документа
«Семинар-обобщение по теме "Реакции в органической химии (механизмы)"»

КУРС ОРГАНИЧЕСКОЙ ХИМИИ
Обобщение

Типы частиц
радикал
нуклеофил
электрофил
- R · (гомолитический разрыв)
- R ·
- (гомолитический разрыв)
- Nu - Гетеролитический разрыв)
- Nu -
- Гетеролитический разрыв)
- Е + Гетеролитический разрыв
- Е +
- Гетеролитический разрыв

Типы реакций
замещение
присоединение
отщепление
- S ( S ubstitution)
- S
- ( S ubstitution)
- А ( А ddition)
- А
- ( А ddition)
- Е ( E limination)
- Е
- ( E limination)

S R
- Радикальное замещение
- Алканы
- Интермедиат – частица, несущая неспаренный электрон (радикал алкил, гидроксил)
- Механизм
- 1 стадия: Инициирование под действием света
- 2 стадия: Рост цепи
- 3 стадия: Обрыв цепи
- Примеры: Галогенирование, реакция Коновалова, реакция Вюрца, реакции окисления

Пример

S E
- Электрофильное замещение
- Арены, соли диазония в реакции азосочетания, гетероциклы
- Интермедиат – электрофил, частица заряженная +, атакующая места с избытком электронной плотности (галоген, нитро, сульфо, алкил группа)
- Механизм
- 1 стадия: получение электрофила из реагента и катализатора
- 2 стадия: атака электрофилом кольца, образование пи-комплекса (медленно), образование сигма-комплекса с потерей ароматичности (быстро), восстановление кольца и отщепление протона
- 3 стадия: восстановление катализатора, получение побочного продукта

Пример
Н 3 О + + Н + +НSO 4 - → H 2 SO 4 + H 2 O

S N
- Нуклеофильное замещение
- Галогенпроизводные, спирты
- Интермедиат: нуклеофил, частица, заряженная отрицательно, атакующая места с дефицитом электронной плотности (нитро, циано, амино, гидроксо, алкоксигруппы)
Механизм
S N1
S N2
Мономолекулярное замещение
Бимолекулярное замещение
Третичные и вторичные производные
Первичные и вторичные производные
- Образование нуклеофила из катализатора и реагента
- Распад спирта или галогенпроизводного с образованием карбокатиона
- Соединение положительных и отрицательных частиц
- Образование нуклеофила из катализатора и реагента
- Атака с тыла, переходное состояние, уходящая группа
- Соединение катиона и уходящей группы

Пример
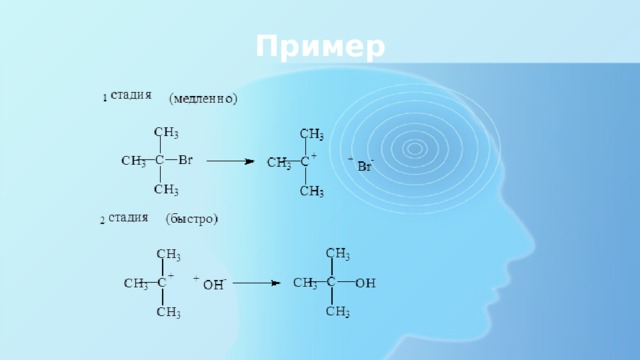
Пример

А Е
- Электрофильное присоединение
- Алкены, алкины, амины
- Интермедиат – электрофил (галоген, гидроксил, водород, алкил)
- Механизм
- 1. Получение электрофила из реагента и катализатора
- 2. Присоединение электрофила по обрыву кратной связи к атому с большим отрицательным зарядом.
- 3. Присоединение отрицательной частицы к карбокатиону

Пример

А N
- Нуклеофильное присоединение
- Альдегиды и кетоны
- Интермедиат: нуклеофил (-NH-NH2, -NH-CH3, - NH-OH, -NH-C6H5, -O-C2H5, -CH2 –CH=O)
- Механизм
- 1. Присоединение водорода нуклеофильного реагента к кислороду
- 2. Присоединение оставшейся частицы по месту разрыва связи с водородом к карбонильному атому С

Пример

Е
- Элиминироваие (отщепление)
- Спирты, галогенпроизводые, алканы, алкены
- Интермедиата нет
- Механизм по правилу Зайцева: водород отщепляется у атома углерода, у которого водородов меньше

Пример

Особые реакции
Окисление
Восстановление
Реакция Вагнера
Ацилирование
Реакция гидрирования алкинов, алкенов
«Серебряное зеркало»
Этерификации
Реакция Зинина
Окисление спиртов медной проволокой
Получение жиров
Получение спиртов из альдегидов и кетонов
Получение амидов, галогенангидридов, ангидридов, солей карбоновых кислот
Особые реакции
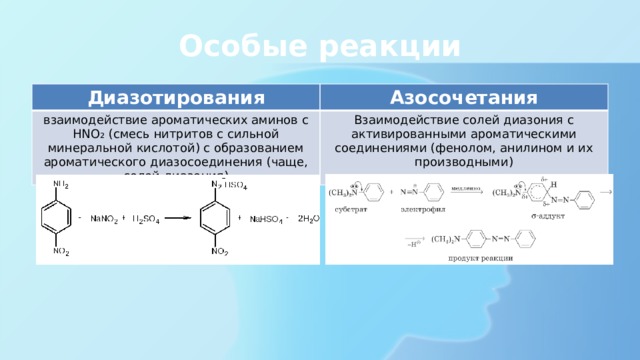
Диазотирования
Азосочетания
взаимодействие ароматических аминов с HNO₂ (смесь нитритов с сильной минеральной кислотой) с образованием ароматического диазосоединения (чаще, солей диазония)
Взаимодействие солей диазония с активированными ароматическими соединениями (фенолом, анилином и их производными)

Особые реакции
Изомеризации
Полимеризации
Поликонденсации
Без побочных продуктов
превращение химического соединения в изомер, перегруппировка атомов в молекуле вещества без изменения её качественного и количественного состава.
процесс образования высокомолекулярного вещества путём многократного присоединения молекул низкомолекулярного вещества к активным центрам в растущей молекуле полимера.
С побочными
это процесс образования высокомолекулярных веществ из низкомолекулярных, идущий с выделением побочных продуктов. В отличие от реакции полимеризации этот процесс не может быть отнесен к типу реакций соединения.


































