Просмотр содержимого документа
«Соли и их свойства для группы 1А»
Добрый день, уважаемые студенты!
Отправляю вам лекцию по ХИМИИ от 25.11.2020.
Лекцию законспектировать в тетрадь, и прислать фотоотчет в личные сообщения в социальную сеть ВКонтакте https://vk.com/mt_albertovna
Лекцию ВЫУЧИТЬ ВСЕМ !
Опрос на следующей паре в программе ZOOM.
25.11.2020.
Тема: Соли и их свойства
Соли образуются в результате нейтрализации кислоты основанием:
NaOH + HCl = NaCl + H2O
Поэтому соли состоят из атомов металлов, которые связаны с кислотными остатками. Таким образом, можно сформулировать определение:
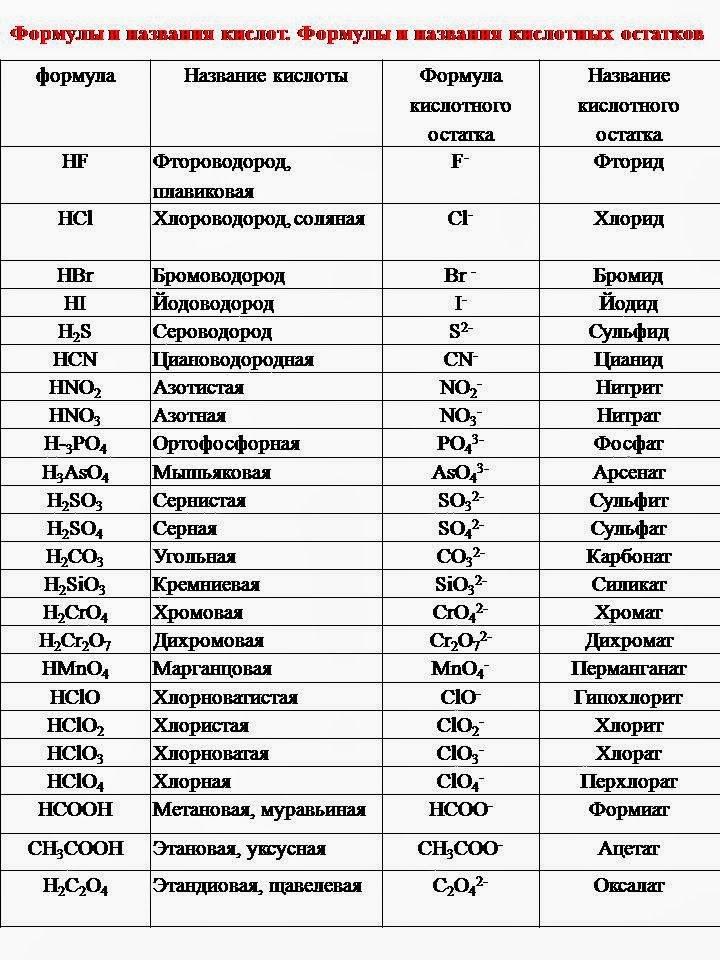
Соли – это сложные вещества, образованные атомами металлов и кислотными остатками.
Многие соли имеют свои исторически сложившиеся названия. Но на химическом языке названия солей образуются так: сначала называем кислотный остаток (например, хлорид), добавляем название металла в родительном падеже (например, натрия) – NaCl, CaSO4 – сульфат кальция; CuSO4 – сульфат меди (II).

Получение средних солей
Взаимодействие кислот.
- с металлами: 2H3PO4 + 6Na = 2Na3PO4 + 3H2↑
- с основными оксидами: 3H2SO4 + Fe2O3 =(t) Fe2(SO4)3 + 3H2O
- с основаниями: 3HNO3 + Cr(OH)3 = Cr(NO3)3 + 3H2O
Взаимодействие кислотных оксидов.
- с щелочами: N2O5 + Ca(OH)2 = Ca(NO3)2 + H2O
- с основными оксидами: SiO2 + CaO =(t) CaSiO3
3. Взаимодействие солей.
- с кислотами: Ca3(PO4)2 + 3H2SO4 =(t) 3CaSO4 + 2H3PO4
- с щелочами: Fe(SO4)3 + 6NaOH = 2Fe(OH)3↓ + 3Na2SO4
- с металлами: CuSO4 + Fe =(t) FeSO4 + Cu↓
- с нелетучими кислотными оксидами: CaCO3 + SiO2 =(t) CaSiO3 + CO2↑
- с другими солями: Al2(SO4)3 + 3BaCl2 = 3BaSO4↓ + 2AlCl3
4. Взаимодействие металлов с неметаллами:
2Fe + 3Cl2 → 2FeCl3 (горение)
ХИМИЧЕСКИЕ СВОЙСТВА
средних солей
1. Термическое разложение.
Карбонаты разлагаются с образованием основного оксида и углекислого газа:
CaCO3=CaO+CO2
Нитраты металлов разлагаются с образованием восстановления азотной кислоты до различных продуктов, в зависимости от положения металла в ряду напряжений:

Запомнить! Исключение: NH4NO3→t∘C,N2O↑+2H2O
Соли аммония разлагаются, как правило, с выделением аммиака: NH4Cl→t∘C,NH3↑+HCl




















