МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение
высшего образования
«Хакасский государственный университет им. Н.Ф. Катанова»
Институт естественных наук и математики
Кафедра математики, физики и информационных технологий
Современные теории строения жидкости
Выполнил: студент 4 курса,
ОФО, МФ-41
Кудин Эдуард Владимирович
Абакан-2024
Оглавление
Введение…………………….……………..…………………...……………….....3
1. История возникновения теорий строения жидкостей и старые теории строения жидкостей……………………………………………………………….6
2. Микрокристаллическая модель………………………………………………13
3. Квазикристаллическая модель………………………………………………..14
4. Колебательно - усредненная структура жидкости…………………………..17
5. Кластерная структура жидкости……………………………………………...20
Заключение……………………………………………………………………….24
Список использованной литературы………………………….………...............25
Введение
Жи́дкость — вещество, находящееся в жидком агрегатном состоянии, занимающем промежуточное положение между твёрдым и газообразным состояниями.
При этом агрегатное состояние жидкости, как и агрегатное состояние твёрдого тела является конденсированным, то есть таким, в котором частицы (атомы, молекулы, ионы) связаны между собой.
Область существования жидкости ограничена со стороны низких температур переходят в твердое состояние высоких – переходом в газообразное. Для каждого вещества существует температура, называемая критической, выше которой жидкость не может находится в равновесии с собственным паром.
Все жидкости принято делить на чистые жидкости и смеси. Некоторые смеси жидкостей имеют большое значение для жизни: кровь, морская вода и другие. Жидкости могут выполнять функцию растворителей.
Многочисленные исследования показывают, что наряду с колебанием молекул в окружении своих соседей и активационными скачками в жидкостях происходят плавные перемещения молекул вместе с их ближайшим окружением. Другими словами, молекулы жидкости, находящиеся в состоянии колебаний, непрерывно смещаются на короткое расстояние (меньше межатомного) и обеспечивают тем самым непрерывную диффузию. Можно предположить, что в сжиженных инертных газах и металлах доминирует непрерывная диффузия, тогда как для ассоциированных жидкостей (например, для воды) более вероятен прыжковый механизм диффузии.
В жидком состоянии вещества в отличие от газообразного проявляются те же межмолекулярные силы притяжения, которые обусловливают тот или иной тип связи в кристалле. Так, например, между атомами сжиженных инертных газов действуют дисперсионные Ван-дер-ваальсовы силы. Те же силы обусловливают взаимное притяжение молекул диэлектрических жидкостей (бензол, парафины и др.). Между молекулами воды, спиртов, кислот жирного ряда действуют специфические силы притяжения, возникновение которых связано с наличием в составе этих молекул группы ОН (водородная связь). В расплавах солей действуют электростатические силы, в металлах — силы металлической связи. В жидком германии, кремнии и других полупроводниковых веществах наряду с металлической связью частично сохраняется ковалентная связь. Жидкости, принадлежащие к данному типу межмолекулярных связей, характеризуются специфическим ближним порядком в расположении частиц, что отражается на поведении физических свойств вещества в жидком состоянии. В естественных условиях жидкости изотропны, имеют только одну модификацию. Исключением является гелий, который может находиться в двух фазах, и так называемые жидкие кристаллы, у которых существует как изотропная, так и анизотропная фазы.
Из описанного можно сделать вывод, что структура жидкостей ближе к кристаллической, чем к газообразной форме вещества, основываясь на взаимном расположении частиц, их движении и взаимодействии. Полная энергия молекул жидкости представляет собой сумму их кинетической и потенциальной энергий. Соотношение между их численными значениями зависит от температуры и давления. Являясь фазой, промежуточной между твердой и газообразной, жидкость, естественно, обнаруживает непрерывную гамму переходных свойств, примыкая в области высоких температур и больших удельных объемов к газам, а в области низких температур и малых удельных объемов - к твердым телам.
Структура жидкостей – это способ распределения ее частиц в пространстве. Если взаимное расположение молекул, атомов или ионов, входящих в состав жидкости, изучено, то ее структура считается известной, однако трактуется структура на данный момент несколькими существующими молекулярными моделями, актуальность данной работы в анализе данных моделей и сравнении их с устаревшей, а так же нахождении общих черт современных моделей.
Цель исследования – Изучить и проанализировать современные теории строения жидкости, сравнить их с устаревшими теориями
Объект исследования – Современные теории строения жидкости
Предмет исследования – Анализ современных молекулярных теорий строения жидкости.
Задачи исследования:
1. Рассмотреть устаревшую теорию строения жидкостей
2. Рассмотреть современные теории строения жидкостей
3. Сравнить теории строения жидкостей с устаревшей и между современными
4. Выделить общие положения современных теорий строения жидкостей
1. История возникновения теорий строения жидкостей и старые теории строения жидкостей
Жидкость — вещество в состоянии, промежуточном между твердым и газообразным. Это агрегатное состояние вещества, в котором молекулы или атомы связаны между собой настолько, что это позволяет ему сохранять свой объем, но недостаточно сильно, чтобы сохранять и форму.
Свойства жидкостей:
- Жидкости легко меняют свою форму, но сохраняют объем. В обычных условиях они принимают форму сосуда, в котором находятся.
- Поверхность жидкости, не соприкасающаяся со стенками сосуда, называется свободной поверхностью. Она образуется в результате действия силы тяжести на молекулы жидкости.
Строение жидкостей:
Свойства жидкостей объясняются тем, что промежутки между их молекулами малы: молекулы в жидкостях упакованы так плотно, что расстояние между каждыми двумя молекулами меньше размеров молекул. Объяснение поведения жидкостей на основе характера молекулярного движения жидкости было дано советским ученым Я. И. Френкелем.
Оно заключается в следующем. Молекула жидкости колеблется около положения временного равновесия, сталкиваясь с другими молекулами из ближайшего окружения. Время от времени ей удается совершить «прыжок», чтобы покинуть своих соседей из ближайшего окружения и продолжать совершать колебания уже среди других соседей.
Время оседлой жизни молекулы воды, т. е. время колебания около одного положения равновесия при комнатной температуре, равно в среднем 10-11 с. Время одного колебания значительно меньше — 10-12 – 10-13 с.
Поскольку расстояния между молекулами жидкости малы, то попытка уменьшить объем жидкости приводит к деформации молекул, они начинают отталкиваться друг от друга, чем и объясняется малая сжимаемость жидкости.
Текучесть жидкости объясняется тем, что «прыжки» молекул из одного оседлого положения в другое происходят по всем направлениям с одинаковой частотой. Внешняя сила не меняет заметным образом число «прыжков» в секунду, она лишь задает их преимущественное направление, чем и объясняется текучесть жидкости и то, что она принимает форму сосуда[1].
В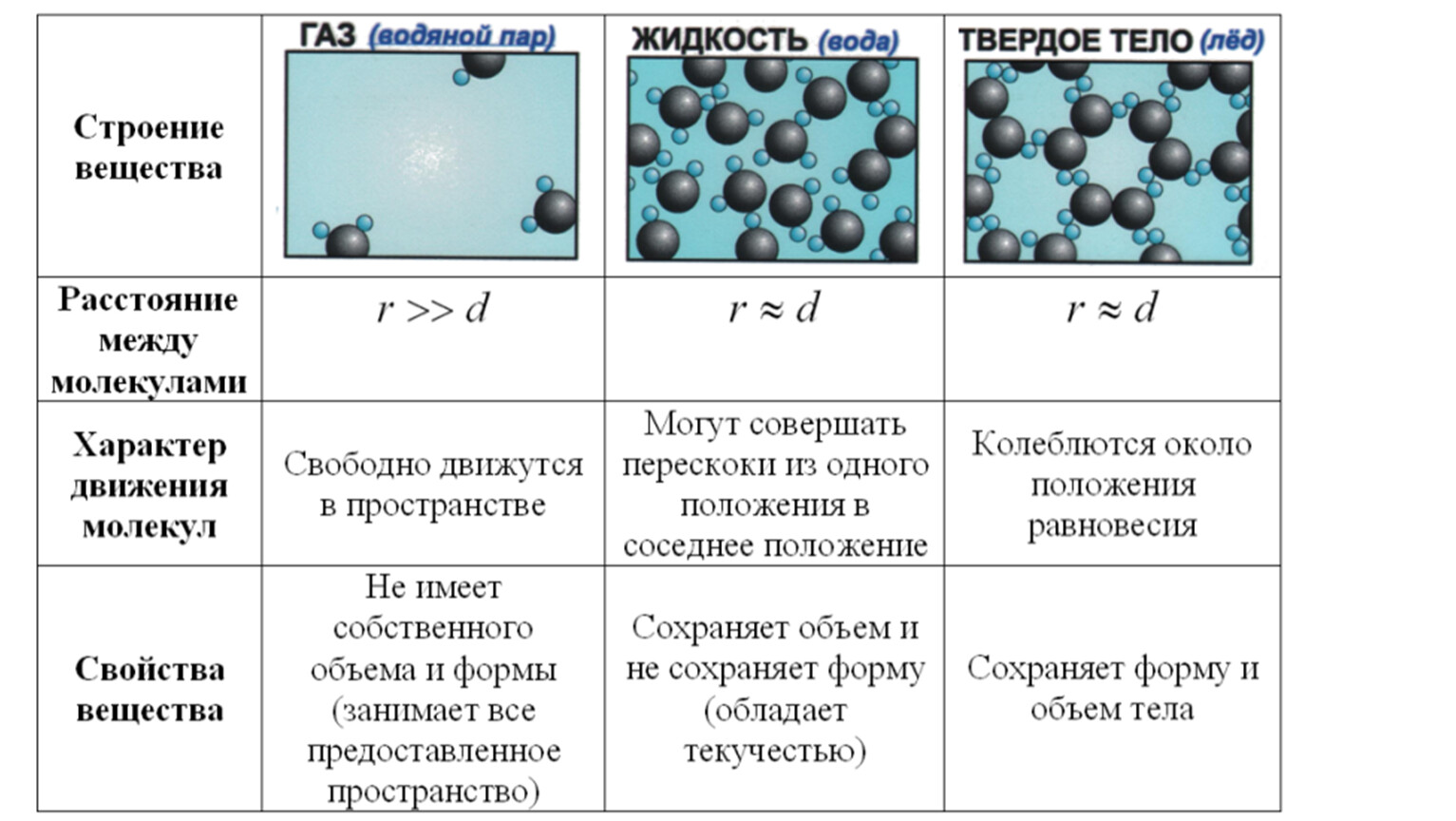 ещество находится в жидком состоянии, если средняя кинетическая энергия теплового движения его молекул примерно равна средней потенциальной энергии их взаимодействия.
ещество находится в жидком состоянии, если средняя кинетическая энергия теплового движения его молекул примерно равна средней потенциальной энергии их взаимодействия.
До настоящего времени законченной количественной теории жидкого состояния нет, на качественном же уровне МКТ может объяснять явления, происходящие с жидкостями[3,4,5]:
1. Из-за того, что расстояние между молекулами жидкости малы, увеличиваются силы притяжения молекул друг к другу, поэтому жидкости в отличие от газов обладают собственным объёмом, практически несжимаемы, плотность жидкостей при обычных условиях в сотни и тысячи раз больше плотности газов.
2. Вблизи каждой молекулы другие молекулы располагаются в определённом порядке, в целом в жидкости именно такой порядок не сохраняется, поэтому говорят, что в расположении молекул жидкости имеется ближний порядок и отсутствует дальний порядок.
3. Молекулы жидкости совершают хаотическое движение вблизи некоторого положения равновесия (колебания), изредка переходя в новое состояние равновесия (совершают перескоки), которые происходят случайным образом. Если на жидкость действует сила, например, сила тяжести, то перескоки происходят в направлении силы. Этим объясняется текучесть жидкости.
4. На границе с газом жидкость образует свободную поверхность.
Поверхностный слой жидкости – резкая граница, отделяющая жидкость от газа над ней, существует из-за большого различия плотностей жидкости и газа (например,  .
.
Поверхностный слой представляет собой подобие упругой плёнки из самой жидкости (можно положить осторожно, не нарушая слоя, иголку или лезвие бритвы на поверхность воды). Благодаря существованию поверхностного слоя возможно образование капли, мыльного пузыря, движение насекомых (водомерки) по поверхности воды.
Основное свойство поверхностного слоя: он стремится сократиться и принять наименьшую площадь поверхности при данном объёме. Из всех тел при данном объёме наименьшая площадь поверхности у шара, вот почему капля жидкости, мыльный пузырь в невесомости имеют форму шара.
МКТ объясняет существование поверхностного слоя так: молекулы на поверхности жидкости находятся в особых условиях по сравнению с молекулами её внутренних слоёв. Внутри жидкости результирующая сила притяжения, действующая на молекулу со стороны соседних молекул, равна нулю. У «поверхностных» молекул соседних молекул «сверху» меньше, чем «снизу». Молекулы поверхностного слоя под действием результирующей силы, втягиваются внутрь жидкости. В результате они оказывают молекулярное давление на жидкость, стягивая её поверхность до минимума. Этот эффект называется поверхностным натяжением.[2]
Поверхностное натяжение обуславливает наличие у молекул поверхностного слоя дополнительной потенциальной энергии – поверхностной энергии.
Дополнительная потенциальная энергия равна той работе, которую нужно было бы совершить, чтобы молекулам из глубины подняться к поверхности, преодолевая силу молекулярного давления на поверхности жидкости.
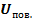 - поверхностная энергия,
- поверхностная энергия, 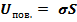 , где
, где 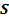 - площадь поверхностного слоя,
- площадь поверхностного слоя, 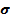 - коэффициент поверхностного натяжения.
- коэффициент поверхностного натяжения.
Все тела стремятся к положению устойчивого равновесия, которое определяется минимумом потенциальной энергии. Условием устойчивого равновесия жидкости является минимум потенциальной поверхностной энергии. Уменьшение поверхностной энергии достигается сокращением площади поверхностности жидкости, этим объясняется основное свойство поверхностного слоя.
В поверхностном слое действует сила поверхностного натяжения – сила, которая действует вдоль поверхности жидкости, перпендикулярно линии, ограничивающей поверхность и стремящаяся сократить её до минимума.
Согласно Д. Берналу, предложившему гипотезу бездефектной жидкости, жидкость имеет структуру, мало отличающуюся от геометрии кристалла, из которого она получена.
2)Модель, предложенная Я. И. Френкелем, называется квазикристаллической. Согласно этой модели жидкость, особенно вблизи температуры кристаллизации, рассматривается как искаженный кристалл, в котором утрачен дальний порядок, но сохранен ближний.
3) Согласно гипотезе «роев или сиботаксисов», предложенной Г. Стюартом, в жидкости существуют агрегаты, называемые сиботаксическими группами- псевдокристаллические образования, строение которых приближается к строению соответствующих кристаллов, выделяющихся из жидкости при кристаллизации. Структуру сиботаксических групп можно рассматривать как сильнодеформированную, искаженную структуру кристаллов. Явл-ся подвижными, динамическими агрегатами, которые разрушаются при движении и создаются вновь. Эти группы разделены областями беспорядочного расположения частиц, но резких переходов между областями с частично упорядоченным и неупорядоченным расположением частиц не существует. Такие переходы осуществляются постепенно.
Строение силикатных расплавов Большинство исследователей (О. А. Есин, О. Вейль и др.) считают, что расплавы силикатов представляют собой диссоциированную жидкость, в которой нет молекул свободных оксидов и недиссоциированных соединений, в них содержатся крупные полимерные анионы, состоящие из связанных друг с другом кремнекислородных тетраэдров, и катионы металлов. Т.о., силикатный расплав —совокупность сложных кремнекислородных анионов и катионов металлов.
Наиболее трудным в изучении состава силикатных расплавов является определение состава кремнекислородных комплексов. Размеры этих комплексов при определенной температуре зависят в основном от двух факторов: от атомарного отношения содержания в расплаве кислорода и кремния (О/Si) и от значения энергии связи других катионов (помимо Siи А1) с кислородом, отнесенной на одну связь катион — кислород, т.е., по сути, от состава. С увеличением отношения О/Si, имеющим место при введении в состав расплава помимо кремнезема и глинозема оксидов других металлов, происходит дробление и уменьшение кремнекислородных комплексов. С уменьшением этого отношения, наоборот, все большее число кремнекислородных тетраэдров связывается через общие вершины. В расплаве кремнезема отношение O/Si= 2 имеет наименьшее возможное значение, что обеспечивает максимальное связывание кремнекислородных тетраэдров через общие вершины. При увеличении отношения О/Si комплексы начинают дробиться, благодаря чему в многокомпонентных силикатных расплавах могут присутствовать анионные комплексы различной степени сложности и конфигурации, напоминающие кремнекислородные мотивы решеток кристаллических силикатов.
Помимо состава на строение расплавов, в частности на состав частиц, из которых они состоят, большое влияние оказывает температура. Согласно О. В. Мазурину, виды структурных преобразований в расплавах, происходящих при изменении температуры, сводятся к следующим основным типам:
1. Температурные флуктуации плотности. Этот вид неоднородности типичен для любых расплавов. По мере охлаждения интенсивность этих флуктуации уменьшается пропорционально снижению температуры до тех пор, пока расплав сохраняется в метастабильном состоянии.
2. Изменение координации. Влияние состава на координацию ионов в расплаве изучено достаточно подробно, влияние же температуры на соотношение в расплаве одноименных атомов, находящихся в разных координационных состояниях по кислороду, даже качественно изучено крайне мало. В большинстве случаев следует ожидать уменьшения координационных чисел при росте температуры.
3. Образование и диссоциация структурных комплексов. Усиление тепловых колебаний ионов с увеличением температуры приводит к разрыву связей Si—О и дроблению комплексов. При понижении температуры, наоборот, происходит укрупнение комплексов, т. е. увеличение степени ассоциации, уменьшает свой объём на 5% – от 1 л до 950 мл. Используя большие давления, жидкости можно сжать и ещё сильнее.
2. Микрокристаллическая модель
Микрокристаллическая модель предполагает, что в жидкости существуют группы молекул – ''микрокристаллы'', содержащие несколько десятков или сот молекул. Внутри каждого микрокристалла сохраняется в точности порядок твердого тела. Эти группы молекул, или ''кластеры'', существуют непродолжительное время, затем распадаются и создаются вновь; кроме того, они постоянно перемещаются так, что каждая молекула не принадлежит все время к одной и той же группе молекул или ''кластеру''. Собственно, этим свойством объясняется текучесть жидкости. Наличие в жидкости пространственного упорядочения молекул подтверждается многими факторами, в частности экспериментальными по рассеянию света и рентгеновского излучения, нейтронов и электронов.[6,7]
Результаты рентгеновского анализа жидкостей можно объяснить, представив их структуру либо как скопления множества ультрамикроскопических значительно деформированных агрегатов, либо в виде непрерывной, структурной сетки, в которой элементы структурного порядка ограничены ближайшими соседями.
Первое предположение означает, что огромное число мельчайших ''кристаллических островков'' (сиботоксических групп) разделены областями беспорядочного расположения частиц. Они перемещаются и не только непрерывно утрачивают одни частицы и пополняются другими, но могут разрушаться и создаваться вновь. Как в газе, они перемещаются по объему, как в кристаллах, колеблются около положения равновесия. Нагревание сокращает время ''оседлой'' жизни сиботаксических групп, охлаждение приводит к противоположному результату. Таким образом, представление о жидкости формируется на основании результатов синтеза представлений о газах и кристаллах – сочетания закономерного расположения молекул в небольших объемах с неупорядоченным распределением во всем объеме.
3. Квазикристаллическая модель.
Квазикристаллическая модель предполагает, что относительное расположение частиц в жидкости приближается к имеющемуся в кристалле, причем отступление от правильности систематически увеличивается с расстоянием по мере удаления от исходной молекулы на большом расстоянии уже не наблюдается правильности в расположении молекул, то есть в жидкости имеет место ''ближний порядок'' и отсутствует ''дальний порядок''.
Второе предположение сводится к представлению о квазикристаллической структуре жидкости: каждая молекула окружена соседними, которые располагаются вокруг нее почти так же, как и в кристалле того же вещества. Однако во втором слое появляются отклонения от упорядоченности, которые увеличиваются по мере отдаления от первоначально взятой молекулы. Иначе говоря, отступление от правильного расположения по мере удаления от данной молекулы систематически возрастает и на большом расстоянии становится очень значительным – в жидкости существует ближний порядок. Этим строение жидкости отличается от строения кристаллов, характеризующегося строгой повторяемостью одного и того же элемента структуры (иона, атома, группы атомов, молекул) во всех направлениях, то есть дальним порядком.
Изучение рассеяния рентгеновских лучей в жидкостях, состоящих из многоатомных молекул, показало не только упорядоченное расположение молекул, но и известную закономерность во взаимной ориентации частиц. Эта ориентация усиливается для полярных молекул и если проявляется действие водородной связи.
Беспорядочное движение молекул жидкости приводит к непрерывному изменению расстояний между ними. Это можно выразить словами: структура жидкости носит статистический характер. В этом состоит существенное различие жидкости от кристаллов. Статистический характер упорядоченного расположения молекул жидкости приводит к флуктуациям – непрерывно происходящим отклонениям не только от средней плотности, но и от средней ориентации, так как молекулы жидкости способны образовывать группы, в которых преобладает определенная ориентация. Чем меньше величина этих 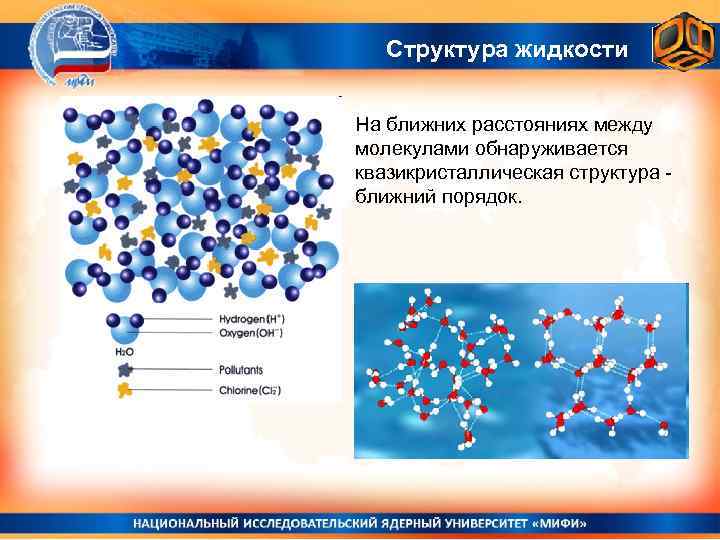 отклонений, тем чаще они встречаются.
отклонений, тем чаще они встречаются.
Наиболее наглядным примером образования диссипативной структуры являются ячейки Бенара. В этом случае управляющим параметром процесса самоорганизации является градиент температуры. При малых значениях градиента температуры с жидкостью ничего не происходит, т. е. система находится в непосредственной близости от термодинамического равновесия, при этом подводимое извне тепло отводится посредствам диффузии. При постоянном нагревании система все больше и больше становится термодинамически неустойчивой. Тепловой диффузии становится все труднее обеспечивать рассеяние подводимой энергии. Это происходит до тех пор, пока внезапно не откроется конвективный канал отвода энергии и в точке неустойчивости не возникнет макроскопическое коллективное движение жидкости. Более нагретые участки жидкости, находящиеся ближе к источнику тепла, расширяются и, подчиняясь подъемной силе Архимеда, поднимаются вверх. Здесь они охлаждаются и вновь опускаются вниз. Подъемной силе противостоят сопротивление внутреннего трения и тепловая диффузия, которые стремятся уровнять температуру и плотность нагретого участка жидкости с температурой и плотностью окружающей среды. Таким образом устанавливается процесс конвективного переноса тепла, обусловленный коллективным движением жидкости. Это движение производится за счет кинетической энергии – работы сил, вызывающих всплывание более теп- 10 лых масс жидкости при наличии обратного градиента температуры, поддерживаемого односторонним нагревом.
4. Колебательно - усредненная структура жидкости
Структурное описание может относиться ко всему множеству элементов атомно-молекулярной системы, задающемуся числом частиц, или к его части. Полное соответствие соблюдается только в случае идеального кристалла, однако оно не является единственно возможным в частично упорядоченных системах (фазах), имеющих внешние и внутренние поверхности раздела. Второе разделение связано с тем, что структура может относиться не только к исходным элементам множества, задающего систему, но и к производным элементам, геометрически или топологически задающимся в пространстве (например, разного рода полиэдральные схемы для всего объема жидкости). Разновременные I, V, D и производные от них структуры в твердом и жидком состоянии, связанные с усреднениями в расположении частиц за разные времена, привносят добавочную специфику и представляют характерный пример отличия структурных элементов в параллельно сосуществующих структурах.
С использованием компьютерного эксперимента и других теоретических и экспериментальных методов в жидкости в настоящее время выделяются разные пространственные структуры.
В структуре I структурные единицы тождественны или задаются исходными точками (частицами) системы, которые могут быть получены методами компьютерного моделирования.
В структуре V исходный структурный элемент выделяется при усреднениях расположений частиц при их колебательных движениях. При этом, в случае кристалла появляется трансляционная упорядоченность в цепочке частиц.
Наиболее вероятная структура Dv, в этом случае геометрически тождественна со структурой V. В то же время только в случае структуры D реального кристалла, реализующейся за макроскопические времена, появляется решетка кристалла и возможность описания системы, используя федоровские группы симметрии (при отсутствии рассмотрения внешних границ). Таким образом, понятие идеального кристалла может соотноситься в первую очередь со структурой D реального объекта. В то же время объединение динамического и геометрического подходов описания структуры кристаллов, по-видимому, возможно через анализ соотношения их конкретных структур I, V, Dv, D.
При переходе к жидкости появляются новые структурные особенности. Описание структуры здесь должно быть дано в уточняющей трактовке, не тождественной квазикристаллическому описанию. Это связано с тем, что в отличие от твердого тела колебательно - усредненную структуру жидкости нельзя рассматривать без учета влияния диффузионных (трансляционных и вращательных) движений молекул на характер усреднения их центров колебаний, задающих геометрию структурных единиц. Особенность рассматриваемой здесь V-структуры заключается в том, что она относится к пространственно - разделенным участкам системы, включающим только часть ее частиц, и отвечает дискретному расположению центров колебаний (или усредненных позиций среди смещающихся центров колебаний) вокруг позиции, задающейся невозмущенной диффузионным движением конфигурацией молекул. Геометрические различия структур V и V' соответствуют различиям ''жестких'' и ''мягких'' структурных конфигураций в конформационном анализе. При совместном рассмотрении жестких и нежестких структур V и V' жидкостей и растворов и жестких (мягких) конфигураций сложных молекул может идти объединение геометрического и динамического подходов к анализу структуры сложных систем и изучение структурных эффектов влияния среды на конформационные движения молекул. Переход к описанию жидкости на уровне колебательно - усредненной структуры в этом случае может осуществляться в рамках рассмотрения двух структурных подсистем (V и V') с учетом трех видов молекул, которые могут в разной степени присутствовать в жидкостях:
V-частицы, которые осуществляют колебательные движения во временных положениях равновесия в течение времени τ в постоянном поле, создаваемом одними и теми же соседями (центр колебаний центральной молекулы усредняется вне влияния поля нарушений, появляющегося вследствие изменения расположений частиц при диффузионных движениях).
I'-частицы, находящиеся вне позиций, отвечающих временным положениям равновесия в конфигурациях глубоких минимумов, на поверхности потенциальной энергии системы.
V'-частицы, колебания которых осуществляются при наличии влияния быстропеременного поля локальных нарушений исходной постройки, создаваемого I'-частицами.
5. Кластерная структура жидкости.
Кластеры, многоядерные комплексные соединения, в основе молекулярной структуры которых лежит объемный скелет (ячейка) из атомов металла, (обычно переходного), непосредственно связанных между собой. Ячейка окружена лигандами и играет роль центра атома. Как правило, она имеет, форму правильного полиэдра. Из возможных полиэдров чаще других реализуются те, стороны которых правильные треугольники.
Атомные и молекулярные кластеры. В простейшем случае эту систему описывают моделями, в которых частицы заменены шарами. При этом кластер удобно рассматривать как жидкую каплю, в которой частицы плотно упакованы. С геометрической точки зрения такая модель кластера не представляет наиболее плотную упаковку шаров. Под плотностью упаковки обычно понимают долю пространства, занимаемую шарами, которыми заполнено все пространство. Так, например, пентагональная упаковка шаров, изображенная на рисунке ниже, имеет плотность 72 процента.
При конечной температуре такая упаковка, однако, обладала бы большей свободной энергией, чем рассматриваемая нами модель жидкой капли. Возможны и более плотные упаковки шаров, чем изображенная на рис. 3. Существует две основные плотнейшие упаковки — кубическая трехслойная и гексагональная двухслойная. Для плотнейшей упаковки коэффициент заполнения пространства равен 0.74048. Такие структуры действительно могут наблюдаться при очень низких температурах в кластерах из атомов благородных газов.

Современная технология позволяет получать кластеры, содержащие заданное число молекул данного типа. Методом масс - спектрометрии можно выбрать из пучка кластеры, содержащие фиксированное число молекул п. Так у плотно упакованного кластера из 20 атомов только один атом находится внутри объема. У кластеров из 100 атомов — не более 20.
Для малых кластеров n
Кластеры из атомов инертных газов представляют собой простейший и наиболее изученный тип кластеров.
На рис ниже приведено изображение кластера из атомов аргона, содержащего 16 атомов.

Атомы инертных газов с полностью заполненными электронными оболочками слабо взаимодействуют друг с другом посредством ван-дер-ваальсовых сил.
Характерная энергия связи, т.е. энергия, затрачиваемая на отрыв атома от кластера, очень мала и составляет примерно 10 К - 100 К. При описании таких кластеров с достаточно хорошей точностью применима модель твердых шаров. В настоящее время с помощью описанной выше технологии газопламенных кластерных пучков удается создавать кластеры из атомов инертных газов, содержащие от нескольких единиц до десятков тысяч атомов. Кластеры из атомов инертных газов представляют собой уникальный объект для изучения атом-атомных взаимодействий различных типов возбуждений в таких кластерах, электрон-атомного взаимодействия и т.д.
Заключение
В курсовой работе на тему «Современные теории строения жидкости» рассматриваются современные теории строения жидкостей, являющиеся трактовками экспериментальных данных из рентгеноструктурного анализа, дифракции электронов и нейтронографии, в частности рассматриваются 3 основных модели: Микрокристаллическая модель, квазикристаллическая модель и колебательно-усредненная структура жидкостей. Изучение теоретической литературы показало, что данные модели имеют несколько общих черт, подтверждённых экспериментально и описывающих основные свойства жидкостей.
В результате исследования мы выделили 3 общих черты для современных моделей строения жидкостей:
1) Современные теории строения жидкостей подразумевают структуру в том или ином виде напоминающую кристаллическую
2) Данные структуры имеют статистический характер, что в свою очередь вызывает флуктуации
3) В жидкости прослеживается «ближний порядок» и отсутствует «дальний порядок».
Таким образом, современные модели строения жидкостей, полученные на основе экспериментальных данных, говорят о том, что жидкости имеют схожее строение с кристаллическими телами, то есть жидкости приближенны по своему строению к твёрдым телам.
Список используемой литературы
Модель строения жидкости в молекулярно-кинетической теории. // Калькулятор URL: https://www.calc.ru/Model-Stroyeniya-Zhidkosti-V-Molekulyarnokineticheskoy-Teori.html (дата обращения: 07.05.2024).
Игнатов Игнат, Мосин Олег Викторович, Великов Борислав Математические модели, описывающие структуру воды // Интернет-журнал «НАУКОВЕДЕНИЕ» . - 2013. - №3
Астафуров В. И., Бусев А. И. ''Строение вещества'': Кн. для учащихся – 2-е изд., перераб. – М. : Просвещение, 1983. – 160 с.
Скрышевский А. Ф. “Структурный анализ жидкостей и аморфных тел”. Москва “Высшая школа” 1980, 325с.
Скрышевский А. Ф. “Структурный анализ жидкостей”. Москва “Высшая школа” 1971, 246с.
Современные модели описания структуры жидкости // Geum URL: https://geum.ru/next/art-237800.php (дата обращения: 07.05.2024).
Физикохимия нефтяных дисперсных систем. Нефтяные дисперсные системы : конспект лекций для студентов бакалавриата по направлению подготовки 18.03.01 «Химическая технология», направленность «Химическая технология природных энергоносителей и углеродных материалов», всех форм обучения / Н. И. Полежаева ; СибГУ им. М. Ф. Решетнева. – Красноярск, 2020. – 56 с.






 ещество находится в жидком состоянии, если средняя кинетическая энергия теплового движения его молекул примерно равна средней потенциальной энергии их взаимодействия.
ещество находится в жидком состоянии, если средняя кинетическая энергия теплового движения его молекул примерно равна средней потенциальной энергии их взаимодействия.
 отклонений, тем чаще они встречаются.
отклонений, тем чаще они встречаются.











