Спецификация
контрольной работы
по химии для обучающихся 91 класса
по теме «Металлы и их соединения»
Проводится в рамках внутреннего мониторинга
КОУ «Средняя школа №4 (очно-заочная)»
1. Назначение КИМ
- Оценить уровень общеобразовательной подготовки обучающихся 9 класса по химии по теме: «Металлы и их соединения».
- Выявить наиболее трудные для обучающихся элементы содержания учебного материала.
- Оценить уровень освоения основных формируемых предметом видов деятельности на этапе изучения темы.
2. Подходы к отбору содержания, разработке структуры КИМ
Содержание и основные характеристики диагностических материалов определяются на основе следующих документов:
- Федеральный компонент государственного стандарта основного общего образования по химии (Приказ Минобразования РФ от 05.03.2004 г. № 1089).
- Учебный план КОУ «Средняя школа №4 (очно-заочная)» на 2016-2017
учебный год, разработанный на основе Федерального базисного учебного, утверждённого Министерством образования Российской федерации (Приказ №1312 от 09.03.2004 г).
- Программа основного общего образования по химии. 8-9 классы. Авторы О.С.Габриелян, А.В.Купцова. - М.: Дрофа, 2015.
- Рабочая программа по химии на 2016-2017 учебный год.
Разработка КИМ для проведения контрольной работы по химии осуществлялась с учётом следующих общих положений:
- КИМ ориентированы на проверку усвоения системы знаний, которая рассматривается в качестве инвариантного ядра содержания действующих программ по химии для основной школы, а также на проверку сформированности у обучающихся умения применять
полученные знания в различных ситуациях.
- КИМ призваны обеспечивать возможность дифференцированной оценки обучающихся. В этих целях проверка усвоения основных элементов содержания темы осуществляется на трёх уровнях сложности: базовом, повышенном и высоком.
- Учебный материал, на базе которого строятся задания, отбирается по принципу его значимости для общей культуры обучающихся, общеобразовательной подготовки и значимости материала с точки зрения возможности его применения в повседневной жизни.
3. Структура КИМ.
Структура КИМ определяется особенностями образовательной среды школы пенитенциарной системы: социально-педагогическая запущенность, отставание в психологическом и интеллектуальном развитии обучающихся; слабая мотивация к учебной деятельности или её отсутствие. Основной контингент школы составляют обучающиеся с большим перерывом в учебной деятельности, всё это сопровождается, как правило, весьма ощутимой утратой мотивов и навыков учебной деятельности. Задача учителя – создать «зону успешности», дать возможность выбора.
Контрольная работа состоит из 9 заданий: 6 заданий базового уровня, 1 задание повышенного и
2 задания - высокого уровня сложности.
Каждый вариант проверочной работы состоит из 9 заданий: 6 заданий – с выбором ответа
(часть А); 1 задание – с кратким ответом (часть В), 2 задания – с развёрнутым ответом.
Варианты соответствуют базовому уровню сложности.
В каждом задании части А предложены четыре варианта ответа, из которых нужно выбрать только один. Задание части B - это задание на установление соответствия, требующее записи ответа в виде числа. В заданиях первой формы нужно найти соответствие между веществами и их признаками или областями применения, перечисленными в двух разных столбцах. Каждому элементу первого столбца надо поставить в соответствие элемент второго столбца (причем в этом столбце могут быть и лишние элементы). В заданиях части С необходимо решить задачу и записать ответ в виде цифр и осуществить превращения, т.е. записать уравнения химических реакций и рассмотреть одну из них с точки зрения окислительно - восстановительного процесса.
4. Распределение заданий КИМ по содержанию, видам умений и способам деятельности, по уровням сложности.
Распределение заданий по уровням сложности, типам заданий и времени выполнения представлено в таблице.
Таблица 1
| № задания | Уровень | Тип задания | Примерное время выполнения задания |
| А1 | базовый | Тест с выбором ответа | 2 мин |
| А2 | базовый | Тест с выбором ответа | 2 мин |
| А3 | базовый | Тест с выбором ответа | 2 мин |
| А4 | базовый | Тест с выбором ответа | 2 мин |
| А5 | базовый | Тест с выбором ответа | 2 мин |
| А6 | базовый | Тест с выбором ответа | 2 мин |
| В1 | повышенный | Соотнесение примеров с соответствующим понятием | 5 мин |
| С1 | высокий | Задание с развернутым ответом | 13 мин |
| С2 | высокий | Задача с развернутым ответом | 15 мин |
Задания в контрольной работе оцениваются в зависимости от сложности задания разным количеством баллов, указанных в таблице 2.
Таблица 2
| № задания | Количество баллов |
| А1 | 1 балл – правильный ответ |
| А2 | 1 балл – правильный ответ |
| А3 | 1 балл – правильный ответ |
| А4 | 1 балл – правильный ответ |
| А5 | 1 балл – правильный ответ |
| А6 | 1 балл – правильный ответ |
| В1 | Максимальное количество баллов - 4 1 балл - за каждое правильно установленное соответствие |
| С1 | Максимальное количество баллов - 8 1 балл - каждое уравнение реакции (всего 5); 3 балла - за уравнивание реакции №4 методом электронного баланса |
| С2 | Максимальное количество баллов - 8 1 балл - верно записано уравнение реакции, произведены расчеты по данному уравнению. 2балла - найдена масса магния 2балла -найдено количество вещества магния 2 балла - найден объем водорода теоретический 1 балл - найдена объемная доля выхода продукта реакции |
| Итого | 26 баллов |
Перевод баллов к 5-балльной отметке представлен в таблице 3.
Таблица 3
| Баллы | Отметка |
| 22 -26 баллов: | Отметка «5» |
| 17 -21 баллов: | Отметка «4» |
| 9-16 баллов | Отметка «3» |
| 0- 8 баллов | Отметка «2» |
План варианта КИМ
Таблица 4
| Задания | Проверяемый элемент содержания | Код |
| А 1 | Строение атома. Строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева | 1.1 |
| А 2 | Закономерности изменения свойств элементов и их соединений в связи с положением в Периодической системе химических элементов Д.И. Менделеева | 1.2.2 |
| А 3 | Атомы и молекулы. Химический элемент. Простые и сложные вещества. Основные классы неорганических веществ. Номенклатура неорганических соединений | 1.6 |
| А 4 | Химические свойства простых веществ | 3.1 |
| А 5 | Химические свойства сложных веществ | 3.2 |
| А 6 | Получение и изучение свойств изученных классов неорганических веществ. | 4.3 |
| В 1 | Химические свойства оксидов: основных, амфотерных, кислотных. Химические свойства оснований. Химические свойства солей | 3.2.1 3.2.2 3.2.4 |
| С 1 | Взаимосвязь различных классов неорганических веществ | 3.3. |
| С 2 | Вычисление массовой доли растворённого вещества в растворе | 4.5.2. |
Перечень требований к уровню подготовки обучающихся, освоивших
тему: «Металлы и их соединения».
Таблица 5
| №п/п | Требования к уровню подготовки обучающихся |
| 1 | Знать положение металлов в Периодической системе химических элементов Д.И. Менделеева. Уметь составлять электронные формулы атомов металлов. |
| 2 | Объяснять закономерности изменения строения атомов, свойств элементов в пределах малых периодов и главных подгрупп, а также свойства образуемых ими высших оксидов; |
| 3 | Знать физические свойства металлов. |
| 4 | Знать общие химические свойства металлов: реакции с неметаллами, кислотами, солями. Оценивать возможность протекания реакции, используя ряд напряжений металлов. |
| 5 | Знать химические свойства соединений щелочных, щелочно-земельных металлов, алюминия и железа. |
| 6 | Знать способы получения металлов. |
| 7 | Знать свойства металлов и их соединений. Определять возможность протекания реакций; уметь составлять уравнения химических реакций в молекулярной и ионной формах; уметь определять значения степеней окисления элементов в соединениях, составлять электронные балансы и расставлять коэффициенты в ОВР |
| 8 | Характеризовать взаимосвязь между составом, строением и свойствами неорганических веществ; химические свойства основных классов неорганических веществ (оксидов, кислот, оснований и солей) |
| 9 | Вычислять объёмную долю выхода продукта реакции |
5. Условия проведения.
Контрольная работа (тест) проводится согласно расписанию учебных занятий в присутствии учителя химии. При выполнении контрольной работы обучающиеся записывают ответы в бланк ответа со штампом школы.
6. Время выполнения работы – 45 минут
7. Дополнительные материалы и оборудование
В учебном кабинете во время проведения теста у каждого обучающегося должны быть следующие материалы и оборудование:
- периодическая система химических элементов Д.И.Менделеева;
- таблица растворимости солей, кислот и оснований в воде;
- электрохимический ряд напряжений металлов;
- непрограммируемый калькулятор.
Контрольная работа «Металлы и их соединения» 1 вариант
Часть А.
| При выполнении заданий этой части в бланке ответов под номером выполняемого вами задания поставьте знак «х» в клеточку, номер которой соответствует номеру выбранного вами ответа. |
| А1 | Электронная формула атома магния: 1)1s22s2 2) 1s22s2 2p63s2 3) 1s22s2 2p63s1 4) 1s22s2 2p63s23p2
|
| А2 | В каком ряду химические элементы расположены в порядке усиления металлических свойств? 1) Na, Mg, Al 2) Al, Mg, Na 3) Ca, Mg, Be 4) Mg, Be, Ca
|
| А3 | Металл, обладающий самой высокой электропроводностью, - это 1) железо 2) медь 3) серебро 4) алюминий
|
| А4 | Наиболее энергично взаимодействует с водой: 1) калий 2) натрий 3) кальций 4) магний |
| А5 | Гидроксид цинка взаимодействует с каждым из двух веществ: 1) HCl и CO2 2) NaOH и H2SO4 3) SiO2 и KOH 4) NaNO3 и H2SO4
|
| А6 | Методы переработки руд, основанные на восстановлении металлов из оксидов при высоких температурах, называются: 1) гидрометаллургия 2) пирометаллургия 3) электрометаллургия 4) микробиологический метод
|
Часть В.
| В задании В1 на установление соответствия запишите в таблицу цифры выбранных вами ответов, а затем получившуюся последовательность цифр перенесите в бланк ответов без пробелов и других символов. |
|
В1. |
Установите соответствие между веществами, вступающими в реакцию и продуктами их взаимодействия РЕАГИРУЮЩИЕ ВЕЩЕСТВА ПРОДУКТЫ РЕАКЦИИ
А) СаO + CO2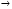 1) Ca(OH)2 1) Ca(OH)2 Б) Ca(OH)2+ SO2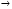 2) CaCO3+ H2O 2) CaCO3+ H2O В) Ca + H2O 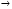 3) CaSO4+ H2O 3) CaSO4+ H2O Г) Ca (HCO3)2 + Ca(OH)2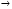 4) Ca(OH)2 + H2 4) Ca(OH)2 + H2 5) CaSO3 + H2O 6) CaCO3 |
Часть С.
С1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
Fe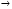 FeCl3
FeCl3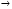 Fe(OH)3
Fe(OH)3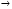 Fe2O3
Fe2O3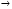 Fe
Fe FeCl2.
FeCl2.
Переход 4 рассмотрите в свете ОВР, уравняйте методом электронного баланса.
C2. При взаимодействии 12 г технического магния, содержащего 5% примесей, с избытком соляной кислоты, выделилось 10 л водорода (н.у.). Вычислите объемную долю выхода продукта реакции.
8





 1) Ca(OH)2
1) Ca(OH)2 









