Степень окисления
8 класс

Определение понятия «степень окисления»
Подумайте, какие слова (словосочетания),
выражают сущность понятия «степень окисления».
Степень окисления это условный заряд атома в молекуле (формульной единице), вычисленный из предположения, что все связи в соединении ионные.
Степень окисления химического элемента в соединении это
целое число от 4 до +8 включительно.
Таким образом, она может быть положительна, отрицательна, равна нулю.
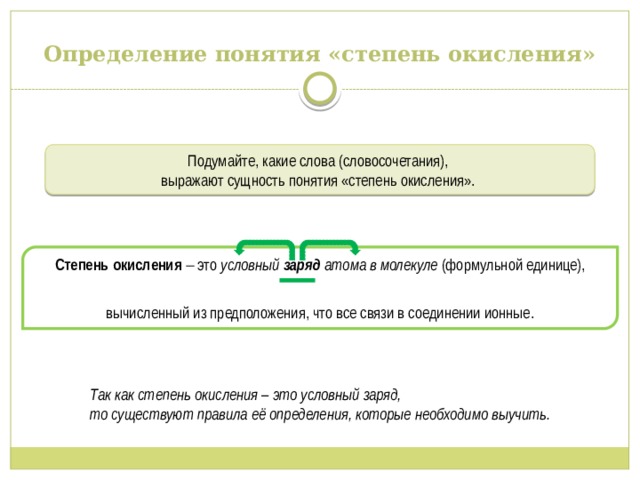
Определение понятия «степень окисления»
Подумайте, какие слова (словосочетания),
выражают сущность понятия «степень окисления».
Степень окисления это условный заряд атома в молекуле (формульной единице), вычисленный из предположения, что все связи в соединении ионные.
Так как степень окисления – это условный заряд, то существуют правила её определения, которые необходимо выучить.

Как указывают степень окисления
Степень окисления записывают над символом химического элемента.
Степень окисления кислорода в молекуле озона равна нулю O 3 .
Степень окисления кислорода в молекуле воды равна минус два H 2 O.
Степень окисления кислорода в пероксиде водорода равна минус одному H 2 O 2 .
Степень окисления кислорода во фториде кислорода равна плюс двум OF 2 .
0
– 2
– 1
+2

Это важно!
Чтобы не путать заряд сложных ионов и степень окисления входящих в них атомов, используют следующие правила:
1) указывая степень окисления вначале записывают знак («+» или «–»), а затем цифру;
- для химических элементов, имеющих степени окисления +1 или –1 цифру «1» рядом со знаком записывают обязательно.
+3 +6 –2
2–
Al 2 (SO 4 ) 3
Степень окисления указана синим цветом, а заряд сульфат-иона – красным.

Правила определения степени окисления
Правило 1. Степень окисления химического элемента в простом (состоящем из одного химического элемента) веществе равна нулю.
Например, степень окисления химических элементов в простых веществах, алюминии, железе, кислороде, фосфоре, сере, равна нулю. Запишем это, используя формулы.
Al, Fe, O 2 , P 4 , S 8 .
0 0 0 0 0
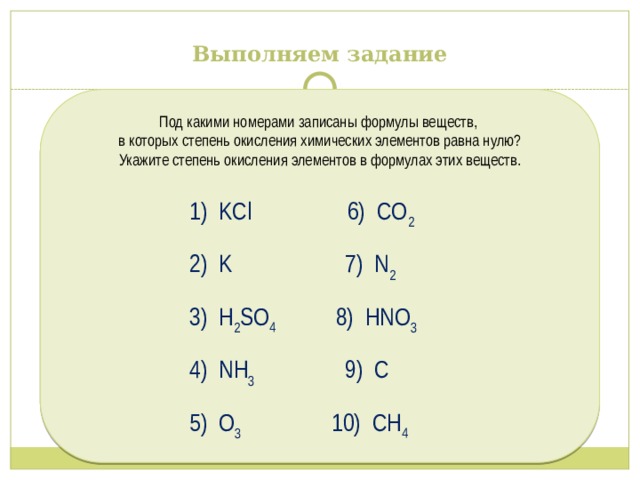
Выполняем задание
Под какими номерами записаны формулы веществ,
в которых степень окисления химических элементов равна нулю?
Укажите степень окисления элементов в формулах этих веществ.
1) KCl 6) CO 2
2) K 7) N 2
3) H 2 SO 4 8) HNO 3
4) NH 3 9) C
5) O 3 10) СН 4
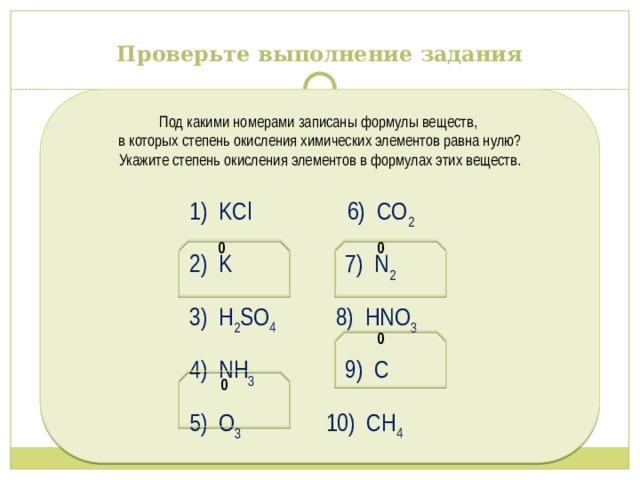
Проверьте выполнение задания
Под какими номерами записаны формулы веществ,
в которых степень окисления химических элементов равна нулю?
Укажите степень окисления элементов в формулах этих веществ.
1) KCl 6) CO 2
2) K 7) N 2
3) H 2 SO 4 8) HNO 3
4) NH 3 9) C
5) O 3 10) СН 4
0 0
0
0

Правила определения степени окисления
Правило 2. В сложных веществах (состоящих из нескольких элементов) степень окисления:
- у кислорода 2 (например, SO 2 , KOH, HNO 3 ), исключения: фторид кислорода OF 2 , пероксид водорода H 2 O 2 , пероксид натрия Na 2 O 2 ;
- у водорода в соединения с неметаллами +1 (например, HCl, H 2 CO 3 );
- у водорода в соединениях с металлами 1 (например, KH, CaH 2 );
- у щелочных металлов элементов lА группы +1 (например, Na 2 O, K 2 S);
- у элементов llА группы +2 (например, BaO, Ca 3 N 2 );
- у алюминия +3 (например, AlN, Al 2 O 3 );
- у неметаллов с большей электроотрицательностью в бинарных соединениях вычисляют по формуле: N 8, где N — номер группы, в которой находится элемент в периодической системе, . Например, KCl, Na 3 P, H 2 S).
2 2 2 +2
1 1
+1 +1
1 1
+1 +1
+2 +2
+3 +3
1 3 2
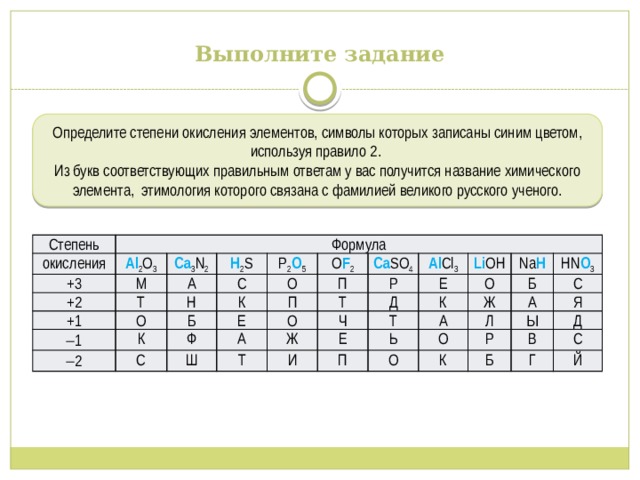
Выполните задание
Определите степени окисления элементов, символы которых записаны синим цветом, используя правило 2.
Из букв соответствующих правильным ответам у вас получится название химического элемента, этимология которого связана с фамилией великого русского ученого.
Степень
окисления
Формула
Al 2 O 3
+3
+2
Ca 3 N 2
М
Н 2 S
+1
А
Т
P 2 O 5
1
Н
О
С
К
Б
2
О
К
O F 2
Е
П
Ca SO 4
Ф
П
С
Al Cl 3
О
А
Р
Ш
Т
Li OH
Ж
Т
Ч
Е
Д
Т
К
О
Е
И
Na H
Ж
HN O 3
А
Ь
Б
П
О
Л
А
О
С
Р
К
Ы
Я
В
Б
Д
С
Г
Й
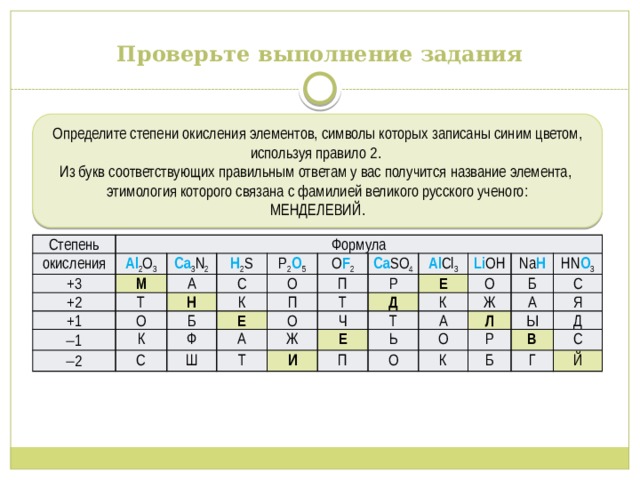
Проверьте выполнение задания
Определите степени окисления элементов, символы которых записаны синим цветом, используя правило 2.
Из букв соответствующих правильным ответам у вас получится название элемента, этимология которого связана с фамилией великого русского ученого:
МЕНДЕЛЕВИЙ.
Степень
окисления
Формула
Al 2 O 3
+3
Ca 3 N 2
+2
М
+1
Н 2 S
Т
А
1
P 2 O 5
С
О
Н
Б
O F 2
2
К
К
О
Ca SO 4
Ф
П
Е
П
С
А
О
Al Cl 3
Р
Ш
Т
Li OH
Ж
Т
Д
Ч
Е
И
Е
Т
О
Na H
К
HN O 3
Ж
Ь
А
Б
П
Л
О
О
С
А
Р
Ы
Я
К
Б
В
Д
С
Г
Й
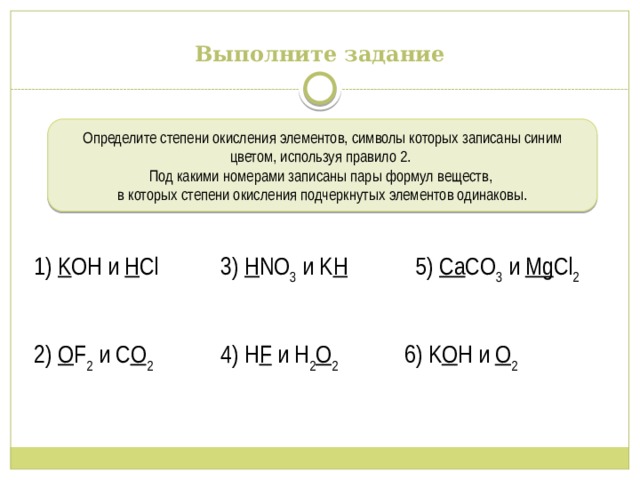
Выполните задание
Определите степени окисления элементов, символы которых записаны синим цветом, используя правило 2.
Под какими номерами записаны пары формул веществ,
в которых степени окисления подчеркнутых элементов одинаковы.
1) K OH и H Cl 3) H NO 3 и K H 5) Ca CO 3 и Mg Cl 2
2) O F 2 и C O 2 4) H F и H 2 O 2 6) K O H и O 2
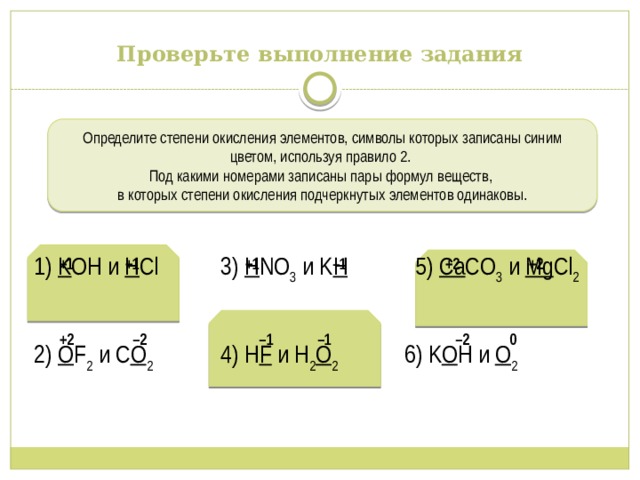
Проверьте выполнение задания
Определите степени окисления элементов, символы которых записаны синим цветом, используя правило 2.
Под какими номерами записаны пары формул веществ,
в которых степени окисления подчеркнутых элементов одинаковы.
1) K OH и H Cl 3) H NO 3 и K H 5) Ca CO 3 и Mg Cl 2
2) O F 2 и C O 2 4) H F и H 2 O 2 6) K O H и O 2
+1 +1 +1 –1 +2 +2
+2 –2 –1 –1 –2 0
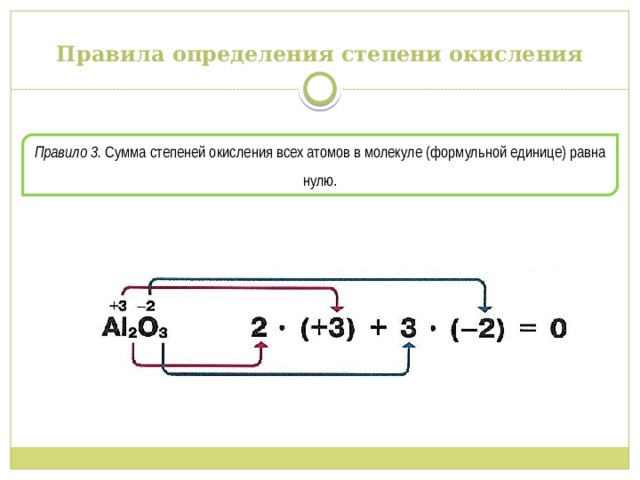
Правила определения степени окисления
Правило 3. Сумма степеней окисления всех атомов в молекуле (формульной единице) равна нулю.
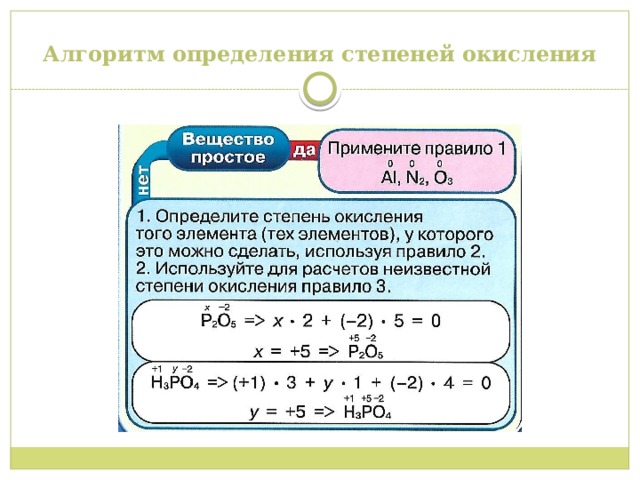
Алгоритм определения степеней окисления
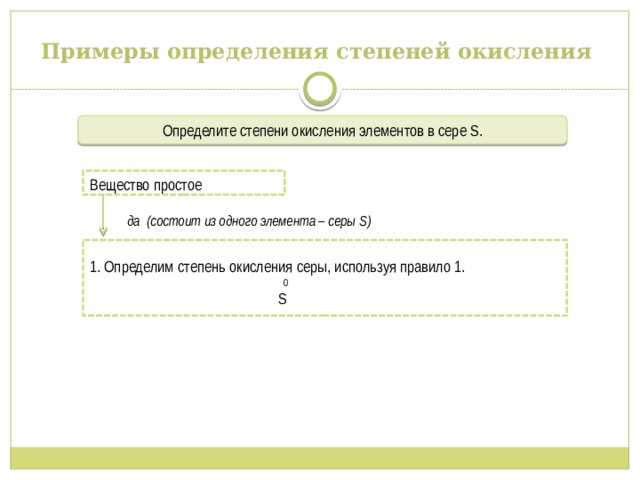
Примеры определения степеней окисления
Определите степени окисления элементов в сере S.
да (состоит из одного элемента – серы S)
Вещество простое
1. Определим степень окисления серы, используя правило 1.
0
S
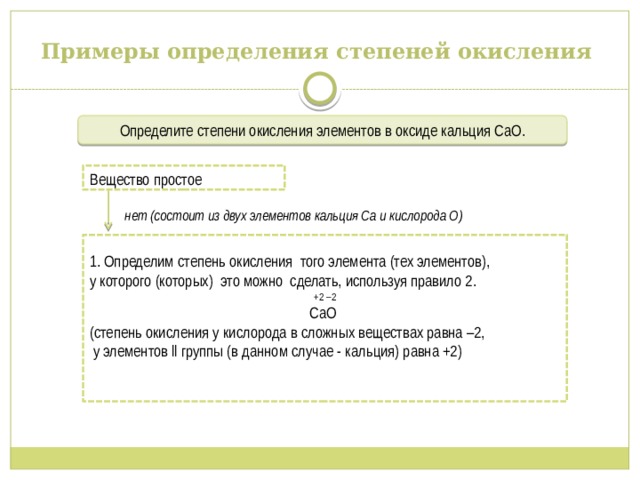
Примеры определения степеней окисления
Определите степени окисления элементов в оксиде кальция СаО .
нет (состоит из двух элементов кальция Са и кислорода О)
Вещество простое
1. Определим степень окисления того элемента (тех элементов),
у которого (которых) это можно сделать, используя правило 2.
+2 –2
CaO
(степень окисления у кислорода в сложных веществах равна –2,
у элементов ll группы (в данном случае - кальция) равна +2)

Примеры определения степеней окисления
Определите степени окисления элементов хлориде меди (II) CuCl 2 .
нет (состоит из двух элементов меди Сu и хлора Cl )
Вещество простое
1. Определим степень окисления того элемента, у которого это можно сделать, используя правило 2.
– 1
CuCl 2 (в бинарном соединении у элемента с большей электроотрицательностью (в данном случае хлора) – степень окисления равна N – 8, где N – номер группы, в которой элемент находится в периодической системе Д. И. Менделеева (7 – 8 = –1).
2. Используем для расчётов неизвестной степени окисления правило 3.
х –1 +2 –1
CuCl 2 = х ∙ 1 + (–1) ∙ 2 = 0; х = +2 = CuCl 2
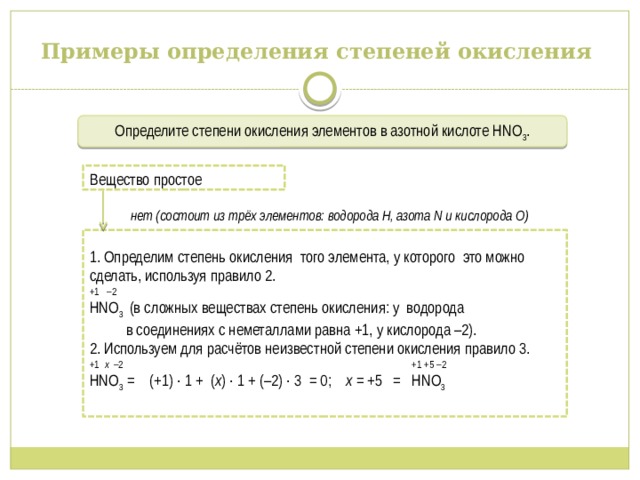
Примеры определения степеней окисления
Определите степени окисления элементов в азотной кислоте НNО 3 .
нет (состоит из трёх элементов: водорода Н, азота N и кислорода O)
Вещество простое
1. Определим степень окисления того элемента, у которого это можно сделать, используя правило 2.
+1 –2
НNО 3 (в сложных веществах степень окисления: у водорода в соединениях с неметаллами равна +1, у кислорода –2).
2. Используем для расчётов неизвестной степени окисления правило 3.
+1 х –2 +1 +5 –2
НNО 3 = (+1) ∙ 1 + ( х ) ∙ 1 + (–2) ∙ 3 = 0; х = +5 = НNО 3

Выполните задание
Определите степени окисления элементов в веществах, формулы которых:
CaCl 2 , Cu, NaNO 3 , Ba(OH) 2 , Al, СuSO 4 , MgCO 3 , N 2 , KCl, Al(OH) 3 , BaS, H 2 , Na 2 SiO 3 , KOH, Na 3 PO 4 , Na 2 SO 3 , Fe

Проверьте выполненное задание
Определите степени окисления элементов в веществах, формулы которых :
CaCl 2 , Cu, NaNO 3 , Ba(OH) 2 , Al, СuSO 4 , MgCO 3 , N 2 , KCl, Al(OH) 3 , BaS, H 2 , Na 2 SiO 3 , KOH, Na 3 PO 4 , Na 2 SO 3 , Fe
+2 –1 0 +1 +5 –2 +2 –2 +1 0 +2 +6 –2 +2 +4 –2 0 +1 –1
+3 –2 +1 +2 –2 0 +1 +4 –2 +1 –2 +1 +1 +5 –2 +1 +6 –2 0






































