
Степень окисления. Бинарные вещества-оксиды. Гидроксиды

Степень окисления
- Степень окисления – это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов (атомов имеющих какой-либо заряд).
- Рассмотрим строение атомов фтора и натрия:
F: +9 )2)7
Na: +11 )2)8)1
- Что можно сказать о завершённости внешнего уровня атомов фтора и натрия?
- - Какому атому легче принять, а какому легче отдать валентные электроны с целью завершения внешнего уровня?

- Оба атома имеют незавершённый внешний уровень.
- Атому натрия легче отдавать электроны, фтору – принять электроны до завершения внешнего уровня.
- F 0 + 1ē → F -1 (нейтральный атом принимает один отрицательный электрон и приобретает степень окисления «-1», превращаясь в отрицательно заряженный ион - анион )
- Na 0 – 1ē → Na +1 (нейтральный атом отдаёт один отрицательный электрон и приобретает степень окисления «+1», превращаясь в положительно заряженный ион - катион )
![Правила определения степень окисления в соединениях. 1. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю - Na 0 , P 4 0 , O 2 0 2. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0 , а в сложном ионе его заряду. Например, H +1 N +5 O 3 -2 : (+1)*1+(+5)*1+(-2)*3 = 0 [S +6 O 4 -2 ] 2- : (+6)*1+(-2)*4 = -2 3. Для элементов главных подгрупп в бинарных соединениях А +n х В -m у : Высшая СО (+n) = номеру группы N группы Низшая СО (-m) = N группы –8 4. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me +n H n -1 ) 5. Кислород обычно проявляет СО -2 (исключения: О +2 F 2 , H 2 O 2 -1 – перекись водорода) 6. Фтор проявляет всегда СО равную -1 (F -1 ) 7. Металлы главных подгрупп I-III групп проявляют +n=Nгруппы 8. Металлы главных подгрупп групп IV-VII и металлы побочных подгрупп проявляют +n , согласно правилу №2 (с учётом рядом стоящего аниона – см. ТР)](https://fsd.multiurok.ru/html/2021/01/13/s_5ffebd9a82253/img3.jpg)
- Правила определения степень окисления в соединениях.
1. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю - Na 0 , P 4 0 , O 2 0
2. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0 , а в сложном ионе его заряду.
Например, H +1 N +5 O 3 -2 : (+1)*1+(+5)*1+(-2)*3 = 0
[S +6 O 4 -2 ] 2- : (+6)*1+(-2)*4 = -2
3. Для элементов главных подгрупп в бинарных соединениях А +n х В -m у :
- Высшая СО (+n) = номеру группы N группы
- Низшая СО (-m) = N группы –8
4. Водород обычно проявляет степень окисления (СО) +1
(исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me +n H n -1 )
5. Кислород обычно проявляет СО -2
(исключения: О +2 F 2 , H 2 O 2 -1 – перекись водорода)
6. Фтор проявляет всегда СО равную -1 (F -1 )
7. Металлы главных подгрупп I-III групп проявляют +n=Nгруппы
8. Металлы главных подгрупп групп IV-VII и металлы побочных подгрупп проявляют +n , согласно правилу №2 (с учётом рядом стоящего аниона – см. ТР)
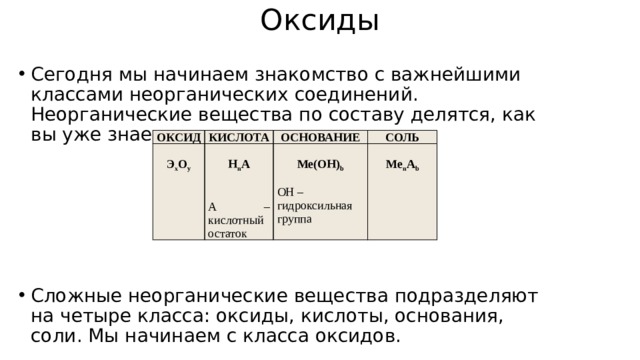
Оксиды
- Сегодня мы начинаем знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые и сложные.
- Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
ОКСИД
КИСЛОТА
Э х О у
ОСНОВАНИЕ
Н n A
СОЛЬ
Ме(ОН) b
А – кислотный остаток
Me n A b
ОН – гидроксильная группа

- Оксиды - это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2. Лишь один химический элемент - фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF 2 . Называются они просто - "оксид + название элемента" (см. таблицу). Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
Формула
Название
CO
NO
Формула
оксид углерода ( II )
Название
Al 2 O 3
оксид азота ( II )
Fe 2 O 3
N 2 O 5
оксид железа (III )
CrO 3
оксид алюминия
оксид хрома (VI )
ZnO
оксид азота (V )
оксид цинка
Mn 2 O 7
оксид марганца (VII )

- Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.

Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO 3 -оксид хрома (VI), Mn 2 O 7 - оксид марганца (VII)):
Основные оксиды – это оксиды, коорым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO - оксид цинка и BeO – оксид берилия):
Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III, иногда IV , а также цинк и бериллий (Например, BeO, ZnO, Al 2 O 3 , Cr 2 O 3 ).
Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N 2 O, NO, CO)

Гидроксиды
- Среди многоэлементных соединений важную группу составляют гидроксиды. Некоторые из них проявляют свойства оснований (основные гидроксиды) – NaOH, Ba(OH) 2 и т.п.; другие проявляют свойства кислот (кислотные гидроксиды) – HNO 3 , H 3 PO 4 и другие. Существуют и амфотерные гидроксиды, способные в зависимости от условий проявлять как свойства оснований, так и свойства кислот – Zn(OH) 2 , Al(OH) 3 и т.п.
Основания - это сложные вещества, состоящие из атома металла, связанного с одной или несколькими гидроксильными группами - ОН. Общая формула:

По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Формула
Название
LiOH
гидроксид лития
Формула
NaOH
KOH
Название
Ca(OH)2
гидроксид натрия
гидроксид калия
гидроксид кальция
Cu(OH) 2
гидроксид меди(II)
Fe(OH) 3
гидроксид железа(III)

Классификация оснований
Щёлочи – это основания растворимые в воде. К щелочам относят гидроксиды щелочных и щелочноземельных металлов: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH) 2 , Sr(OH) 2 , Ba(OH) 2 . Остальные - нерастворимые . К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью -как кислоты.
Классификация оснований по числу групп ОН:
n=1 однокислотное
n=2 двухкислотное
n=3 трехкислотное

Домашнее задание
- Параграф 18 (учебник 8 класс Габриелян) https://clck.ru/RvskP №1-письменно
- Параграф 19 (учебник 8 класс Габриелян) https://clck.ru/RvskP №3,5,6 - письменно на оценку!!!











![Правила определения степень окисления в соединениях. 1. Степень окисления свободных атомов и атомов в молекулах простых веществ равна нулю - Na 0 , P 4 0 , O 2 0 2. В сложном веществе алгебраическая сумма СО всех атомов с учётом их индексов равна нулю = 0 , а в сложном ионе его заряду. Например, H +1 N +5 O 3 -2 : (+1)*1+(+5)*1+(-2)*3 = 0 [S +6 O 4 -2 ] 2- : (+6)*1+(-2)*4 = -2 3. Для элементов главных подгрупп в бинарных соединениях А +n х В -m у : Высшая СО (+n) = номеру группы N группы Низшая СО (-m) = N группы –8 4. Водород обычно проявляет степень окисления (СО) +1 (исключение, соединения с металлами (гидриды) – у водорода СО равна (-1) Me +n H n -1 ) 5. Кислород обычно проявляет СО -2 (исключения: О +2 F 2 , H 2 O 2 -1 – перекись водорода) 6. Фтор проявляет всегда СО равную -1 (F -1 ) 7. Металлы главных подгрупп I-III групп проявляют +n=Nгруппы 8. Металлы главных подгрупп групп IV-VII и металлы побочных подгрупп проявляют +n , согласно правилу №2 (с учётом рядом стоящего аниона – см. ТР)](https://fsd.multiurok.ru/html/2021/01/13/s_5ffebd9a82253/img3.jpg)




























