
Строение атома: физический смысл порядкового номера элемента, массовые числа атомов, изотопы
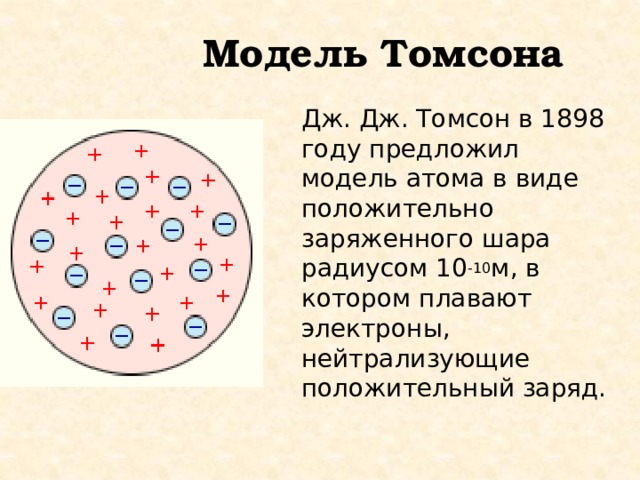
Модель Томсона
Дж. Дж. Томсон в 1898 году предложил модель атома в виде положительно заряженного шара радиусом 10 -10 м, в котором плавают электроны, нейтрализующие положительный заряд.
В 1895 году немецкий учёный Уильям Конрад Рентген обнаружил новый вид невидимых лучей, способных беспрепятственно проходить через твердые тела и вызывать почернение фотоплёнки. Рентген назвал их Х-лучами .
В 1896 году французский ученый Анри Беккерель открыл явление естественной радиоактивности ( от лат. Radius – «луч» ) – самопроизвольного испускания атомами излучения.

В 1898 году Пьер Кюри и Мария Склодовская – Кюри , изучавшие явление радиоактивности, открыли новые элементы – полоний и радий.

Английский физик Эрнест Резерфорд в 1909 г. открыл ядро атома
Опыт Резерфорда : поток ά-частиц, излучаемый радиоактивным источником, через узкую щель направлялся на тонкую золотую фольгу; при помощи флюоресцирующего экрана проводилась регистрация ά-частиц, которые в отсутствии фольги двигались узким пучком, вызывая на экране яркую вспышку
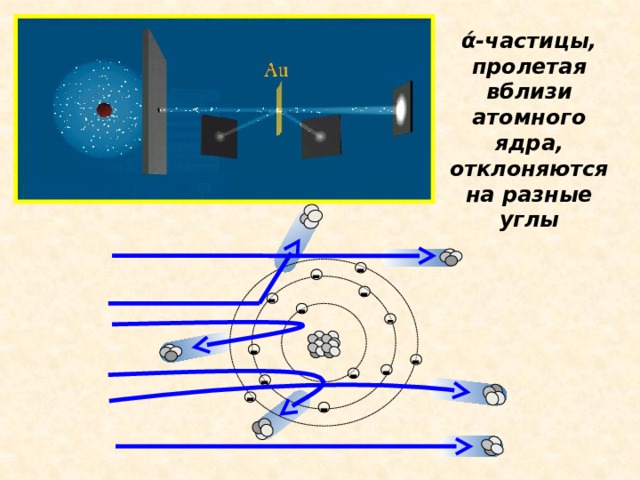
ά-частицы, пролетая вблизи атомного ядра, отклоняются на разные углы
-
-
-
-
-
-
-
-
-
-
-
-
-

Э. Резерфорд предложил планетарную модель атома : в центре находится положительно заряженное ядро, которое имеет достаточно малые размеры, но в нём заключена почти вся масса атома; вокруг ядра по круговым орбитам движутся отрицательно заряженные электроны, подобно движению планет вокруг солнца.
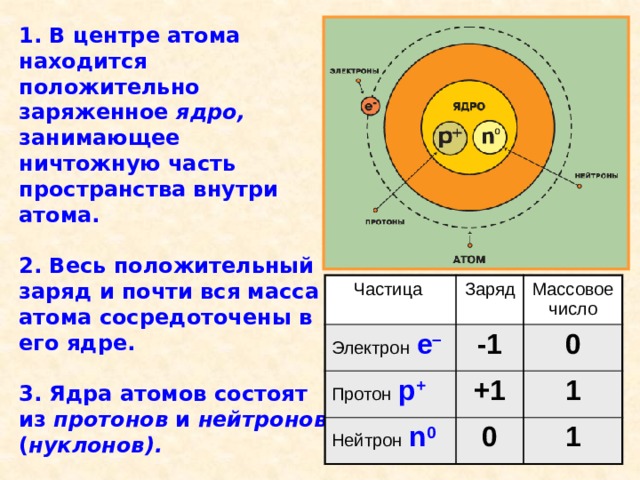
1. В центре атома находится положительно заряженное ядро, занимающее ничтожную часть пространства внутри атома.
2. Весь положительный заряд и почти вся масса атома сосредоточены в его ядре.
3. Ядра атомов состоят из протонов и нейтронов ( нуклонов).
4. Вокруг ядра по замкнутым орбитам вращаются электроны .
Частица
Электрон е –
Заряд
Протон р +
Массовое число
-1
0
Нейтрон n 0
+1
1
0
1

Элементарные частицы
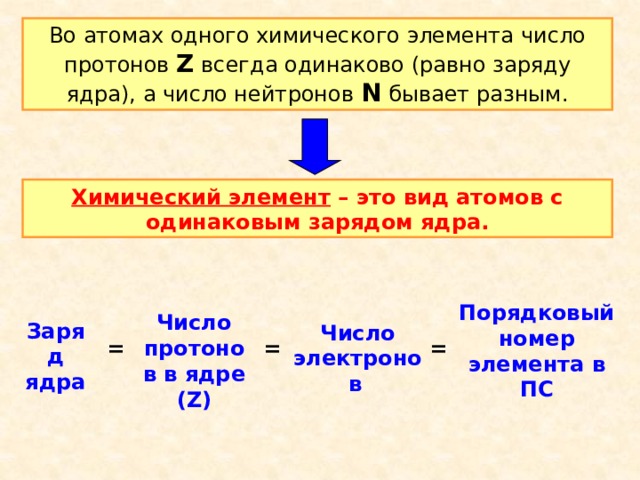
Во атомах одного химического элемента число протонов Z всегда одинаково (равно заряду ядра), а число нейтронов N бывает разным.
Химический элемент – это вид атомов с одинаковым зарядом ядра.
Порядковый номер элемента в ПС
Число протонов в ядре (Z)
Заряд ядра
Число электронов
=
=
=
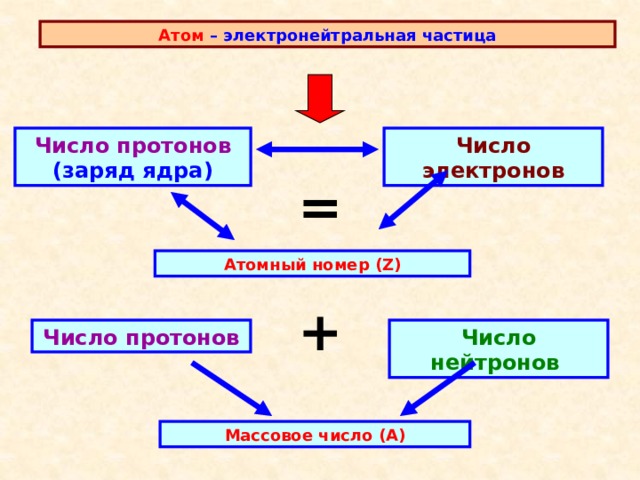
Атом – электронейтральная частица
Число протонов (заряд ядра)
Число электронов
=
Атомный номер (Z)
+
Число нейтронов
Число протонов
Массовое число (А)
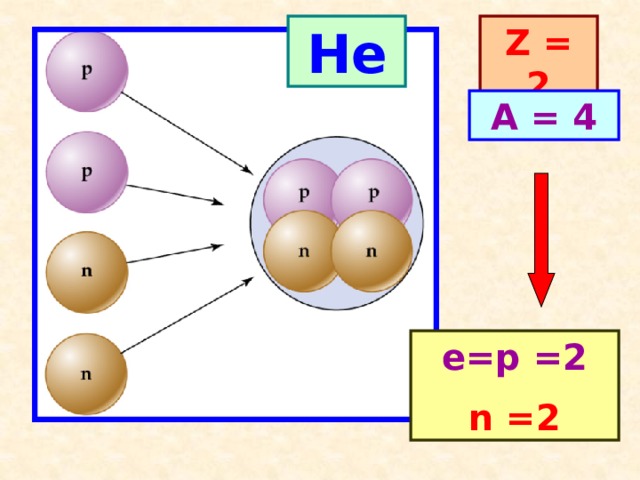
He
Z = 2
A = 4
е=p =2
n =2
Азот
Кислород
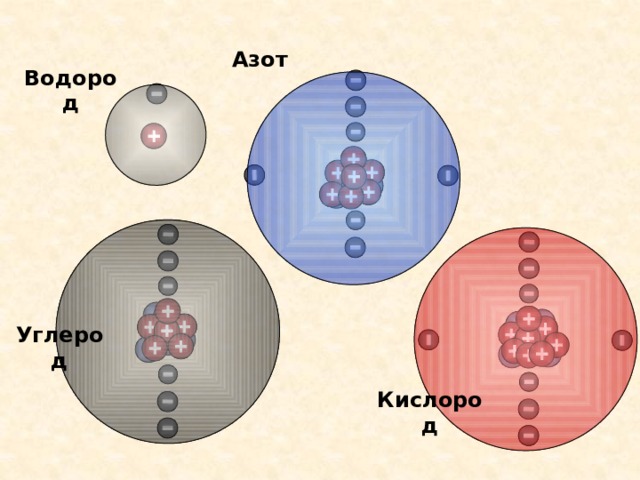
Азот
Водород
Углерод
Кислород
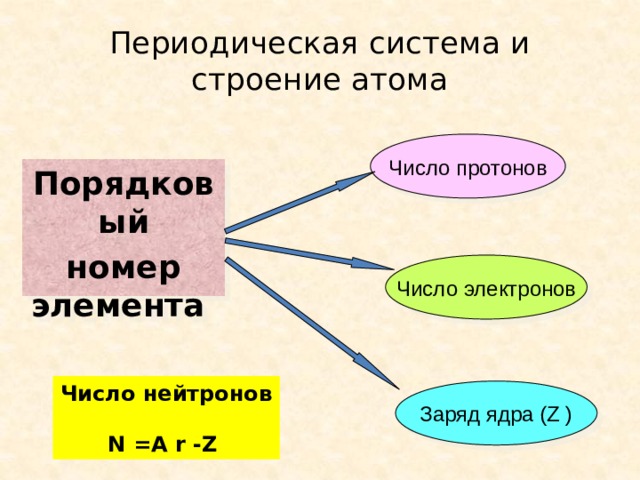
Периодическая система и строение атома
Число протонов
Порядковый
номер элемента
Число электронов
Число нейтронов
N =A r -Z
Заряд ядра (Z )

Современная формулировка Периодического закона
Свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от зарядов атомных ядер

Изотопы
- Это разновидности данного химического элемента, различающиеся по массе атомных ядер.
- Это разновидности атомов (и ядер ) одного химического элемента с разным количеством нейтронов в ядре.

История открытия изотопов
- Первое доказательство того, что вещества, имеющие одинаковое химическое поведение, могут иметь различные физические свойства, было получено при исследовании радиоактивных превращений атомов тяжёлых элементов. В 1906—07 выяснилось, что продукт радиоактивного распада урана — ионий и продукт радиоактивного распада тория — радиоторий , имеют те же химические свойства, что и торий, но отличаются от него атомной массой и характеристиками радиоактивного распада. Было обнаружено позднее, что у всех трёх продуктов одинаковы оптические и рентгеновские спектры.
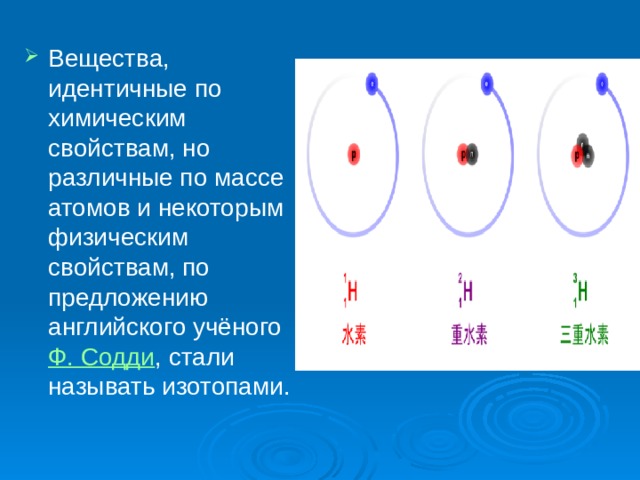
- Вещества, идентичные по химическим свойствам, но различные по массе атомов и некоторым физическим свойствам, по предложению английского учёного Ф. Содди , стали называть изотопами.

Изотопы водорода
- Водород встречается в виде трёх изотопов , которые имеют индивидуальные названия: 1H — протий (Н), 2Н — дейтерий (D), 3Н — тритий (T; радиоактивный).
- Протий и дейтерий являются стабильными изотопами с массовыми числами 1 и 2. Содержание их в природе соответственно составляет 99,98% и 0,01 %. Это соотношение может незначительно меняться в зависимости от источника и способа получения водорода..
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
-
- протон
+
- нейтрон
16
- электрон
+
+
+
+
+
+
+
+
18
+
+
+
+
+
+
+
+
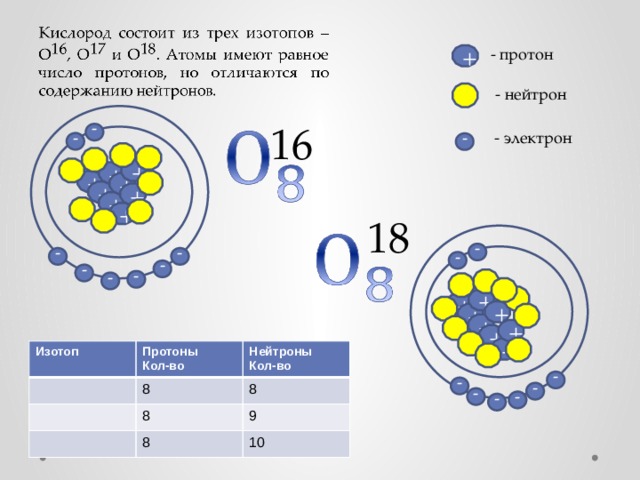
Изотоп
Протоны
Нейтроны
8
Кол-во
8
8
Кол-во
9
8
10

Изотопный состав веществ на примере воды (Н 2 O)
Концентрация изотопов кислорода в молекулах
воды различна
99.76%
Н 2 O
0.037%
0.203%

Изотопы - атомы одного химического элемента с одинаковыми зарядами ядер, но различными относительными атомными массами за счет разного числа нейтронов в ядре.
Относительная атомная масса показывает, во сколько раз масса атома химического элемента больше 1/12 массы атома углерода. Значения относительных атомных масс химических элементов запоминать не надо, они приведены в любом учебнике или справочнике по химии, а также в периодической таблице Д.И. Менделеева.
Порядковый номер элемента в таблице Д.И. Менделеева соответствует числу протонов в ядре атома.
Атом - мельчайшая частица вещества, состоящая из ядра и электронов.

Ядро - центральная часть атома, состоящая из протонов и нейтронов, в которой сосредоточена основная масса атома.
Протон - это элементарная частица, имеющая заряд +1 и относительную массу, равную единице.
Нейтрон - входящая в ядро атома частица, лишённая электрического заряда, имеющая относительную массу, равную единице.
Электрон - мельчайшая частица вещества с отрицательным электрическим зарядом е=1,6·10-19 кулона, принятым за элементарный электрический заряд (-1)
Среднее арифметическое - сумма всех зафиксированных значений, делённая на их количество.

Заполни таблицу
Р
p +
Mn
e -
Co
n 0
Au
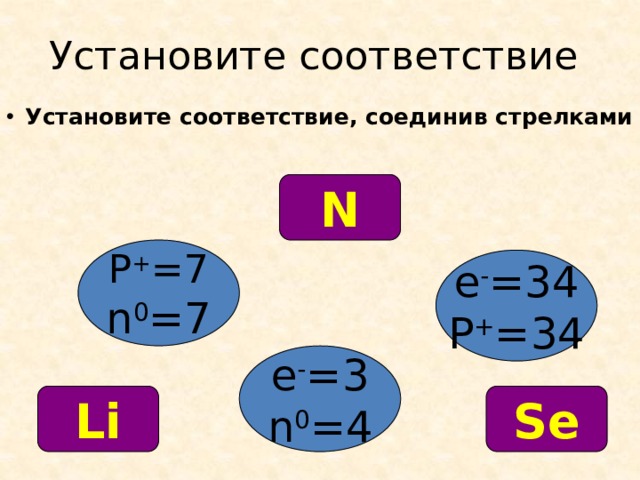
Установите соответствие
- Установите соответствие, соединив стрелками
N
P + =7
n 0 =7
e - =34
P + =34
e - =3
n 0 =4
Se
Li

Тестовые задания
- Заряд ядра атома азота равен :
- а) 7 б) 13 в) 4 г) 29 д) 11
- Число протонов в ядре атома криптона :
- а ) 36 б) 17 в) 4 г) 31 д) 6
- Число нейтронов в ядре атома цинка :
- а) 8 б) 35 в)11 г)30 д)4
- Число электронов в атоме железа :
- а) 11 б)8 в)56 г)26 д)30

Тестовые задания
- Заряд ядра атома азота равен :
- а) 7 б) 13 в) 4 г) 29 д) 11
- Число протонов в ядре атома криптона :
- а ) 36 б) 17 в) 4 г) 31 д) 6
- Число нейтронов в ядре атома цинка :
- а) 8 б) 35 в)11 г)30 д)4
- Число электронов в атоме железа :
- а) 11 б)8 в)56 г)26 д)30























































