Строение атома. Состав атомных ядер. Химический элемент – вид атома с одинаковым зарядом ядра.
- Организационный момент
Называется тема урока, обучающиеся определяют цели урока.
- Фронтальный опрос
Проводится фронтальный опрос обучающихся по ранее пройденному материалу:
- Сформулируйте периодический закон Д.И. Менделеева
- В порядке увеличения чего Менделеев расположил химические элементы?
- Как Менделеев назвал горизонтальные ряды в периодической таблице?
- Как изменяются свойства элементов в периодах?
- Из чего состоят все вещества?
- Что такое атом?
- Что такое относительная атомная масса?
- Изучение нового материала
- Прежде чем рассматривать строение атома познакомимся с таким явлением как радиоактивность. 1896 год Антуан Анри Беккерель обнаруживает, что уран (U) и урановые соединения излучают лучи, которые подобно рентгеновским лучам способны затемнять фотопластинку. Изучая соединения урана и урановые руды, ученые Мария Складовская-Кюри и Пьер Кюри обнаружили, что некоторые руды излучают такие же лучи, но с большей интенсивностью. В этих рудах ученые открыли два новых на тот момент элемента – радий Ra (названный в честь радиации) и полоний Po (названный в честь Польши). Эти же ученые ввели понятия радиоактивность.
Радиоактивность – это явление самопроизвольного распада элементов, испуская излучения.
При радиоактивном распаде выделяют три вида излучения:
- α-лучи – это поток ядер гелия
- β-лучи – это поток электронов
- γ-лучи – это электромагнитные излучения
Физкульт-минута: обучающиеся делают тренировку для глаз.
-
- Строение атома
- Одной из первый представлений строения атома является модель атома Томсона, согласно его модели в атоме положительный заряд распределен в некоторой небольшой области пространства сферической формы, тогда как электроны вкраплены в этот заряд, подобно изюму в пироге. Каждый электрон может совершать колебательные движения около своего положения равновесия. Положительный заряд равен по модулю отрицательному заряду электронов.
- Наиболее удачной стала модель строения атома Резерфорда. 1911 г. английский физик Эрнест Резерфорд доказал, что в центре атома имеется положительно заряженное ядро. Облучая золотую пластину потоком альфа-частиц он заметил, что большинство частиц проходили сквозь пластину, а некоторые отклонялись от своей траектории или возвращались назад. Изменить траекторию альфа-частиц мог только большой положительный заряд имеющий большую массу. Опираясь на результаты своих исследований Резерфорд заключил, что в центре находиться тяжелое положительно заряженное ядро, а отрицательно заряженные электроны вращаются вокруг ядра.
- Позднее было установлено, что ядро атома состоит из нуклонов: протонов (положительно заряженных частиц) и нейтронов (нейтральных частиц), которые имели практически одинаковую массу и принята считаться за 1 а.е.м. Поскольку основная масса атома сконцентрирована в ядре атома, то сумма протонов и нейтронов в ядре – это массовое число (Ar). Масса электронов не учитывается поскольку электрон легче протона и нейтрона в 1840 раз.
- Строение атома и его положение в периодической таблице:
- Экспериментально было установлено, что количество протонов в ядре атома равно порядковому номеру атома, и это количество протонов определяет заряд ядра атома (Z).
- Количество электронов в атоме всегда равно количеству протонов в ядре атома и порядковому номеру элемента.
- Поскольку сумма протонов и нейтронов это массовое число, то количество нейтронов определяется как разность между массовым числом (Ar) и зарядом ядра (порядковым номером элемента).
Теперь, после того как мы рассмотрели строение атома уточним что же такое химический элемент.
Химический элемент – это вид атомов с одинаковым зарядом ядра.
Однако следует помнить, что в атомах может отличаться количество нейтронов при одинаковом количестве протонов, в этом случае масса атомов одного химического элемента может отличаться, такие атомы называются изотопами.
Изотопы – атомы одного и того же химического элемента, имеющие одинаковое число протонов в ядре атома, но различное количество нейтронов.
- Закрепление изученного материала: проводиться небольшой опрос по пройденной теме.
- Что такое радиоактивность?
- Чему равно количество протонов в атоме элемента?
- Что такое массовое число?
- Как определить количество нейтронов в атоме элемента?
- Где находятся электроны в атоме?
- Что такое изотопы?
- Что такое химический элемент?
- Постановка домашнего задания: §52 упр.1-3 выполнить письменно.
- Подведение итогов урока: подводятся итоги урока, выставляются отметки обучающимся за работу на уроке.
Просмотр содержимого документа
«Строение атома. Состав атомных ядер. Химический элемент – вид атома с одинаковым зарядом ядра.»

Строение атома. Состав атомных ядер. Изотопы. Химический элемент.

Опрос:
- Сформулируйте периодический закон Д.И. Менделеева.
- В порядке увеличения чего Менделеев располагал химические элементы?
- Как Менделеев назвал горизонтальные ряды в периодической таблице?
- Как изменяются свойства элементов в периодах?
- Из чего состоят все вещества?
- Что такое атом?
- Что такое относительная атомная масса?
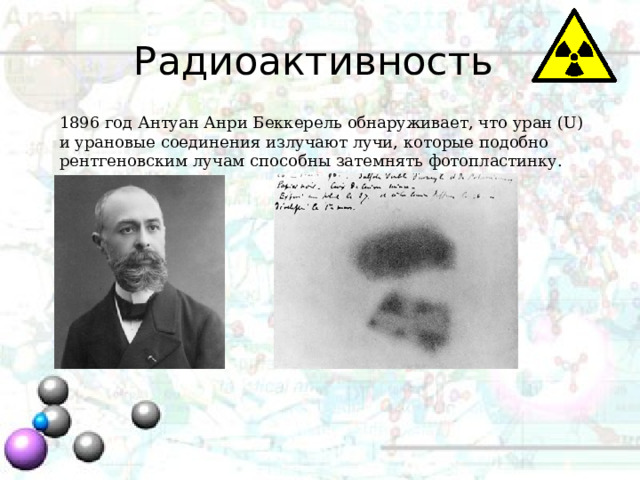
Радиоактивность
1896 год Антуан Анри Беккерель обнаруживает, что уран (U) и урановые соединения излучают лучи, которые подобно рентгеновским лучам способны затемнять фотопластинку.

Радиоактивность
Изучая соединения урана и урановые руды, ученые Мария Складовская-Кюри и Пьер Кюри обнаружили, что некоторые руды излучают такие же лучи, но с большей интенсивностью. В этих рудах ученые открыли два новых на тот момент элемента – радий Ra (названный в честь радиации) и полоний Po (названный в честь Польши). Эти же ученые ввели понятия радиоактивность.
Радиоактивность – это явление самопроизвольного распада элементов, испуская излучения.
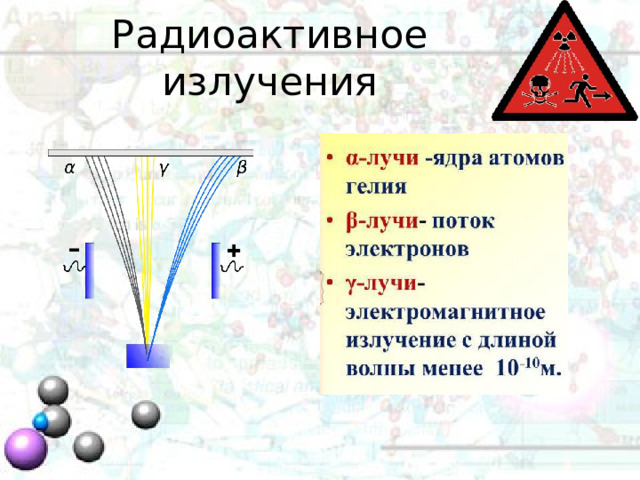
Радиоактивное излучения

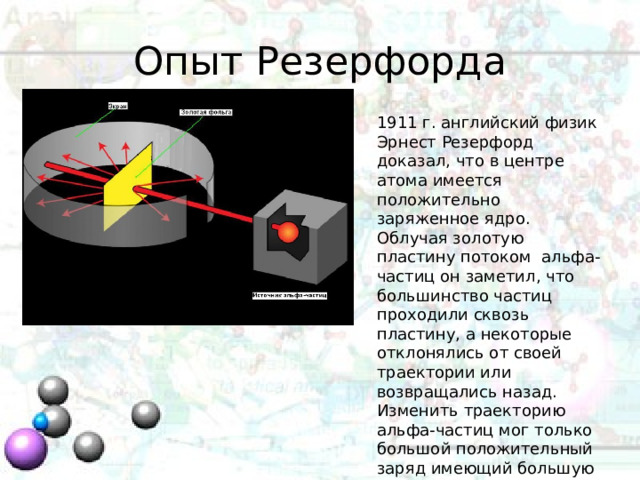
Опыт Резерфорда
1911 г. английский физик Эрнест Резерфорд доказал, что в центре атома имеется положительно заряженное ядро. Облучая золотую пластину потоком альфа-частиц он заметил, что большинство частиц проходили сквозь пластину, а некоторые отклонялись от своей траектории или возвращались назад. Изменить траекторию альфа-частиц мог только большой положительный заряд имеющий большую массу.

Планетарная модель строения атома
Опираясь на результаты своих исследований Резерфорд заключил, что в центре находиться тяжелое положительно заряженное ядро, а отрицательно заряженные электроны вращаются вокруг ядра.

Состав атомного ядра
Позднее было установлено, что ядро атома состоит из нуклонов: протонов (положительно заряженных частиц) и нейтронов (нейтральных частиц), которые имели практически одинаковую массу и принята считаться за 1 а.е.м.
Поскольку основная масса атома сконцентрирована в ядре атома, то сумма протонов и нейтронов в ядре – это массовое число (Ar). Масса электронов не учитывается поскольку электрон легче протона и нейтрона в 1840 раз.
Название частицы
Обозначение частицы
Протон
Нейтрон
Электрический заряд
p +
Приблизительная масса (в атомных единицах массы)
Электрон
+1
n 0
0
1
e -
1
-1
1/1840

Строение атома и его положение в периодической таблице
- Экспериментально было установлено, что количество протонов в ядре атома равно порядковому номеру атома, и это количество протонов определяет заряд ядра атома (Z).
- Количество электронов в атоме всегда равно количеству протонов в ядре атома и порядковому номеру элемента.
- Поскольку сумма протонов и нейтронов это массовое число, то количество нейтронов определяется как разность между массовым числом (Ar) и зарядом ядра (порядковым номером элемента).
- Например:
p + = 9
n 0 =19-9=10
e - =9
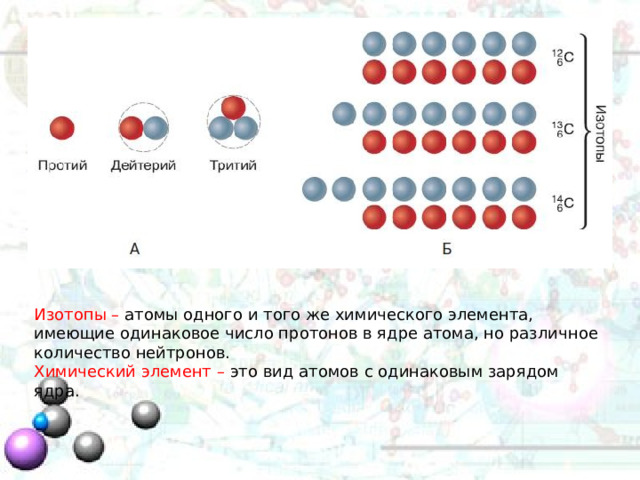
Изотопы – атомы одного и того же химического элемента, имеющие одинаковое число протонов в ядре атома, но различное количество нейтронов.
Химический элемент – это вид атомов с одинаковым зарядом ядра.

Ответь на вопрос
- Что такое радиоактивность?
- Чему равно количество протонов в атоме элемента?
- Что такое массовое число?
- Как определить количество нейтронов в атоме элемента?
- Где находятся электроны в атоме?
- Что такое изотопы?
- Что такое химический элемент?

Домашнее задание
- §52 упр.1-3 выполнить письменно.





























