

Проверка знаний
Письменно
Устно
- Что такое электронная оболочка?
- Как определить количество энергетических уровней у элемента по периодической системе?
- Какая формула расчета максимального количества электронов на энергетическом уровне?
- Как по периодической системе определить количество электронов у электронейтрального атома химического элемента?
- Как определить количество электронов на последнем уровне у элемента по периодической системе?
2

Проверка знаний
Письменно
Устно
Нарисуйте схемы строения электронных оболочек атомов:
- Лития Магния Аргона Фтора Серы
- Лития Магния Аргона Фтора Серы
- Лития Магния Аргона Фтора Серы
- Лития Магния Аргона Фтора Серы
- Лития
- Магния
- Аргона
- Фтора
- Серы
0
0
0
40
7
24
Li
Ar
Mg
+ 18
+ 12
+ 3
2
2
2
8
1
8
2
8
0
32
S
0
19
F
+ 16
+ 9
2
8
6
2
7
Далее:
Проверка:
3

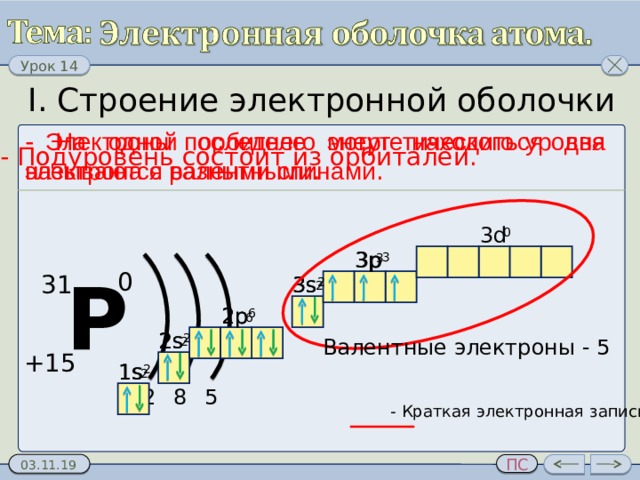
I. Строение электронной оболочки
- Подуровень состоит из орбиталей.
- Энергетический уровень состоит из подуровней.
Первый уровень
s – подуровень
1 s
2
Второй уровень
Р
0
31
2 s
s – подуровень
2р
р – подуровень
8
+15
Третий уровень
8
5
2
s – подуровень
3 s
5
2
8
3р
р – подуровень
5
3 d
d – подуровень
4
I. Строение электронной оболочки
- Электроны последнего энергетического уровня называются валентными .
- На одной орбителе могут находиться два электрона с разными спинами .
- Подуровень состоит из орбиталей.
0
3d
3 р 3
3p
3
Р
0
31
3 s 2
3s
2
2р 6
2p
6
2s
2 s 2
2
Валентные электроны - 5
+15
1 s 2
1 s
2
5
8
2
- Краткая электронная запись.
5
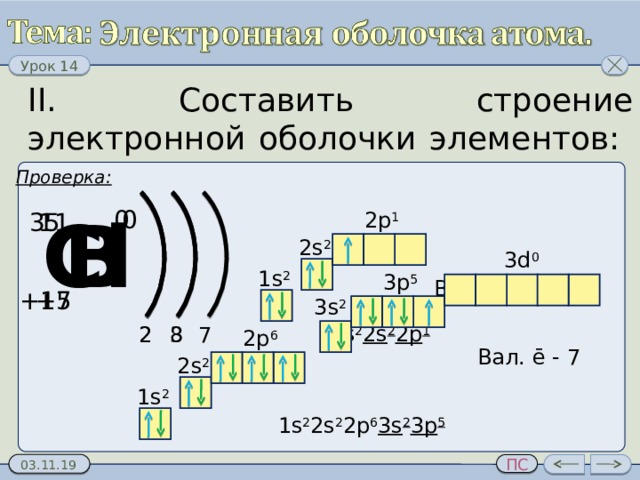
II. Составить строение электронной оболочки элементов: В, Cl.
Проверка:
В
С l
0
0
2p 1
11
35
2s 2
3d 0
1 s 2
3p 5
Вал. ē - 3
+ 17
+5
3s 2
1 s 2 2s 2 2p 1
7
3
8
2
2
2p 6
Вал. ē - 7
2s 2
1 s 2
1 s 2 2s 2 2p 6 3s 2 3p 5
6

Домашняя работа
Параграф 9, задания 1,2,4,5.
6



































