Муниципальное бюджетное образовательное учреждение
«Локотская средняя общеобразовательная школа»
Рыльского района, Курской области
Сценарий урока по химии для 8 класса
по теме: «Кислоты»
по программе Г. Е. Рудзитиса, Ф. Г. Фельдмана
Разработана
Коськовой Тамарой Алексеевной,
учителем биологии и химии первой
квалификационной категории
с.Локоть 2020 г
Тема урока: «Кислоты»
Цель урока: сформировать представления учащихся о кислотах как классе неорганических соединений.
Тип урока: комбинированный
Деятельностная цель:
- формулировать цель учебной деятельности;
- развивать умение находить общее, отличное (формирует основы теоретического мышления), умение находить достоверную информацию в учебнике, анализировать, определять понятия, делать выводы;
- осуществлять самооценку собственной учебной деятельности на уроке, меру своего продвижения к цели.
Предметно - дидактическая цель: расширить базу химических понятий при изучении кислот
Планируемые образовательные результаты:
Предметные:
- изучить состав, строение, классификацию и свойства кислот
- научить определять принадлежность веществ к определенному классу
- научить составлять формулы кислот
Метапредметные:
1.Познавательные:
–находить в учебниках и других источниках достоверную информацию, необходимую для решения учебных и жизненных задач;
- владеть смысловым чтением;
- анализировать и обобщать, доказывать, делать выводы, строить логически обоснованные рассуждения;
2.Коммуникативные:
- уметь общаться
- проявление уважительного отношения к партнерам, внимания к личности другого, адекватного восприятия
- вступают в учебный диалог с учителем, участвуют в общей беседе, соблюдая правила речевого поведения.
3.Регулятивные:
- научить обучающихся ставить цель
- проведение необходимого действия самостоятельно, самоконтроль и самооценка достигнутого результата
Личностные:
- осознавать свои эмоции, адекватно выражать их и контролировать;
- выбирать, как поступить, в том числе, в неоднозначных ситуациях и отвечать за свой выбор
Основное содержание темы, термины и понятия: кислоты, кислотный остаток, кислородсодержащие и бескислородные кислоты, основность, одноосновные двухосновные и трехосновные кислоты
Оборудование:
лимон, яблоки, уксусная эссенция
компьютер, проектор.
учебник Г. Е. Рудзитис «Химия. Неорганическая химия. 8 класс» М.: Просвещение, 2014; А. М. Радецкий «Дидактический материал. Химия 8-9» М.: Просвещение, 2012.
Ход урока.
Организационный момент
Учитель. Добрый день. Ребята, я очень рада вас видеть, рада нашей встрече. Надеюсь, что сегодняшний урок доставит нам удовольствие.
В качестве эпиграфа к нашему уроку я предлагаю послушать высказывание таджикского и персидского поэта Рудаки, жившего еще в средние века ( около 830- 941 гг)
С тех пор как существует мирозданье,
Такого нет, кто б не нуждался в знанье.
Какой мы не возьмем язык и век –
Всегда стремился к знанью человек.
Надеюсь, вы всегда стремились, стремитесь и будите стремиться к новым знаниям
Я хочу познакомить вас с планом урока.
1 Сначала мы вместе восхитимся вашими глубокими знаниями, а для этого вытащим из тайников вашей памяти кое-что ценное — проведем небольшой опрос по теме «Амфотерные оксиды и гидроксиды», вспомним названия и химические свойства оксидов и гидроксидов.
2. Потом попробуем ответить на удивительный вопрос. Что общего между лимоном, яблоком, уксусной эссенцией?
3. Затем продемонстрируем свое умение извлекать нужную информацию при чтении параграфа — смысловое чтение.
4. И, наконец, продемонстрируем свое умение в названии химических соединений, в распределении веществ по классам.
Итак, осуществляем наш план.
2. Этап проверки домашнего задания
Учитель. Вспоминаем материал прошлых уроков и показываем наши знания.
Мы изучаем основные классы неорганических соединений. Что же мы с вами уже знаем?
Загадки:
1. Если в паре элементов
Кислород вторым стоит,
Ты же знаешь, эта пара
Называется … (оксид)
2. Если формулы начало
Представляется с металла,
ОН – красуется затем,
Вещества знакомы всем.
Не надо придумывать им название,
Ведь эти вещества…(основания)
Итак, какие соединения химических элементов мы изучили?
( класс оксиды и класс основания).
Дайте определение этих классов веществ.
Ответ учащегося: Оксид – это сложное вещество, которое состоит из двух элементов, одним из которых является кислород.
Ответ учащегося: Основание – это сложное вещество, в состав которого входит атом металла, соединенный с одной или несколькими гидроксогруппами (ОН)
Учитель. Чем отличается оксид CaO от ZnO? Подтвердите свой ответ уравнениями.
Ответ учащегося. Оксид цинка является амфотерным оксидом. Он реагирует как с кислотами, так и с основаниями.
ZnO +2HCI =ZnCI2+H2O
ZnO +2NaOH+H2O= Na2[Zn(OH)4]
Учитель. На доске приведите доказательства с помощью уравнений реакций амфотерности гидроксида цинка.
Ответ учащегося.
Zn(OH)2+2HCI= ZnCI2+H2O
Zn(OH)2+2NaOH= Na2[Zn(OH)4]
Учитель. А сейчас выполните письменные задания. Я вам раздам карточки с заданием и бланки ответов.
1.Установите соответствие между реагирующими веществами и продуктами их взаимодействия
| Реагирующие вещества | Продукты взаимодействия |
| А) K2O +H2O = | 1) Na2CO3 |
| Б) Fe(OH)3 = | 2) Cu(OH)2 + 2NaCI |
| В) Na2O + CO2 = | 3) KOH |
| Г)CuCI2 + NaOH = | 4) Fe2O3 + 3H2O |
Предполагаемый ответ учащихся.
Установите соответствие между реагирующими веществами и продуктами их взаимодействия
| Реагирующие вещества | Продукты взаимодействия |
| А) K2O +H2O = | 1) KOH |
| Б) Fe(OH)3 = | 2) Fe2O3 + 3H2O |
| В) Na2O + CO2 = | 3) Na2CO3 |
| Г)CuCI2 + NaOH = | 4) Cu(OH)2 + 2NaCI |
3. Актуализация знаний.
Учитель: на магнитной доске прикреплены карточки с формулами веществ. Сидящие на 1 варианте выбирают формулы оксидов и дают их название. Учащиеся 2 варианта выбирают формулы оснований и также называют их.
Вариант 1 HCl NaOH CuO P2O5 HNO3
Вариант 2 CaO KOH Al(OH)3 H2SO4 H3PO4
Ответы учащихся:
1. CuO – оксид меди
P2O5 – оксид фосфора
CaO – оксид кальция
2. NaOH – гидроксид натрия
KOH – гидроксид калия
Al(OH)3 – гидроксид алюминия (III)
Учитель: Молодцы. Справились с заданием. Посмотрите на оставшиеся карточки
HCl HNO3 H2SO4 H3PO4
Что общего у этих веществ?
Ответ учащегося: Все оставшиеся вещества начинаются с атома водорода.
Учитель: Внимательно посмотрите на продукты (Лимон, яблоки, уксусная эссенция) и скажите, что общего у них? ( кислый вкус)
Яблоко ешь – кислый вкус, красота,
В яблоке – яблочная кислота.
Есть в муравьях и крапиве невинная,
С пользой для нас кислота муравьиная.
4. Определение темы и цели урока.
Учитель: Как вы думаете, о каких веществах мы будем сегодня говорить? ---- (о кислотах)
Мы нашли название группы веществ 3 класса. Какова будет тема урока?
Ответы учащихся: Кислоты.
Учитель Тема урока. Кислоты
Учитель: Давайте вместе поставим цели нашего урока
- выяснить классификацию, номенклатуру и свойства кислот
Учитель: Каких знаний нам не хватает, чтобы достичь цели?
Ответы учащихся: Не знаем, какие вещества называются кислотами и какими свойствами они обладают.
5. Изучение нового материала.
Что мы уже знаем о них? ( кислые)
А что нам не известно?
1.Состав
2. Классификация
3. Свойства
4. Получение
Слова "кислота" и "кислый" не зря имеют общий корень. Растворы всех кислот на вкус кислые. Это не означает, что раствор любой кислоты можно пробовать на язык – среди них встречаются очень едкие и даже ядовитые. Но такие кислоты как уксусная (содержится в столовом уксусе), яблочная, лимонная, аскорбиновая (витамин С), щавелевая и некоторые другие (эти кислоты содержатся в растениях) знакомы вам именно своим кислым вкусом.
На этом уроке мы познакомимся только с важнейшими неорганическими кислотами, то есть с такими, которые не синтезируются живыми организмами, но играют большую роль в химии и химической промышленности.
Определение кислот
Посмотрите на эти формулы.
HCl H2SO4 H3PO4 H2SO4
Если в них мысленно убрать атомы водорода, то что останется, будет называться кислотным остатком, который, как правило, образован элементами неметаллами.
Давайте вместе дадим определение кислот, посмотрев на формулы Кислоты – это сложные вещества, состоящие из атомов водорода (которые могут замещаться на атомы металлов) и кислотных остатков.
Валентность кислотного остатка определяется числом атомов водорода в молекуле кислоты.
Определите валентность кислотных остатков в молекулах кислот:
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
Проверим себя.
II II I II III
H2SO4; H2CO3; HNO3; H2SiO3; H3PO4
Составьте формулы кислот по известным кислотным остаткам: Cl (I), S(II), PO4(III), SO4(II), NO3(I).
Проверим.
HCl, H2S, H3PO4, H2SO4, HNO3
Перед нами проблема: как назвать кислоты?
Работа с учебником. Стр. 150 таблица 11.
HCl хлороводородная(соляная)кислота
HNO3 азотная кислота
H2SO4 серная кислота
H2CO3 угольная кислота
H3PO4 фосфорная кислота
Традиционная номенклатура кислот
Бескислородные кислоты. К названию элемента, который образует кислоту, добавляют соединительную гласную «о» и слова «…водородная кислота».
HF –фтороводородная кислота
H2S – сероводородная кислота
Кислородсодержащие кислоты складывается из двух слов: к названию элемента, выраженного прилагательным, прибавить слова – кислота. Например, серная кислота (H2SO4), азотная кислота (HNO3).
Классификация кислот.
Учитель: Внимание на экран. Перед вами схема
Классификация кислот
а)

 Кислоты
Кислоты

одноосновные двухосновные трехосновные
НNО3; НСI Н2SО4; Н2СО3 Н3РО4
Учитель: По какому признаку данные кислоты разделены на три группы на этой схеме ?
Учащиеся: По числу атомов водорода делятся на одно-, двух- и трехосновные
Учитель: Ребята, посмотрите на схему б) и скажите, по какому признаку данные кислоты разделены на две группы?
Учащиеся: Наличие и отсутствие кислорода.
По составу кислоты делятся на кислородсодержащие и бескислородные
б)

 Кислоты
Кислоты
бескислородные кислородосодержащие
НСI; Н2S НNО3; Н2СО3
Работа с учебником. стр 151.
Способы получения кислот. Запишите в тетрадь
1) Из неметаллов и водорода с последующим растворением образовавшегося газа в воде:
Cl2 + H2  2HCl
2HCl
2) При действии сильных кислот на соли более слабых или летучих бескислородных кислот:
2NaCl + H2SО4 = Na2 SО4 + 2НСI
3) Взаимодействием кислотного оксида и воды.
SO2 + H2O  H2SO3.
H2SO3.
Учитель. Структурные формулы кислот
При составлении структурных формул бескислородных кислот следует учитывать, что в молекулах этих кислот атомы водорода связаны с атомом неметалла:

При составлении структурных формул кислородсодержащих кислот нужно помнить, что водород с центральным атомом связан посредством атомов кислорода. Для составления структурных формул кислородсодержащих кислот пользуются следующим принципом (для примера взяты H2S+6O4 и H3P+5O4):
1. Пишут один под другим атомы водорода данной кислоты. Затем через атомы кислорода черточками связывают их с центральным атомом:

2. К центральному атому (с учетом валентности) присоединяют остальные атомы кислорода:

Из примера видно, что оставшиеся кислороды присоединились с помощью двойной связи (двумя черточками). Однако, например, структурную формулу азотной кислоты HNO3 таким образом составить невозможно. Это связано с тем, что, несмотря на степень окисления +5, азот имеет валентность IV (пятивалентного азота не бывает). Структурная формула азотной кислоты будет выглядеть следующим образом:
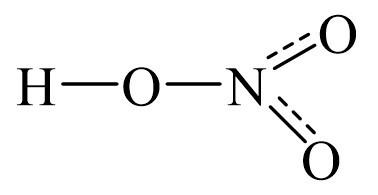
Работа с учебником. Стр 151 учебника. Прочитайте физические свойства кислот .
Кислоты – вещества, которые обладают определёнными физическими свойствами.
Какими?
Ответ учащегося: Все кислоты жидкие, не имеют цвета.
Действительно. Все кислоты жидкие. Но известны и твердые кислоты: фосфорная, борная. Почти все растворимы в воде.
5.Этап контроля и самоконтроля
Внимание на экран
Из списка веществ выпишите формулы кислот и дайте им названия.
Распределите химические формулы кислот в предложенную таблицу.
LiOH, Fe(OH)3, Na2O, HCl , H2SO4 , HNO3 , Ca(OH)2, , Zn(OH)2, H3PO4 , H2CO3 , Fe 2O3
| Бескисло- родные | Кислород- содержащие | одно- основные | двух-основные | трёх-основные |
|
|
|
|
|
|
6. Домашнее задание
Пар. 44, выучить названия кислот, упр. №1, стр 152
7. Подведение итогов урока.
Я довольна вами, вы порадовали меня своими ответами.
-Ребята! Давайте мы попробуем с вами оценить каждый свою работу за урок. Поднимите руку, кто поставил себе 5? А кто -3?
Оценки прокомментировать
8. Рефлексия.
- Какова была цель урока?
- Как вы считаете, достигли мы этой цели?
Закончим урок словами арабской пословицы:
Ни один сосуд не вмещает больше своего объема,
кроме сосуда знаний; он постоянно расширяется.
Какими же знаниями пополнился наш сосуд?
- Что запомнили?
(Кислоты – жидкости, без цвета, запаха, обладают кислым вкусом.
Лакмус – в кислой среде краснеет)
- Что поняли?
(Кислоты приносят пользу, но и могут оказывать вред)
- Чему научились?
(Различать формулы кислот, определять валентность кислотного остатка, составлять структурные формулы кислот)
Молодцы!
-Спасибо за урок!
Приложение.
1. Установите соответствие между реагирующими веществами и продуктами их взаимодействия
Закрепление.
2. Из списка веществ выпишите формулы кислот и дайте им названия.
Распределите химические формулы кислот в предложенную таблицу.
| Бескисло- родные | Кислород- содержащие | одно- основные | двух-основные | трёх-основные |
|
|
|
|
|
|










 Кислоты
Кислоты











