
Сценарий электронного урока на тему «Кислород как химический элемент и простое вещество» по предмету: химия класс: 8


Структура урока
- Мотивационный этап (1-2 мин)
- Актуализация знаний и умений (2-3 мин)
- Изучение нового материала (18-25 мин)
- Закрепление изученного материала( усвоения изученного материала (8-13 мин)
- Рефлексия учебной деятельности (2 мин)
Здравствуй!
Сегодня мы с тобой познакомимся с одним очень интересным химическим элементом. Но я тебе не назову его, а загадаю загадку:
.

Отгадай загадку
В чем горят дрова и газ, Фосфор, водород, алмаз? Дышит чем любой из нас Каждый миг, и каждый час? Без чего мертва природа? Правильно, без…
кислорода

Итак, сегодня речь пойдет о кислороде. Для начала я приготовила тебе небольшую историческую справку о том, когда появились первые упоминания о кислороде.

Историческая справка
Многие ученые прошлого догадывались, что существует вещество со свойствами, присущими кислороду. Сведения о нем – косвенные, разумеется,- есть в трактате китайского алхимика Мао Хао (VIII в.). Китайцы знали «деятельное начало», входящее в состав воздуха, и называли его «йын». В XV в. следы кислорода можно обнаружить в трудах Леонардо да Винчи. Потом снова теряются - до XVII в., когда голландец Дреббель изобретает подводную лодку. Он использует селитру, чтобы получив из нее кислород обогатить им воздух в подводной лодке. Но этот факт остался незамеченным. В 1758 году М.В.Ломоносов на основании своих опытов доказал, что в состав воздуха входит вещество, окисляющее металл. Сегодня известно, что речь шла о кислороде.

Открытие кислорода связано с именами Д. Пристли, К. Шееле и А. Лавуазье. Рассмотрим подробнее фамилии этих ученых. Д.Пристли смог получить кислород в своей лаборатории. Тебе интересно, как он относился к данному явлению? Тогда я тебе расскажу об этом.

Из личных записей Джозефа Пристли
«1 августа 1774 г я попытался извлечь воздух из ртутной окалины (оксида ртути) и нашел, что воздух легко может быть изгнан из нее посредством линзы. Этот воздух не поглощался водой. Каково же было мое изумление, когда я обнаружил, что свеча горит в этом воздухе необычайно ярким пламенем. Тщетно пытался я найти объяснение этому явлению».
2HgO → 2Hg + O 2 ↑
Полгода спустя Д. Пристли осуществил опыт с мышами. Он поместил одну мышь в сосуд с кислородом, а другую - в такой же сосуд с воздухом, и обнаружил, что в кислороде мыши живут дольше, чем в воздухе. Затем он сам пробовал дышать полученным газом и убедился, что дышится чрезвычайно им «свободно и легко».

Но интересно, что одновременно с Пристли кислород открыл и шведский ученый Карл Шееле. Шееле даже получил его раньше, чем Пристли, но сообщение об этом было опубликовано позже, чем открытие Пристли. И все-таки главная фигура в истории открытия кислорода – не Шееле и не Пристли. Тебе интересно, кто это? Тогда читай дальше.

Открытие кислорода
Собственно открывшим кислород остается французский химик Антуан Лавуазье. В 1775 году он исследовал кислород и создал кислородную теорию горения, которая пришла на смену теории флогистона (теория огненной материи). За два века, прошедшие со времени открытия, теория Лавуазье не только не была опровергнута, но еще более укрепилась. Лавуазье дал название кислороду oxygenium – рождающий кислоту.

Ну теперь давай попробуем охарактеризовать положение химического элемента кислорода в таблице Менделеева

В каком периоде находится кислород?
второй
Верно! Ты получаешь 1 балл.
Или
Подумай еще!

В какой группе находится кислород?
шестой
Верно! Ты получаешь 1 балл.
Или
Подумай еще!

Какой порядковый номер у кислорода?
8
Верно! Ты получаешь 1 балл.
Или
Подумай еще!

Чему равна относительная атомная масса кислорода?
16
Верно! Ты получаешь 1 балл.
Или
Подумай еще!

Чему равна валентность кислорода?
II
Верно! Ты получаешь 1 балл.
Или
Подумай еще!

Как ты думаешь, кислород – это металл или неметалл?
неметалл
Верно! Ты получаешь 1 балл.
Или
Подумай еще!

Молодец, ты неплохо справился с заданиями. Далее я тебе расскажу о том, какие простые вещества образует химический элемент кислород.

Аллотропные модификации кислорода
В природе кислород образует два простых вещества
- кислород с формулой О 2 . Сжижается, если его охладить до температуры -183С 0 при н.у. Если снизить температуру до -218,8С 0 , то жидкий кислород превратится в красивые синие кристаллы.
О 2 ;
О=О;
М (О 2 ) = 32 г/моль;
Малорастворим в воде;
- 187 ○ С -218, 7 ○ С
→ →
↑ ; без цвета, жидкость кристаллы синего
вкуса и запаха бледно-синего цвета
цвета

Аллотропные модификации кислорода
В природе кислород образует два простых вещества
- озон с формулой О 3 . Он образуется во время грозы при прохождении разрядов молнии через слои воздуха. Он образуется из молекулярного кислорода. При нормальных условиях это газ, голубоватого цвета с запахом свежести. Он образует озоновый слой нашей планеты. З ащищает от ультрафиолетовых лучей.
3 O 2 = 2 O 3
М (О 3 ) = 48 г/моль
При н.у. – газ синеватого цвета
Лучше растворим в воде
В природе образуется после грозы
Максимальная концентрация в атмосфере - на высоте 20-25 км.

Ты знаешь, кислород самый распространенный элемент на земле!
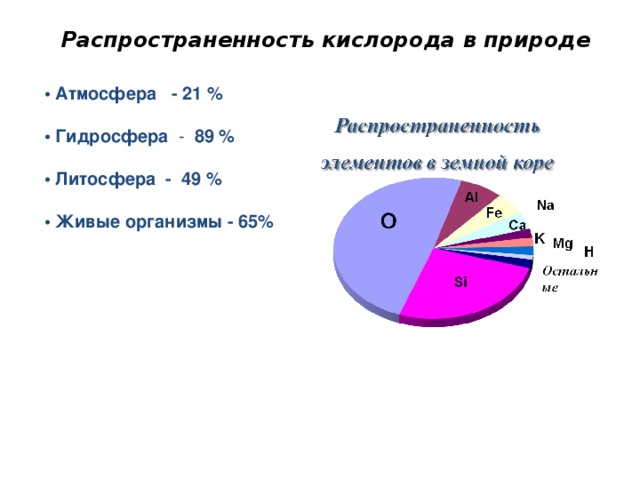
Распространенность кислорода в природе
• Атмосфера - 21 %
• Гидросфера - 89 %
• Литосфера - 49 %
• Живые организмы - 65%
Кислород всегда окружает тебя! Но знаешь, его можно получить и в лаборатории. Далее я расскажу тебе именно об этом!

Способы получения кислорода
- Разложение сложных веществ
- Разложение воды электрическим током
- Разделение воздуха на составные части
Теперь я подробно расскажу тебе о каждом способе отдельно.

Получение кислорода в лаборатории
Разложение перманганата калия
2KMnO 4 = K 2 MnO 4 + MnO 2 + O 2 ↑

Таким образом, при нагревании перманганат калия разлагается с выделением свободного кислорода. Далее подумай и ответь на следующий вопрос

Как надо держать пробирку (вверх дном или вниз дном), чтобы собрать кислород методом вытеснения воздуха?
Вниз дном

Верно! Надо пробирку держать вниз дном, так как кислород тяжелее воздуха. Ты получаешь еще один балл в свою копилку!
ИЛИ
Очень жаль, но ты ошибся .

Кислород также можно собрать методом вытеснения воды. Как ты думаешь, о каком свойстве кислорода здесь можно судить?
Растворимость в воде

Верно! Кислород очень плохо растворяется в воде! Ты получаешь еще один балл в свою копилку!
ИЛИ
Очень жаль, но ты ошибся .

Давай двигаться дальше, мой друг!

Получение кислорода в лаборатории
Разложение пероксида водорода
MnO 2
2Н 2 О 2 = 2Н 2 О + О 2 ↑
Вещество, указанное на знаком равенства, является катализатором.
Катализатор – это вещество, которое ускоряет химическую реакцию, но сам при этом не расходуется.
Собранный кислород можно обнаружить тлеющей лучинкой: она разгорится, так как кислород поддерживает горение.

Я, думаю, ты знал о том, что кислород поддерживает горение. И участвует в нашем дыхании. Я права?!

Получение кислорода в лаборатории
В присутствии все того же катализатора (оксид марганца IV) при сильном нагревании до 400 градусов разлагается бертолетова соль (хлорат калия) с выделением кислорода.
Разложение бертолетовой соли
2KClO 3 = 2KCl + 3O 2 ↑

Получение кислорода в лаборатории
Кислород также можно получить разложением воды под действием электрического тока (электролиз воды):
Электролиз воды
2 Н 2 О = 2 Н 2 + O 2 ↑

Помнишь, чуть ранее я тебе говорила, что кислород поддерживает горение. То есть вещества горят в атмосфере кислорода. Давай разберемся с этим.

Химические свойства кислорода
Для кислорода характерны реакции горения. Реакции горения - это такие реакции, при которых происходит окисление веществ с выделением теплоты и света. Можно также назвать реакции с кислородом реакциями окисления. Давай посмотрим конкретные примеры взаимодействия различных веществ, то есть их горение и окисление.
Горение угля
С + O 2 = С O 2
Полученное вещество называется оксидом. Оксиды – это сложные вещества, состоящие из двух элементов, один из которых кислород.

Химические свойства кислорода
С + О 2 = СО 2
Для того, чтобы записать формулу продукта реакции, вспомним валентности этих элементов по таблице Менделеева. Уравняем реакцию. Полученное вещество называется углекислый газ. Но у этого вещества есть еще одно название. Посмотри, это сложное вещество. Оно состоит из двух химических элементов. Один из которых кислород. Значит это оксид.

Но как правильно назвать этот оксид? Ты еще не догадался? Тогда я тебе помогу!

Номенклатура оксидов
Слово Название Указание валентности (в скобках)
«оксид» + элемента + для тех случаев, когда элемент
в р.п. имеет переменную валентность
Например: СаО – оксид кальция, Hg О – оксид ртути ( II )

В таком случае, как называется наше исходное вещество СО 2 ?
Оксид углерода ( IV)

Молодец!!! Правильно! Ты получаешь еще один балл!
Или
Подумай еще, ответ не верен.

Химические свойства кислорода
С кислородом взаимодействуют не только неметаллы, но и простые вещества-металлы:
2Mg + О 2 = 2MgO

Как называется полученное вещество MgO ?
Оксид магния

Молодец!!! Правильно! Ты получаешь еще один балл!
Или
Подумай еще, ответ не верен.

Сделаем общие выводы:
-в реакцию взаимодействия с кислородом вступают простые вещества (металлы и неметаллы)
- одно из обязательных условий – предварительное нагревание
-интенсивность горения резко увеличивается в атмосфере кислорода
-все реакции взаимодействия кислорода с простыми веществами относятся к реакциям соединения
- сложные вещества, состоящие из двух элементов, один из которых кислород, называются оксидами.
- все реакции окисления являются экзотермическими, то есть идут с выделением тепла.

Химические свойства кислорода
Кислород также взаимодействует со сложными веществами. Например, с метаном, входящим в состав природного газа. Запишем уравнение реакции:
СН 4 + 2О 2 = СО 2 + 2Н 2 О
Это экзотермическая реакция.
Итак, мы добрались до применения кислорода. Обрати внимание, как широка область его применения.

Применение кислорода
- Находит широкое применение в медицине и промышленности.
- При высотных полётах лётчиков снабжают специальными приборами с кислородом.
- При многих лёгочных и сердечных заболеваниях, а также при операциях дают вдыхать кислород из кислородных подушек.
- Кислородом в баллонах снабжают подводные лодки.
- Горение рыхлого горючего материала, пропитанного жидким кислородом, сопровождается взрывом, что даёт возможность применять кислород при взрывных работах.
- Жидкий кислород применяют в реактивных двигателях, в автогенной сварке и резке металлов, даже под водой.

Ты сегодня узнал многое о кислороде. Давай закрепим полученные знания. Попробуй ответить на предложенные вопросы и выполни задания.

В ряду формул веществ выберите оксиды:
CS 2 MgO PH 3 SO 3 CO 2 Al 2 O 3 Mg 3 N 2

Как называется полученное вещество ВаО?
Оксид бария

Как называется полученное вещество FeO ?
Оксид железа ( II)

Укажите верное утверждение:
Оксиды – ото простые вещества, состоящие из двух химических элементов
Оксиды – это все вещества, в составе которых есть кислород
Оксиды состоят из трех химических элементов
Оксиды – это сложные вещества, состоящие из двух химических элементов, один из которых кислород

Составьте химическую формулу оксида марганца (II) ?
MnO

Составьте химическую формулу оксида серы (VI) ?
SO 3
Отлично! В твою копилку еще добавляются баллы!

Итак, сегодня мы с тобой познакомились с химическим элементом и простым веществом – кислородом. Ты сегодня хорошо потрудился и заработал 16 баллов!

Я искренне надеюсь, что тебе понравилось наше занятие. В таком случае нарисуй смайлик, который соответствует твоему настроению. До новых встреч, мой друг!





























































































