| Этап урока или другой формы УВП | Подэтап урока или другой формы УВП | Действия учителя (педагога) | Действия обучающихся (примерные версии ответов) |
|
1. Мотивационно ориентировочный | 1.1. Вхождение в контакт | Приветствие, отметка отсутствующих, проверка дом.задания |
|
| 1.2. Актуализация субъектного опыта обучающихся | Вопрос игры «Что? Где? Когда?» В ее честь названы многие города, реки и озера? Она необходима человеку каждый день, но избыток вреден для здоровья. В средние века она ценилась дороже серебра и золота. У всех народов она символ гостеприимства, верности, радушия. Она находится в черном ящике. Что в черном ящике? | Отвечают на вопросы в парах, затем озвучивают ответ вслух. |
| 1.3. Создание проблемной ситуации Решите ситуационную задачу. | 1 задание.Лечебно-столовую минералку пьют как для профилактики, так и в качестве столовой. Но с ней следует быть осторожным: в неограниченном количестве она может привести к нарушению солевого баланса в организме и обострению хронических заболеваний. Лечить такая вода будет только в том случае, если вам ее подобрал специалист.
По химическому составу минеральная вода бывает: гидрокарбонатной, хлоридной и сульфатной. От спектра тех или иных минеральных веществ и их количества зависит вкус минералки.
Минеральная вода с большим содержанием хлорида натрия имеет соленый вкус, сульфата магния — горьковатый. Самой вкусной считают минералку из группы гидрокарбонатных (на этикетке указано – гидрокарбонатно-натриевая и др.).
Гидрокарбонатная вода — содержит гидрокарбонаты (минеральные соли) - 600 мг на литр.
Рекомендуется людям, активно занимающимся спортом, грудным детямбольным циститом.
Снижает кислотность желудочного сока. В вашем стаканчике 150 мл минеральной воды. Сколько г гидрокарбоната натрия содержится в данном растворе?
Составьте формулу гидрокарбоната натрия. К какому классу относится это вещество? Решите задачу.
|
Читают задание.
Выполняют задания учителя:
Самостоятельно формулируют учебные гипотезы для решения проблемной ситуации, используя имеющийся набор знаний и применяя логические операции.
|
|
2. Операционно – исполнительский | 2.1. Целеполагание и планирование | Обеспечение мотивации и принятие цели учебно-познавательной деятельности. Сегодня на уроке вы продолжите изучение класса химических веществ «Соли» и узнаете о классификации солей на средние, кислые и основные, научитесь составлять их формулы и давать им названия. Вы узнаете о способах получения разных видов солей. | Готовятся к активной учебно-познавательной деятельности |
|
2.2. Поиск способа решения проблемной ситуации | 2 задание. Среди предложенных формул выберите формулы солей. На какие 2 группы они делятся? 

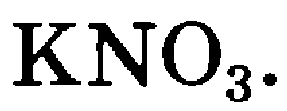
?К какому классу относятся оставшиеся соли? ?Чем отличается их состав? ?Запишите их формулы и названия в тетрадь. ?Составьте конспект. | Самостоятельно создают алгоритм деятельности при решении поставленной проблемы. Для решения проблемы у учащихся имеется определенный минимум исходных знаний из курса химии 8 класса по теме «Соли», в котором есть понятие «соли» как сложного вещества, состоящего из катионов металла и анионов кислотного остатка. Поэтому формулы средних солей они находят безошибочно и понимают, что оставшиеся формулы тоже принадлежат солям. Выделяют растворимые и нерастворимые соли и выписывают их формулы. Изучают текст параграфа №41 и интернет ресурс http://www.hemi.nsu.ru/ucheb187.htm Составляют конспект по данной теме и работают с таблицей «Международные, русские и традиционные названия некоторых важных солей». |
| 2.3. Выбор верного варианта решения, фиксация найденного способа | Возможное объяснение и комментирование действий обучающихся с записями на доске Решение задачи (1 задание) |
Анализируют, классифицируют и выписывают формулы кислых и основных солей, подписывают их названия. Формулы гидрокарбоната магния, кальция, натрия, ответ к задаче 90 мг
Соли | Кислые  гидрокарбонат железа (2) гидрокарбонат железа (2)
 гидросульфат магния гидросульфат магния
| Основные  гидроксохлорид цинка гидроксохлорид цинка
 гидроксокарбонат меди (2) гидроксокарбонат меди (2)
|
|
| 2.4. Отработка открытого способа в системе упражнений, конкретно-практических действий
| 3 задание. Обобщить и составить схему «Классификация солей» 1 уровень. Приведите по 2 своих примера кислых и основных солей и дайте им названия Напишите эти формулы в схему. 2 уровень. Сколько различных солей может образоваться при взаимодействии гидроксида кальция и соляной кислоты? Гидроксида лития и фосфорной кислот? Дайте им названия
4 задание. Закончите уравнения реакций. Определите, какие соли (средние, кислые, основные) получаются при данном мольном соотношении реагентов. Назовите эти соли. а) 2NaOH + H2SO4 = б) NaOH + H2SO4 = в) Ca(OH)2 + HBr = г) Ca(OH)2 + 2HBr = 5 задание Решите задачу. К серной кислоте, количеством 1 моль, добавили гидроксид натрия, массой 40 г. Какая среда раствора (кислая, нейтральная или щелочная) образуется в результате? Как вы это определили? Докажите это расчетами. Рассчитайте массу соли в образовавшемся растворе. | http://distant-lessons.ru/ximicheskie-svojstva-solej.html NaHSO4-гидросульфат натрия (кислая соль) AlOHSO4-гидроксосульфат алюминия
CaOHCl-гидроксохлорид кальция CaCl2- хлорид кальция Li3PO4- фосфат лития Li2HPO4- гидрофосфат лития LiH2PO4- дигидрофосфат лития
 . На основе анализа формул солей и составления формул делают самостоятельные выводы о - возможности составления кислых солей только двухосновных и трехосновных кислот и основных солей двухкислотных оснований, -сверяют правильность написания уравнений с предложенным образцом
http://hemi.wallst.ru/
Записывают уравнения реакций в тетради и индивидуально-на доске. Отвечают на поставленные вопросы.
Составляют уравнение, записывают данные условия и решают задачу |
| 3. Рефлексивно – оценочный | 3.1. Ситуация контроля за выполнением учебных действий | Проверка выполнения заданий
Самооценка работы выявляется в письменном анкетировании по вопросам Оцените свою работу на уроке 1.Я умею составлять формулы солей и давать им названия. 2.В задании № 1 я ответил на 1 вопрос 2 вопроса 3.Я выполнил задание №2 полностью частично 4.задание №3 я выполнил 1 уровень 2уровень 5. В задании №4 я написал первое уравнение первое и второе уравнения все уравнения 6. Задание №5 выполнил полностью частично не выполнил (почему?) | Выполняют задания самостоятельно,при этом не исключаются объяснения учителя и репродуктивная деятельность.
|
| 3.2. Ситуация оценки образовательных результатов | Комментирование отметок, указание на достижения и недоработки обучающихся | Подведение итогов урока Домашнее задание 
 |


















