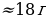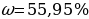Технологическая карта урока на тему: « Основные положения теории электролитической диссоциации»
Учитель: Насибуллина Дина Раилевна
Дата и место проведения: 28.02.2020, МАОУ «Лицей №131» Вахитовского района г. Казани
Тема урока: « Основные положения теории электролитической диссоциации»
Класс: 8
УМК: О.С.Габриелян 8 класс
Тип урока: изучение нового материала
Формы работы: индивидуальная, фронтальная, беседа
Оборудование и реактивы: – интерактивная доска, проектор, компьютер, выход в Интернет; программное обеспечение: компьютерная презентация к уроку, Интернет-ресурсы;
Цели урока: рассмотреть основные положения теории электролитической диссоциации, научиться характеризовать кислоты, щелочи и соли с точки зрения теории электролитической диссоциации.
Задачи урока:
Обучающие: учащиеся должны знать 6 положений электролитической диссоциации, характеризовать кислоты, щелочи и соли с точки зрения теории электролитической диссоциации.
Воспитательные: Способствовать развитию у обучаемых исследовательских умений и навыков. Обеспечение условий по формированию сознательной дисциплины и нормального поведения учащихся. Обеспечение условий для воспитания положительного интереса к изучаемому предмету.
Развивающие: совершенствовать учебные умения школьников при составлении химических уравнений, при выполнении лабораторных опытов; развивать память, устойчивое внимание, применять свои знания на практике.
Планируемые результаты обучения:
Предметные: знать основные положения ТЭД, характеристику кислот, щелочей солей в свете ТЭД.
Метапредметные: Умение определять цель урока с помощью учителя, осознавать свои действия. Умение организовывать самостоятельную работу, работу в группах и парах, совершая при этом адекватные коммуникативные действия, соответствующие задачам и условиям коммуникации; Уметь делать взаимопроверку и взаимооценку, самооценку и рефлексию деятельности.
Личностные: уметь выражать и аргументировать свою позицию, толерантность по отношению к другой точке зрения.
Средства обучения: учебник, раздаточный материал, карточки, наглядные материалы
Литература и использованные источники: 1.О.С.Габриелян.Химия 8 класс 2. Габриелян О.С., Воскобойникова Н.П., Яшукова А.В. «Химия. 9класс» Настольнаякнига учителя химии. М.: Дрофа, 2007; 3.Габриелян О.С., Химия. Методическое пособие (8-9) М.: Дрофа, 2000;
| № | Этап урока | Деятельность учителя | Деятельность учащихся | Формируемые УУД | время |
| 1 | Организационный момент | Приветствие учеников. Проверка готовности учеников к уроку. Создание в классе атмосферы психологического комфорта. | Приветствуют учителя. Отмечают готовность к уроку. | Познавательные: выделять существенную информацию из текста Регулятивные: настраивать себя на продуктивную работу Коммуникативные: слушать учителя и понимать речь других Личностные: Выработка учебной мотивации, установление учащимися связи между целью учебной деятельности и ее мотивом | 1 мин |
| 2 | Актуализациия знаний | Учитель задает вопросы по теме прошлой теме.
Организует самостоятельную работу по пройденной теме (приложение №1)
| Отвечают на вопросы учителя. Слушают ответы одноклассников.
Обсуждают ответы одноклассников
Выполняют самостоятельную работу.
| Познавательные: Понимать смысл информации. Делать умозаключения Регулятивные: Уметь слушать в соответствии с целевой установкой. Дополнять, уточнять высказанные мнения по существу полученного задания. Коммуникативные: Строить продуктивное взаимодействие со сверстниками и взрослыми. Личностные: выражать свои мысли в соответствии с задачами и условиями коммуникации | 15 мин |
| 3 | Мотивация. Сообщение темы и цели урока | Организует определение темы урока. Сформулировать цель.
Подводит учеников к теме урока. | Отвечают на вопросы учителя. Определяют тему урока. Записывают в тетради тему рока | Познавательные: структурировать, систематизировать материал, полученный на предыдущих уроках Регулятивные: самостоятельно формулировать тему и цели урока Коммуникативные: сотрудничать, вступать в дискуссию, анализировать, доказывать свое мнение. Личностные: самоопределение, смыслообразование | 3 мин |
| 4 | Изучение нового материала | Учитель объясняет новый материал: основные положения ТЭД; рассматривают кислоты, основания и соли с позиций ТЭД.
Положения ТЭД и их применение для объяснения особенностей электролитов.
|
| Познавательные: выдвижение гипотез и их обоснование Регулятивные: организовать выполнение заданий учителя, делать выводы по результатам работы Коммуникативные: слушать и понимать речь других Личностные: осознавать свою роль в группе - осознавать степень своего усвоения материала
| 10 мин
|
| 5 | Закрепление изученного материала | Организует проверку новых знаний учащихся, вербально со всем классом по вопросам: Приложение №2 Корректирует ответы учащихся. Дает оценку по результатам этого этапа урока. Предлагает составить возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. Из букв, соответствующих правильным ответам, вы составите название одного из элементов четвертого периода таблицы Д.И. Менделеева. Приложение №3 | Отвечают на вопросы учителя, слушают ответы одноклассников. Корректируют неправильные или неточные ответы одноклассников.
Определяют свои достижения. Учащиеся составляют уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты в карточках.(в молекулярном и ионном виде) | Познавательные: ориентироваться в содержании предмета, использовать информацию для решения учебной задачи Регулятивные: действовать по алгоритму, правилу. Коммуникативные: аргументировать свое мнение Личностные: способность к самооценке | 15 мин |
| 6 | Домашнее задание | Учитель объясняет предстоящую домашнюю работу 1.Изучить параграф 37. 2.Ответить на вопросы в конце параграфа
| Слушают учителя, задают вопросы, возникающие по домашней работе. | Познавательные: анализировать и синтезировать информацию Регулятивные: планировать свою деятельность Коммуникативные: строить монологическую и диалогическую речь Личностные: самоопределение | 2 мин |
| 7 | Рефлексия, подведение итогов урока | Подводит итог урока, комментирует задание, записанное на доске, объявляет оценки. На данном уроке оцениваться будут все ученики по самостоятельной работе. | Отвечают на вопросы: Сегодня на уроке я узнал … Я удивился … Теперь я умею … Я хотел бы узнать…
| Познавательные: рефлексия способов и условий действия контроль и оценка процесса и результатов деятельности. Регулятивные: адекватное понимание причин успеха / неуспеха в учебной деятельности. Коммуникативные: формулирование и аргументация своего мнения; Личностные: закрепление положительной мотивации на учебную деятельность. | 5 мин |
Подпись учителя________________________ Сафонова Э.Р
Приложение №1
1 вариант
№1.Проанализируйте данные таблицы:
| Формула вещества | Растворимость при 0° С | Растворимость при 20° С | Растворимость при 40° С | Растворимость при 6 0° С |
| CuSO4 *5H2O | - | 20,7г | - | - |
| CaCO3 | - | 0,00013 г | - | - |
| PbI2 | - | 0,07г | - | - |
| CO2 | 1,713 л | 0,878 (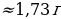 ) ) | 0,53 л | 0,36 л |
Какие из веществ относятся:
А) К растворимым,
Б) К малорастворимым,
В)К практически нерастворимым?
Как зависит растворимость углекислого газа от температуры? Определите объем углекислого газа, который выделится при нагревании насыщенного раствора от 0°С до 40°С. Для приготовления насыщенного раствора было взято 300г воды.
№2.В 100 г воды при 0°С растворяется 127 г бромида марганца (II). Определите массовую долю бромида марганца (II) в его насыщенном при 0° С растворе.
№3. В насыщенном при 50 °С растворе сульфата калия массовая доля соли равна 14,24 %. Определите растворимость сульфата калия при данной температуре.
2 вариант
№1.Проанализируйте данные таблицы:
| Формула вещества | Растворимость при 0° С | Растворимость при 20° С | Растворимость при 40° С | Растворимость при 6 0° С |
| KNO3 | 11,2г | 31,6 г | 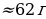
| 
|
| Ca(OH)2 | - | 0,165 г | - | - |
| AgCl | - | 0,00015 г | - | - |
| N2 | - | 0,016 г | - | - |
Какие из веществ относятся:
А) К растворимым,
Б) К малорастворимым,
В)К практически нерастворимым?
Как зависит растворимость нитрата калия от температуры? Рассчитайте массу кристаллов нитрата калия, образовавшийся при охлаждении насыщенного при 20°С раствора до 0°С. Для приготовления насыщенного раствора было взято 200г воды.
№2.В 100 г воды при 80°С растворяется 30,7 г сульфата лития. Определите массовую долю сульфата лития в его насыщенном при 80° С растворе.
№3. В насыщенном при 40 °С растворе сульфата натрия массовая доля соли равна 32,8 %. Определите растворимость сульфата натрия при данной температуре.
3 вариант
№1.Проанализируйте данные таблицы:
| Формула вещества | Растворимость при 0° С | Растворимость при 20° С | Растворимость при 40° С | Растворимость при 6 0° С |
| NaI | - | 179,1 г | - | - |
| PbI2 | - | 0,07 г | - | - |
| AgI | - | 0,000003 г | - | - |
| HCl | 525 л | 440 л (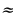 717 г ) 717 г ) | 390 л | 340 л |
Какие из веществ относятся:
А) К растворимым,
Б) К малорастворимым,
В)К практически нерастворимым?
Как зависит растворимость хлороводорода от температуры? Рассчитайте массу объем хлороводорода, выделившегося при нагревании насыщенного при 0°С раствора до 60°С. Для приготовления насыщенного раствора было взято 200г воды.
№2.В 100 г воды при 20°С растворяется 61,5 г хромата калия (K2CrO4). Определите массовую долю хромата калия в его насыщенном при 20° С растворе.
№3. В насыщенном при 0 °С растворе сульфата калия массовая доля соли равна 6,85 %. Определите растворимость сульфата калия при данной температуре.
4 вариант
№1.Проанализируйте данные таблицы:
| Формула вещества | Растворимость при 0° С | Растворимость при 20° С | Растворимость при 40° С | Растворимость при 6 0° С |
| NH3 | - | 702л (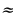 533 г ) 533 г ) | - | - |
| NaCl | - | 35,8 г | - | - |
| NaHCO3 | 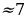 г г
| 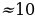 г г
| 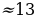 г г
| 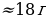
|
| BaSO4 | - | 0,00023 г | - | - |
Какие из веществ относятся:
А) К растворимым,
Б) К малорастворимым,
В)К практически нерастворимым?
Как зависит растворимость питьевой соды от температуры?
Рассчитайте массу NaHCO3, выделившегося при охлаждении насыщенного при 60°С раствора до 0°С. Для приготовления насыщенного раствора было взято 400г воды.
№2.В 100 г воды при 80°С растворяется 355,74 г иодида кальция. Определите массовую долю иодида кальция в его насыщенном при 80° С растворе.
№3. В насыщенном при 20 °С растворе нитрата бария массовая доля соли равна 8,42 %. Определите растворимость нитрата бария при данной температуре.
Ответы:
1 вариант
1. а) CuSO4 *5H2O, CO2 Б) нет В) CaCO3, PbI2 С увеличением температуры растворимость CO2 уменьшается; 3,549 л.
2. 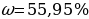
3. 16,6 г в 100 г воды.
2вариант
1. а) KNO3 б) Ca(OH)2 в) AgCl, N2. С увеличением температуры растворимость KNO3 возрастает; 40,8 г.
2. 23,5 %
3. 48,8 г на 100 г воды
3вариант
1. а) NaI , HCl б) нет в) PbI2, AgI с увеличением температуры растворимость хлороводорода уменьшается; 370 л.
2.38,1 %.
3.7,35 г на 100 г воды
4 вариант
1. а) NH3 ,NaCl, NaHCO3 б) нет в) BaSO4 с увеличением температуры растворимость NaHCO3 увеличивается; 44г
2.78,06%
3.9,19 г на 100 г воды
Приложение №2
закрепление новых знаний вербально со всем классом по вопросам:
- Что такое кислоты с точки зрения ТЭД?
- Чем химические свойства веществ отличаются от физических?
- Перечислите химические свойства кислот?
- Что надо помнить при взаимодействии кислот с металлами?
- Как по другому называется реакция взаимодействия кислот с основаниями?
Приложение №3
Составить возможные уравнения реакций взаимодействия перечисленных веществ с раствором серной кислоты. Из букв, соответствующих правильным ответам, вы составите название одного из элементов четвертого периода таблицы Д.И. Менделеева.
1) SiО2 А
2) LiОН К
3) Ва(NО3)2 А
4) НСI С
5) К2О Л
6) К2SiО3 И
7) НNО3 О
8) Fе(ОН)3 Й







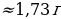 )
)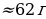

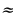 717 г )
717 г )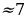 г
г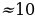 г
г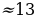 г
г