Учебный предмет: Биохимия (1ч)
Тема: Строение и химические свойства аминокислот, строение, биологическая роль, синтез белка.
Тип занятия: КУ
Цель занятия: сформировать знания о структурной организации аминокислот ,формировать целостное представление об обмене веществ;
Ход занятия
Организационный момент
Формулирование целей и задач урока
Актуализация знаний
4.Объяснение нового материала с элементами закрепления.
5.Закрепление материала
5.Задание на дом. Составить реакции хим. свойств аминокислот.
Рис. «Биосинтез белка»
3.Актуализация знаний
3.1.Определение белков
3.2. Пептидная связь
3.3. Аминокислоты
3.4. Виды аминокислот
3.5. Амфотерность свойств
4.Объяснение нового материала с элементами закрепления.
4. 1. Строение аминокислот
4. 2. Химические свойства
4. 3. Биологическая роль
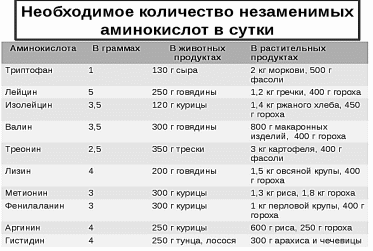
4.4. Основные источники незаменимых аминокислот
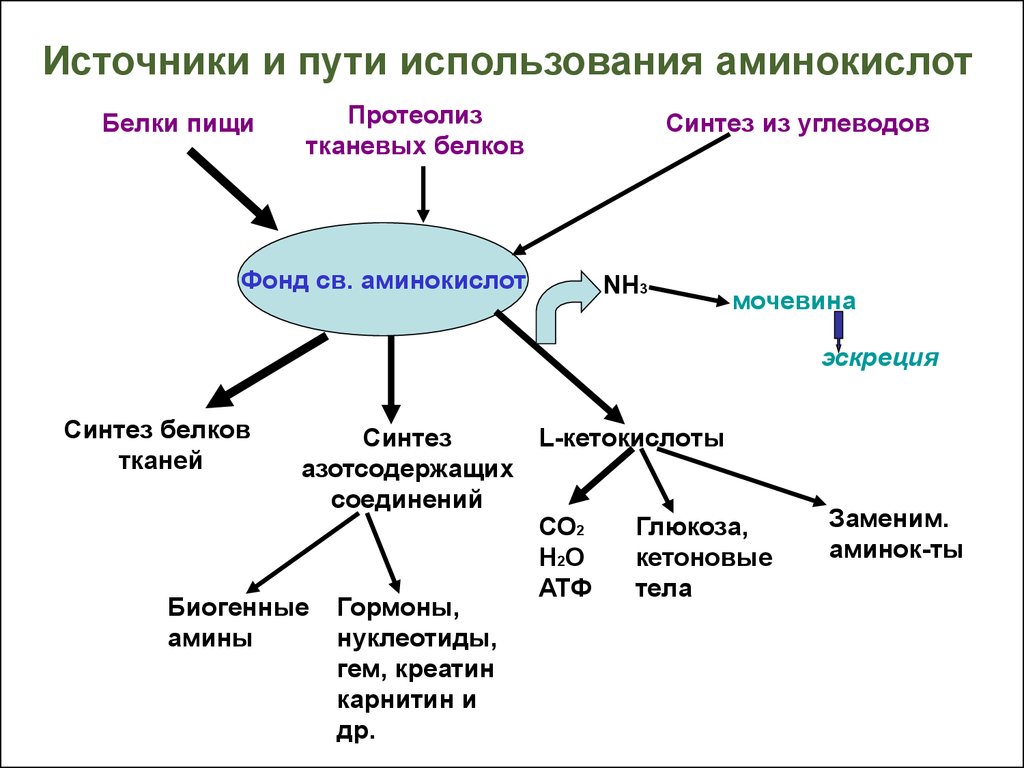
4.5. Синтез белка
5.Закрепление материала
? Привести примеры заменимых и незаменимых аминокислот
? Гидролиз кислотный
4.1.Рефлексия.
Материал к занятию
Общая структурная особенность аминокислот — наличие амино- и карбоксильной групп, соединённых с одним и тем же α-углеродным атомом. R — радикал аминокислот — в простейшем случае представлен атомом водорода (глицин), но может иметь и более сложное строение.
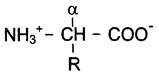
В водных растворах при нейтральном значении pH α-аминокислоты существуют в виде биполярных ионов.
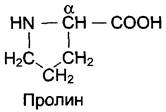
В отличие от 19 остальных α-аминокислот, пролин — иминокислота, радикал которой связан как с α-углеродным атомом, так и с аминогруппой, в результате чего молекула приобретает циклическую структуру.
19 из 20 аминокислот содержат в α-положении асимметричный атом углерода , эти аминокислоты в природе могут находиться в двух разных изомерных формах — L и D. Исключение составляет глицин, который не имеет асимметричного α-углеродного атома, так как его радикал представлен только атомом водорода. В составе белков присутствуют только L-изомеры аминокислот.
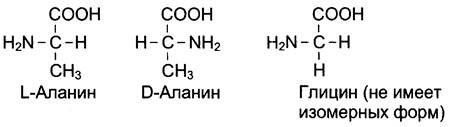
Все 20 аминокислот в организме человека различаются по строению, размерам и физико-химическим свойствам радикалов, присоединённых к α-углеродному атому.
2. Классификация аминокислот по химическому строению радикалов
По химическому строению аминокислоты можно разделить на алифатические, ароматические и гетероциклические (табл. 1-1). В составе алифатических радикалов могут находиться функциональные группы, придающие им специфические свойства: карбоксильная (-СООН), амино (-NН2), тиольная (-SН), амидная (-СО-NН2),гидроксильная (-ОН) и гуанидиновая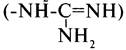 группы.
группы.
Названия аминокислот можно построить по заместительной номенклатуре, но обычно используют тривиальные названия (табл. 1-2).
Тривиальные названия часто происходят от названия источника, серин впервые был выделен из фиброина шёлка (от лат. serieum — шелковистый), а глицин получил свое название из-за сладкого вкуса (от греч. glykos — сладкий).
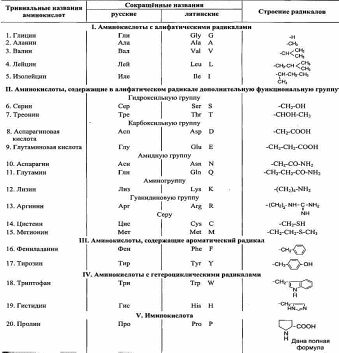
Модифицированные аминокислоты, присутствующие в белках
Непосредственно в синтезе белков организма человека принимают участие только 20 перечисленных аминокислот. Однако в некоторых белках имеются нестандартные модифицированные аминокислоты — производные одной из этих 20 аминокислот. Например, в молекуле коллагена (фибриллярного белка межклеточного матрикса) присутствуют гидроксипроизводные лизина и пролина — 5-гидроксилизин и 4-гидроксипролин.
Модифицированные кислоты, найденные в составе белков
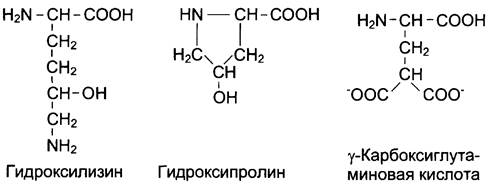
Так, y-карбоксиглутаминовая кислота входит в состав белков, участвующих в свёртывании крови, и две близко лежащие карбоксильные группы в их структуре необходимы для связывания белковых факторов с ионами Са2+. Нарушение карбоксилирования глутамата приводит к снижению свёртываемости крови.
Химические свойства
1) Как основание реагируют с кислотами
HOOC–CH2–NH2 + HCl HOOC–CH2–N+H3Cl (или HOOCCH2NH2∙HCl
основание кислота соль
2) Как кислота, реагирует со щелочами:
NH2–CH2–C–OH + OHNa NH2CH2C–ONa + H2O
кислота O соль O
3) При одинаковом количестве NH2 и COOH групп раствор аминокислоты нейтрален, при неравенстве имеет кислый или основной характер.
В водном растворе может образовываться биполярный ион:
H2N–CH2∙COOH ⇄ H3N+–CH2–COO–
биполярный ион
4) Взаимодействие аминокислот друг с другом:
H2N–CH2COOH + H2NCH–COOH H2NCH2–C–N–CH–COOH + H2O
глицин CH3 O H CH3Б. Пептидная связь. Строение и биологические свойства пептидов
α-Аминокислоты могут ковалентно связываться друг с другом с помощью пептидных связей. Пептидная связь образуется между α-карбоксильной группой одной аминокислоты и α-аминогруппой другой, т. е. является амидной связью. При этом происходит отщепление молекулы воды (см. схему А).