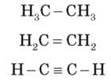Урок 6
Тема урока: «Классификация углеводородов. Образование ковалентных связей в органических соединениях. Виды гибридизации электронных облаков атома Углерода»
Цели урока: формировать у учащихся знания о происхождении ковалентной связи в органических соединениях и ее значение в органической химии; ознакомить учащихся с понятием «гибридизация электронных орбиталей в атоме Углерода, видами гибридизации; научить различать атомы углерода в карбоновой цепи по типам гибридизации и характеризовать возможности образования ковалентных связей гибридными орбиталями различных видов.
Тип урока: изучение нового материала.
Формы работы: фронтальная работа, учебная лекция, решение задач.
Оборудование: медиа-фильм о гибридизацию электронов в атоме Углерода, модели молекул органических веществ, схема классификации углеводородов.
ХОД УРОКА
I. Организационный момент.
II. Проверка домашнего задания.
Актуализация опорных знаний
Фронтальная работа с вопросами
♦ Объясните, почему в органических соединениях атом Углерода проявляет валентность IV.
Для рассмотрения строения следует вспомнить формы электронных облаков и электронное строение атома Углерода.
Электронное строение атома Углерода изображается так: 1s22s22p2, или схематично:
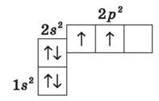
Как видим, на внешней оболочке имеются два неспаренные электроны, следовательно, углерод должен быть двухвалентным. Однако, в подавляющем большинстве случаев Углерод в органических соединениях — четырехвалентное. Это связано с тем, что при образовании ковалентной связи атом Углерода переходит в возбужденное состояние, при котором электронная пара на 2s-орбитали разъединяется и один электрон занимает вакантную р-орбиталь. Схематично:
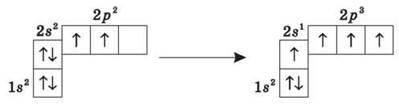
В результате имеем уже не два, а четыре неспаренные электроны.
♦ С какими особенностями строения атома Углерода связано многообразие органических соединений?
Эти уникальные свойства Углерода объясняются сочетанием двух факторов:
• незначительными размерами атома (в сравнении с другими элементами IV группы);
• наличием на внешнем энергетическом уровне (2s и 2p) четырех электронов (поэтому атом Углерода не склонен ни отдавать, ни присоединять свободные электроны с образованием ионов).
Поскольку эти четыре электроны — разные (2s- и 2р-электроны), то в атоме Карбона должны быть и различные связи, однако однозначно доказано, что связи в молекуле метана равнозначны. Оказывается, в результате «смешении» четырех орбиталей возбужденного атома Углерода (одной 2s- и трех 2р-орбиталей) образуются четыре равноценные sp3-гибридные орбитали. Они имеют форму гантели, одна из половин которой значительно больше другой. Вследствие взаимного отталкивания sp3-гибридные орбитали направлены в пространстве в сторону вершин тетраэдра, а углы между ними равны 109° 28' (наиболее выгодное расположение).
Вследствие этого Углерод образует главным образом ковалентные, а не ионные связи, и проявляет валентность IV.
III. Изучение нового материала
Углеводороды — это органические вещества, состоящие из Углерода и Водорода. их общая формула — CxHy.
1. Классификация углеводородов. Работа со схемой электронного пособия «Дрофа» , «Химия -11»
Комментирование схемы.
В зависимости от строения карбонового цепи углеводороды подразделяют на две группы:
• ациклические, или алифатические, т. е. «жирные» (от греческого слова алейфар — «жир», потому что впервые структуры с длинными карбоновыми цепями было обнаружено в составе жиров);
• циклические.
Открытый (незамкнутый) цепь алифатических углеводородов может быть неразветвленным или разветвленным. Углеводороды с неразветвленной карбоновым цепью называют нормальными (н-) углеводородами.
Среди циклических углеводородов выделяют:
• алицикличные (т. е. алифатические циклические);
• ароматические (арены).
В этом случае классификационным признаком является строение цикла.
К ароматическим углеводородам относят соединения, содержащие один или несколько бензоловых циклов (формула бензола — C6H6).
По степени насыщенности различают:
• насыщенные углеводороды (алканы и циклоалканы), в которых имеются только простые связи С и отсутствуют кратные связи;
• ненасыщенные, что наряду с одинарными связями С содержат двойные и/или тройные связи .
2. Образование ковалентной связи в молекулах углеводородов (на примере метана). Метан, его молекулярная, электронная и структурная формулы
Задачи
Простейшая органическое соединение — метан, образованная одним атомом Углерода и четырьмя атомами Водорода. Составьте схему образования ковалентных связей в молекуле метана.
Структурная формула метана не отражает пространственного строения молекулы.
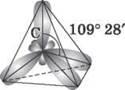
Рис. 1. Модель sр3-гибридного состояния электронной оболочки атома Углерода
sp3-гибридизация характерна для атомов Углерода в насыщенных углеводородах (алканах) - в частности, в метане.
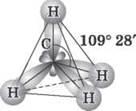
Рис. 2. Схема электронного строения молекулы метана
Из рис. 2 видим, что каждая sp3-гибридная орбиталь в результате перекрывания с s-орбіталлю атомов Водорода образует с ними четыре, так называемые σ-связи. σ-связь — это одинарная ковалентная связь, образованная в результате перекрывания орбиталей по прямой, соединяющей ядра атомов, с максимумом перекрывания на этой прямой. Атом Углерода в молекуле метана расположен в центре тетраэдра, атомы Водорода — в его вершинах, все валентные углы между направлениями связей одинаковы и составляют угол 109° 28'. Следует отметить, что в молекуле этана (CH3 - CH3) один из семи а-связей (C - C) образуется в результате перекрывания двух sp3-гибридных орбиталей атомов Углерода.
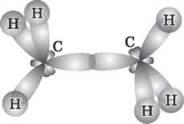
Рис. 3. Образование молекулы этана путем перекрывания двух гибридных электронных облаков атомов Углерода
Гибридизация орбиталей
Гибридизация орбиталей — это смешение и выравнивание электронных орбиталей по форме и энергии.
1. sp3-гибридизация. Одна s-орбиталь и три p-орбитали превращаются в четыре одинаковые «гибридные» орбитали, угол между осями которых равен 109° 28'.
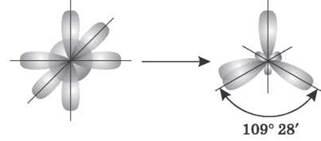
Молекулы, в которых осуществляется sp3-гибридизация, имеют тетраедричну геометрию (CH4, NH3).
2. sp2-гибридизация. Одна s-орбиталь и две p-орбитали превращаются в три одинаковые «гибридные» орбитали, угол между осями которых равен 120°.
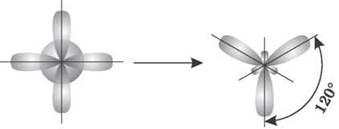
Если связь образуется в результате перекрывания орбиталей по линии, соединяющей ядра атомов, называется σ-связью. Если орбитали перекрываются вне линии, соединяющей ядра, то образуется п-связь. Три sp2-орбитали могут образовывать три σ-связи (BF3, AlCl3). Еще одна связь (п-связь) может образоваться, если на p-орбитали, не участвующей в гибридизации, находится электрон (этилен C2H4).
Молекулы, в которых происходит sp2-гибридизация, имеют плоскую геометрию.
3. sp-гибридизация. Одна s-орбиталь и одна p-орбиталь превращаются в две одинаковые «гибридные» орбитали, угол между осями которых равен 180°.
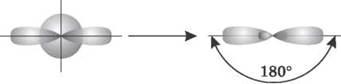
Две sp-орбитали могут образовывать две σ-связи (BeH2, ZnCl2). Еще две p-связи могут образоваться, если на двух p-орбиталях, не участвующих в гибридизации, находятся электроны (ацетилен C2H2).
Молекулы, в которых происходит sp-гибридизация, имеют линейную геометрию (C2H2, HCN).
IV. Первичное применение полученных знаний
Обобщение учителя
Углерод — особый элемент. Ни один другой химический элемент не способен образовывать такое многообразие соединений. Причина этого заключается в том, что атомы Углерода способны:
1) соединяться друг с другом в цепи различного строения — открытые (неразветвленные, разветвленные), замкнутые;
2) образовывать не только простые (одинарные), но и кратные (двойные, тройные) связи:
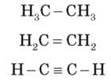
3) образовывать прочные связи почти с любым другим элементом.
V. Домашнее задание
Проработать материал параграфа, ответить на вопросы к нему, выполнить упражнения.