

СДЕЛАЙТЕ СВОИ УРОКИ ЕЩЁ ЭФФЕКТИВНЕЕ, А ЖИЗНЬ СВОБОДНЕЕ
Благодаря готовым учебным материалам для работы в классе и дистанционно
Скидки до 50 % на комплекты
только до
Готовые ключевые этапы урока всегда будут у вас под рукой
Организационный момент
Проверка знаний
Объяснение материала
Закрепление изученного
Итоги урока


Тест ботаника и химия
Просмотр содержимого документа
«Тест ботаника и химия»
ДИСЦИПЛИНА: «БОТАНИКА»
1. Какие компоненты присущи только растительной клетке?
1 – микросомы 2 – митохондрии 3 – пластиды 4 – рибосомы 5 – диктиосомы
2.Каковы размеры паренхимной растительной клетки?
1 – 5-10 мкм 2 – 10-50 мкм 3 – 50-70 мкм 4 – 70-100 мкм 5 – 100-120 мкм
3. Что содержится в вакуоли?
1 – цитозоль 2 – цитогель 3 – эмульсия 4 – клеточный сок 5 – клеточный раствор
4. Укажите, где в клетке отсутствуют рибосомы:
1 – ядро 2 – цитоплазма 3 – микросомы 4 – митохондрии 5 – пластиды
5. Клетки одной ткани характеризуются сходством в…(отметить лишнее)
1 – строении 2 – составе 3 – функции 4 – местоположении 5 – происхождении
6. К системе образовательных тканей относятся (отметить лишнее):
1 – интеркалярная меристема 2 – латеральная меристема
3 – терапевтическая меристема 4 – травматическая меристема
5 – апикальная меристема
7. Какой компонент относится ко вторичной покровной ткани?
1 – устьичные аппараты 2 – кутикула 3 – пробка 4 – волоски 5 – эпидермис
8. Отметьте гистологические элементы, отсутствующие в ксилеме:
1 – трахеи 2 – трахеиды 3 – трихомы
4 – древесинные волокна 5 – древесинная паренхима
9. Где формируется сосудистый камбий?
1 – кнаружи от феллодермы 2 – вовнутрь от перицикла
3 – между флоэмой и паренхимой 4 – между ксилемой и флоэмой
5 – между сосудами ксилемы
10. Отметить объект, не относящийся к корню:
1 – клубеньки 2 – корневище 3 – отпрыски 4 – корнеплод 5 – микориза
11. Какой комплекс тканей присущ только вторичному строению стебля?
1 – флоэма 2 – проводящий пучок 3 – ксилема 4 – закрытый пучок 5 – перидерма
12. Функции, выполняемые листом (отметить лишнее):
1 – терморегуляция 2 – фотосинтез 3 – газообмен 4 – гетерофиллия 5 – транспирация
13. Как называется лист с округлой верхушкой и сердцевидным основанием?
1 – продолговатый 2 – обратнояйцевидный 3 – ланцетный
4 – эллиптический 5 – почковидный
14. У раздельного листа пластинка расчленена:
1 – до 1/4 ширины листа 2 – на 1/2 длины черешка 3 – до 1/2 длины боковой жилки
4 – более чем на 1/2 боковой жилки 5 – до главной жилки
15. Околоцветник – это…
1 – листочки обертки 2 – цветолистики 3 – тычинки и пестики
4 – чашечка и подчашие 5 – чашечка и венчик
16. Неправильный цветок имеет…
1 – несколько осей симметрии 2 – неполночленный околоцветник
3 – одну ось симметрии 4 – нечетное число лепестков 5 – не имеет оси симметрии
17. Гинецей – это совокупность…
1 – плодолистиков 2 – тычинок 3 – семяпочек 4 – нектарников 5 – примордиев
18. Где располагается нижняя завязь?
1 – под пестиком 2 – под пыльником 3 – под оберткой
4 – под прицветником 5 – под цветоложем
19. Отметьте структурный элемент, которого не может быть у лепестка.
1 – язычок 2 – губа 3 – ноготок 4 – шлем 5 – шпора
20. Отметьте симподиальное соцветие:
1 – метелка 2 – дихазий 3 – кисть 4 – щиток 5 – зонтик
21. Отметьте плод с сочным околоплодником.
1 – боб 2 – орешек 3 – зерновка 4 – костянка 5 – семянка
22. Как называется последовательность стадий развития, через которые проходят представители данного таксона от зиготы одного поколения до зиготы другого поколения?
1 – жизненная теория 2 – гетероспория 3 – жизненный цикл
4 – партеногенез 5 – гетероморфия
23. Как называется организм, образующийся в результате прорастания споры?
1 – спорофит 2 – гаметофит 3 – мезофит 4 – фитомер 5 – спорогон
24. Как называется тип полового процесса, в котором участвуют крупная неподвижная женская гамета и мелкая подвижная мужская?
1 – конъюгация 2 – гетерогамия 3 – агаметогамия 4 – изогамия 5 - оогамия
25. Как называется специализированная гаплоидная клетка растений, образующаяся в результате мейоза и предназначенная для бесполого размножения?
1 – зигота 2 – спора 3 – гамета 4 – синергида 5 – диаспора
26 . Как называется женский гаметофит у Покрытосеменных растений?
1 – зародышевый мешок 2 – семя 3 – мегаспорангий 4 – семяпочка 5 – эндосперм
27. Как называется раздел ботаники, посвященный описанию, наименованию и построению иерархической системы растений?
1 – номенклатура 2 – систематика 3 – классификация
4 – экобиоморфология 5 – системология
28. Отметьте слово, обозначающее таксон:
1 – вид 2 – ель 3 – бор 4 – лес 5 – аск
29. Какой отдел не относится к сосудистым растениям?
1 – Lycopodiophyta 2 – Pinоphyta 3 – Polypodiophyta 4 – Bryophyta 5 – Equisetophyta
30. К какой таксономической единице относится название Magnoliopsida?
1 – отдел 2 – семейство 3 – класс 4 – порядок 5 – род
31. Как называется направленное изменение состава и структуры растительности продолжительностью десятки и сотни лет?
1 – эволюция 2 – флуктуация 3 – синузия 4 – совидие 5 – сукцессия
32. Какой законный синоним имеет семейство Poaceae?
1 – Pinaceae 2 – Brassicaceae 3 – Cruciferae 4 – Leguminosae 5 – Gramineae
33. Отметьте название культивируемого гриба:
1 – Mucor mucedo 2 – Amanita phalloides 3 – Lactarius deliciosus
4 – Boletus edulis 5 – Agaricus bisporus
34. Отметьте признак, отсутствующий у Basidiomycetes:
1 – оогамия 2 – споры экзогенные 3 – гаметангиев нет
4 – имеются пряжки 5 – гифы дикарионные
35. Отметьте род, к которому принадлежат культивируемые водоросли:
1 – Spirogyra 2 – Cystoseira 3 – Dictyota 4 – Phyllophora 5 – Laminaria
36. Отметьте признак, отсутствующий у Bryophyta:
1 – ризоиды вместо корня 2 – преобладает гаметофаза 3 – образуется протонема
4 – спорангии на листьях 5 – спорофит паразитирует на гаметофите
37. Отметьте признак, отсутствующий у Lycopodiophyta:
1 – ветвление дихотомическое 2 – гаметофит паразитирует на спорофите
3 – спорангии в стробилах 4 – корни придаточные 5 – гаметофит бесхлорофилльный
38. Отметьте признак, отсутствующий у Equisetophyta.
1 – стробила нет 2 – листья редуцированы 3 – побеги членистые
4 – споры с элатерами 5 – ветвление мутовчатое
39. Отметьте признак, отсутствующий у Polypodiophyta.
1 – гаметофит мелкий сердцевидный 2 – крупные листья - вайи
3 – корневая система стержневая 4 – спорангии в сорусах 5 – преобладает спорофаза
40. Отметьте представителя высших споровых, который используется в рисосеянии:
1 – Mnium 2 – Lycopodium 3 – Selaginella 4 – Calamites 5 – Azolla
41. Отметьте признак, отсутствующий у Pinophyta.
1 – нарастание моноподиальное 2 – архегониев нет 3 – трахеи отсутствуют
4 – шишки раздельнополые 5 – только деревья
42. Отметьте признак, отсутствующий у Magnoliophyta.
1 – семязачатки внутри завязи 2 – рыльце имеется 3 – оплодотворение двойное
4 – гаметангиев нет 5 – споры не образуются
43. Отметьте признак, отсутствующий у Asteraceae.
1 – плод семянка 2 – чашечка редуцирована 3 – плодолистиков два
4 – венчик свободнолепестный 5 – соцветие корзинка
44. Отметьте признак, отсутствующий у Poaceae.
1 – листорасположение супротивное 2 – тычинок три 3 – околоцветник из двух чешуй
4 – интеркалярный рост 5 – элементарное соцветие колосок
45. Отметьте признак, отсутствующий у Brassicaceae.
1 – плод стручок 2 – околоцветник простой 3 – соцветие кисть
4 – тычинок шесть 5 – завязь верхняя
46. Выберите показатели, наиболее точно отражающие видовое богатство сосудистых растений:
1 – 5.000 и 2.700 2 – 3.000 и 2.000 3 – 2.500 и 1.800
4 – 6.000 и 3.000 5 – 6.500 и 2.100
47. К какому из типов жизненных стратегий относятся растения со слабой устойчивостью к неблагоприятным условиям среды и низкой конкурентоспособностью?
1 – В-виды 2 – К-виды 3 – S-виды 4 – R-виды 5 – D-виды
48. Как называются адвентивные растения, вытесняющие на новой родине местную флору?
1 – доминантные 2 – резидентные 3 – антибионты 4 – инвазийные 5 – интразональные
49. Как называется совокупность таксонов, произрастающих на определенной территории?
1 – растительность 2 – фитоценоз 3 – ассоциация 4 – фитосистема 5 – флора
50. Отметьте, где редкие растения сохраняются insitu:
1 – ботанический сад 2 – семенной банк 3 – криохранилище 4 – заповедник 5 – питомник
51. Сколько спермиев участвует в процессе оплодотворения у цветковых растений?
один; 2) два; 3) три; 4) четыре.
52. Женский гаметофит цветкового растения – это:
1) зародышевый мешок; 2) пыльцевая трубка 3) пыльцевая камера; 4) завязь пестика.
53. У цветковых растений пыльцевое зерно прорастает:
1) на рыльце пестика;2) в пыльнике тычинки; 3) в завязи пестика;4) на семязачатке.
54. Соцветие корзинка характерно для:
1) мака; 2) календулы; 3) гречихи; 4) льна 55. Сложным соцветием является:
1) колос подорожника; 2) головка клевера; 3) зонтик вязеля;4) зонтик моркови.
56. Простое соцветие:
1) метёлка овса; 2) колос ячменя; 3) зонтик укропа; 4) корзинка подсолнечника.
57. Ветроопыляемым растением является:
1) амброзия; 2) василёк; 3) астра; 4) тысячелистник.
58. Ранней весной цветёт:
1) гусиный лук; 2) лебеда; 3) девясил; 4) полынь.
59. Сколько в настоящее время известно видов покрытосеменных растений?
1) 250-300 тыс. видов; 2) 500-700 тыс. видов; 3) 700 тыс. — 1 млн видов 4) 1-1,5 млн видов.
60. Одноклеточной водорослью является:
1) нитчатка; 2) улотрикс; 3) спирогира; 4) хлорелла.
61. Съедобной морской водорослью является:
1) королина; 2) ламинария; 3) анфельция; 4) саргассум.
62. Какого отдела водорослей не существует?
1) красные водоросли; 2) бурые водоросли; 3) синие водоросли; 4) зелёные водоросли.
63. Слоевище ламинарии прикрепляется ко дну с помощью:
1) ризоидов; 2) главного корня; 3) придаточных корней; 4) прикрепительного диска.
64. «Цветение» воды в летние месяцы вызывают бурно размножающиеся:
1) красные водоросли; 2) золотистые водоросли;
3) зелёные водоросли; 4) диатомовые водоросли.
65. Характерным признаком водорослей является:
1) тело представлено слоевищем; 2) нет настоящих тканей;
3) не выражен корень, стебель и лист; 4) всё вышеперечисленное.
66. Зооспорами размножается:
1) улотрикс; 2) улотрикс и хлорелла; 3) хлорелла; 4) нитчатка и хлорелла.
67. В Мировом океане на самые большие глубины могут проникать:
1) зелёные водоросли; 2) жёлто-зелёные водоросли;
3) бурые водоросли; 4) красные водоросли;
68. Жгутиковые (подвижные) стадии развития полностью отсутствуют в жизненном цикле водорослей:
1) красных; 2) бурых; 3) эвгленовых; 4) зелёных.
69. Главный корень развивается из:
1) почки; 2) эндосперма; 3) корешка; 4) семядолей.
70. Транспирацией называют процесс:
1) дыхания; 2) испарения воды листьями;
3) поглощения углекислого газа; 4) синтеза углеводов.
71. Микроэлементом, необходимым для минерального питания, является:
1) цинк; 2) кислород; 3) фосфор; 4) углерод;
72. Корень, растущий от стебля или листа, называется:
1) главным; 2) боковым; 3) придаточным; 4) добавочным.
73. Центральная часть проводящего цилиндра корня образована:
1) кожицей; 2) сердцевиной; 3) сосудами; 4) ситовидными клетками;
74. В какой зоне корня происходит деление клеток?
1) зоне проведения; 2) зоне размножения; 3) зоне растяжения; 4) зоне всасывания.
75. Верхушка молодого корня – его точка роста – соответствует зоне:
1) зоне проведения; 2) зоне размножения; 3) зоне растяжения; 4) зоне всасывания.
76. Ложный плод образуется у:
1) вишни; 2) огурца; 3) шиповника; 4) крыжовника.
77. Из нижней завязи развивается плод:
1) яблони; 2) земляники; 3) сливы; 4) лимона.
78. Для прорастания семян не нужен фактор:
1) тепло; 2) вода, влажность; 3) воздух; 4) свет.
79. Семена какого растения необходимо заделывать на наибольшую глубину при посеве:
1) огурец; 2) тыква; 3) томат; 4) мак.
80. После сжигания семян остаются:
1) углеводы; 2) белки; 3) жиры; 4) минеральные соли.
81, Для ускорения прорастания семян с толстой семенной оболочкой её надрезают или подпиливают. Этот приём называется:
1) скарификацией; 2) стратификацией;
3) индукцией; 4) биостимуляцией;
82. Спорофит мохообразных представлен:
1) спорами; 2) спорангием; 3) спорогоном; 4) стеблем и листьями.
83. В жизненном цикле мохообразных:
1) у всех преобладает диплоидное поколение (спорофит);
2) у всех преобладает гаплоидное поколение (гаметофит);
3) у одних групп преобладает спорофит, а у других – гаметофит;
4) спорофит и гаметофит занимают равные части жизненного цикла.
84. Кукушкин лён относится к классу:
1) антоцеротовые мхи; 2) печёночные мхи;
3) листостебельные мхи; 4) не является мхом – лишайник.
85. Верховые торфяные болота образуются в странах:
1) с жарким засушливым климатом; 2) с жарким влажным климатом;
3) с холодным засушливым климатом; 4) с холодным влажным климатом;
86. Основным торфообразователем на болотах является:
1) кукушкин лён; 2) мох сфагнум; 3) лишайник ягель; 4) ключевой мох.
87. У мхов отсутствует:
1) настоящий стебель; 2) настоящий лист;
3) корень; 4) всё перечисленное.
88. В жизненном цикле папоротникообразных:
1) у всех групп преобладает спорофит;
2) у всех групп преобладает гаметофит;
3) у некоторых групп преобладает спорофит, а у других — гаметофит;
4) не происходит чередования поколений.
89. Женские половые органы, развивающиеся на заростках папоротников:
1) антеридии; 2) спорангии; 3) архегонии; 4) сорусы.
90. Для оплодотворения папоротникообразным необходимо:
1) высокая температура; 2) наличие подходящего опылителя;
3) присутствие воды; 4) интенсивное освещение.
91. Простые, не перистые листья имеет папоротник:
1) листовик; 2) орляк; 3) многоножка; 4) щитовник.
92. Корень, растущий от стебля или листа, называется:
1) главным; 2) боковым; 3) придаточным; 4) добавочным.
93. Углеводы, синтезированные в зеленных частях растений, транспортируются во все ткани и органы по:
1) ситовидным трубкам; 2) сосудам;
3) межклетникам; 4) паренхимным клеткам.
94. В зоне растяжения корня происходит:
1) деление клеток; 2) поглощение воды и минеральных солей;
3) увеличение объёма клеток; 4) специализация клеток.
95. Книга «Виды растений» была написана в 1753 году:
1) А. Жюссье; 2) Ж. Б. Ламарком; 3) И. Гете; 4) К. Линнеем.
96. У какого из приведённых растений стержневая корневая система?
1) пырей; 2) лебеда; 3) подорожник; 4) мятлик;
97. У каких растений в стебле имеется настоящий камбий?
1) бамбук; 2) банан; 3) эвкалипт; 4) пальма.
98. Сколько годичных колец в столе 20-летней липы?
1) 10; 2) 20; 3) 40; 4) 80.
99. Видоизменением листа является:
1) игла кактуса; 2) шип розы;
3) колючка боярышника; 4) шип африканской акации.
100. Для прививки у роз в качестве подвоя используют:
1) дикую сливу; 2) шиповник; 3) боярышник; 4) степной миндаль.
101. Разноспоровым папоротником является:
1) страусопер; 2) сальвиния; 3) венерин волос; 4) щитовник.
102. Чаще всего папоротники встречаются:
1) в степях на возвышенностях;
2) в светлых сухих лесах;
3) во влажных лесах, на вырубках и под пологом;
4) на лугах и топких болотах.
103. Особенностью папоротников является:
1) наличие корневищ; 2) размножение спорами;
3) большое количество видов; 4) отсутствие камбия.
104. К вымершим голосеменным принадлежит:
1) гинкго; 2) саговники;
3) семенные папоротники; 4) хвойные.
105. Тип ветвления стеблей у голосеменных растений:
1) вильчатый (дихотомический);
2) у некоторых вильчатый, а у других – симподиальный;
3) моноподиальный;
4) моноподиальный или симподиальный.
106. Семязачатки у сосны развиваются:
1) в завязи пестика; 2) на обычных листьях;
3) на стебле; 4) на семенных чешуях.
107. Органы полового размножения у большинства голосеменных представлены:
1) только архегониями; 2) только антеридиями;
3) и архегониями, и антеридиями; 4) спорангиями;
108. Зрелое пыльцевое зерно сосны состоит из:
1) двух клеток; 2) четырёх клеток;
3) восьми клеток; 4) шестнадцати клеток.
109. Для опыления голосеменным необходимы факторы:
1) вода; 2) насекомое – опылитель; 3) ветер; 4) прохлада.
110. Шишка – это:
1) укороченный видоизменённый побег; 2) видоизменённые листья;
3) спорангий; 4) плод.
111. Средний слой листовой пластинки, в клетках которого содержатся хлоропласты, называется:
1) мезодерма; 2) мезофилл; 3) мезентерий; 4) мезоглея.
112. Клубень картофеля – это:
1) видоизменённый подземный побег; 2) видоизменённый главный корень;
3) утолщённая часть придаточного корня; 4) корневая шишка.
113. У представителей какого семейства никогда не образуются луковицы:
1) луковые; 2) лилейные; 3) амариллисовые; 4) злаковые.
114. Вегетативное размножение и быстрое расселение злостного сорняка – пырея ползучего, осуществляется с помощью:
1) клубней; 2) корневищ; 3) усов; 4) луковиц;
115. Отводками размножают:
1) смородину; 2) картофель; 3) чайные розы; 4) сахарную свеклу.
116. Функции листа:
1) ассимиляция; 2) транспирация; 3) газообмен; 4) все вышеназванные.
117. Стеблевая часть луковицы представлена:
1) донцем; 2) сухими чешуями; 3) сочными чешуями; 4) пазушными почками;
118. Почка – это:
1) видоизменённый укороченный побег; 2) зачаточный побег;
3) укороченный стебель. 4) конус нарастания побега.
119. Почки, образующиеся у основания черешков листьев, называются:
1) верхушечными; 2) придаточными; 3) пазушными; 4) спящими.
120. Важнейшим растением – медоносом является:
1) дуб; 2) липа; 3) бук; 4) берёза.
121. Соцветие метёлка характерно для:
1) грецкого ореха; 2) черёмухи;
3) белой акации (робинии); 4) сирени.
122. Явление, при котором цветки и плоды развиваются непосредственно на стволе дерева, называется:
1) клейстогамия; 2) анемофилия; 3) каулифлория; 4) автохория.
123. Соплодия образуются у:
1) дыни; 2) баклажана; 3) тутового дерева (шелковицы); 4) земляники.
124. Плод семянка характерен для представителей семейства:
1) бобовые; 2) тыквенные; 3) злаковые; 4) сложноцветные.
125. У рапса плод называется:
1) зерновка; 2) стручок; 3) боб; 4) семянка
126. Питательная ткань (эндосперм) в семенах голосеменных растений:
1) гаплоидна; 2) диплоидна; 3) триплоидна; 4) полиплоидна.
127. К классу хвойные не принадлежит:
1) кипарис; 2) хвойник (эфедра); 3) туя; 4) секвойя.
128. В Красную книгу России занесён вид:
1) сосна лесная; 2) сосна крымская;
3) лиственница сибирская; 4) сосна пицундская.
129. Органом, присущим только покрытосеменным растениям, является:
1) семя; 2) плод; 3) спороносный лист; 4) главный корень.
130. Растения, строение цветка которых соответствует формуле Ок 3+3 Т 3+3 П^, относятся к семейству:
1) злаковые; 2) розовые; 3) бобовые; 4) лилейные.
131. Лепестки: лодочка, вёсла и парус, 10 тычинок и 1 пестик, характерны для цветков:
1) паслёновых; 2) сложноцветных; 3) бобовых; 4) зонтичных.
132. К семейству розовых относится:
1) смородина; 2) крыжовник; 3) брусника; 4) ежевика.
133. У представителей семейства паслёновых плод:
1) ягода или коробочка; 2) ягоды или костянка;
3) семянка или коробочка; 4) костянка или стручок;
134. В цветке у крестоцветных количество тычинок:
1) 5; 2) 6; 3) 8; 4) 12.
135. Важнейшей зерновой культурой центрально американского происхождения является:
1) рис; 2) ячмень; 3) кукуруза; 4) просо.
136. Рост стебля в длину происходит благодаря делению клеток:
1) боковой меристемы; 2) вставочной меристемы;
3) раневой меристемы; 4) верхушечной меристемы.
137. Опорную функцию выполняют ткани:
1) паренхима и склеренхима; 2) колленхима и склеренхима;
3) эпидермис и колленхима; 4) паренхима и флоэма.
138. Устьица – это производные:
1) эпидермиса; 2) перидермы; 3) паренхимы; 4) склеренхимы.
139. У какого из перечисленных растений в стеблях и листьях развивается воздухоносная ткань – аэренхима?
1) валериана; 2) ослинник; 3) вьюнок; 4) рдест.
140. У какого пустынного растения вода и питательные вещества запасаются в листьях?
1) канделябровый кактус; 2) опунция; 3) молочай тучный; 4) алоэ.
141. Мутовчатое листорасположение характерно для:
1) подмаренника цепкого; 2) марены белой;
3) хмеля обыкновенного; 4) клёна остролистного.
142. Околоцветник состоит из:
1) цветоножки и цветоложа; 2) цветоложа и лепестков;
3) цветоложа, тычинок и лепестков; 4) лепестков и чашелистиков.
143. В результате двойного оплодотворения эндосперм (питательная ткань семени) развивается из:
1) зиготы; 2) центральной клетки;
3) клеток- антипод; 4) клеток – синергид.
144. Частью пестика не является:
1) пыльник; 2) столбик; 3) завязь; 4) рыльце;
145. Процесс двойного оплодотворения был открыт:
1) К. Линнеем в 1753 г. 2) С.Г. Навашиным в 1898 г.
3) Т. Морганом в 1933 г. 4) Г. Менделем в 1853 г.
146. Двудомным растением является:
1) яснотка; 2) кукуруза; 3) крапива; 4) земляника.
147. Процесс самоопыления у растений называется:
1) автогамия; 2) гетерогамия; 3) клейстогамия; 4) гейтоногамия.
148. Термин «двойное оплодотворение» не совсем удачен. Почему?
1) оплодотворения не происходит вообще;
2) оплодотворение происходит лишь частично, нерегулярным способом;
3) оплодотворение только одно, так как второй спермий сливается не с гаметой, а с вегетативной клеткой;
4) оплодотворение множественное и происходит не дважды, а четырежды.
149. Летучими мышами опыляется:
1) бамбук; 2) баобаб; 3) ананас; 4) инжир.
150. Цветок растения, опыляемого птицами колибри, должен обладать такими признаками, как:
1) сильный фруктовый запах, яркий венчик, обильный жидкий нектар;
2) сильный затхлый запах, яркий венчик, отсутствие нектара, обилие пыльцы;
3) отсутствие запаха, яркий венчик, обильный жидкий нектар;
4) отсутствие запаха, невзрачный или редуцированный венчик, отсутствие нектара, обилие сухой и лёгкой пыльцы.
ДИСЦИПЛИНА: «ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ»
1.Номер периода показывает:
а) число протонов б) число нейтронов в) число электронов г) количество энергетических уровней
2. Электронная формула атома натрия:
а) Is2 2s2 2p2 б) Is2 2s2 2р6 3s2 Зр4 в) Is2 2s2 2p6 3s1 г) Is2 2s2 2p6 3s2 Зр5
3.Соединение с ионной связью:
a) NaCl в) С12 б) SО2 г) Nа
4.Сложные вещества, состоящие из атомов металлов и гидроксогрупп называются:
а) кислоты б) соли в) оксиды г) основания
5.В растворах кислот лакмус изменяет свой цвет на:
а) малиновый б) красный в) фиолетовый г) желтый
6.Заряд комплексного иона в соединении К3 Fе(СN)6]:
а) 1- в) 3- б) 2- г) 1+
7. Отрицательно заряженные ионы:
а) катионы б) анионы в) протоны г) нейтроны
8.Слабый электролит:
a) KJ в) КОН б) H2S г) HCI
9. Реакция, относящаяся к редокс -реакциям:
а) 2КМnО4 + IOFeSO4 + 8H2SO4 K2SO4 + MnSO4 + 5Fe2(SO4)3 + 8Н2О б) CaO + H2SО4 CaSО4 + H2O
в) Ca(OH)2 + H2 SO4 СаSО4 + 2H2O г) FeSО4 + 2NaOH Fe(OH)2 + Na2SO4
10. Наиболее ярко выражены окислительные свойства у:
а) фтора б) хлора в) брома г) йода
11. Название H2SO4.
а) серная кислота б) сернистая кислота в) сероводородная кислота г) тиосерная кислота
12. Формула оксида фосфора (Ш):
а) Аs2О5 в) Р2О5 б) Аs2О3 г) Р2О3
13. В медицине в качестве наружного антисептического средства используют раствор;
а) KMnO4 б) MnSO4 в) HCl г) Na2 SO4
14. Осуществить превращение Cu(OH)2 CuSO4 можно с помощью
а) серной кислоты б) сульфата натрия в) сероводорода г) сернистого газа
15. К солям относится группа веществ
а) NaNO3,NH3,KCl б) NH4C1, KI, Na2CO3 в) H3PO4, K2SO4, AIN г) Fe2 О3, FeCl2, FeCl3
16. При взаимодействии с водородом сера
а) является восстановителем б) является окислителем в) повышает степень окисления г) не изменяет степень окисления
17. Азотную кислоту нельзя получить при взаимодействии веществ
а) N2 О5 и Н2О б) NH3 и Н2О в) AgNО3 и НС1 г) H2SO4 и Ba(NO3)2
18. Реакция, идущая до конца;
а) NaNО3 + HCL б) KNО3 + HCI в) КОН + НС1 г) K2CО3 + NaCI
19. В ряду элементов натрий магний алюминий
а) увеличивается число электронных слоев в атомах б) увеличивается число электронов во внешнем и электронном слое в) уменьшается число протонов в ядрах атомов г) уменьшается степень окисления элементов в соединениях с кислородом
20. При взаимодействии концентрированной серной кислоты с медью получаются:
а) CuSO4+ H2 б) СuO + H2SO3 в) CuSO4 + H2 O + SO2 г) CuO + H2S
21. В соединении с водородом значение степени окисления -2 всегда имеют химические элементы:
а) О и S; б) S и N, в) О и С; г) S и СI.
22. В ряду элементов бериллий → бор → углерод:
а) увеличивается число электронных слоев в атомах; б) увеличивается число электронов во внешнем электронном слое; в) уменьшается число протонов в ядрах атомов; г) уменьшается степень окисления элементов в соединениях.с кислородом.
23.Вещества, формулы которых Cu(OH)2, Cu2S7 СuСl2 , Cu2O соответственно имеют названия:
а) гидроксид меди (li). оксид меди (I), сульфат меди (II), хлорид меди (II). б) гидроксид меди (II), сульфид меди (I). хлорид меди (II), оксид меди (I). в) оксид меди (II). сульфид меди (II), гидроксид меди (I), хлорид меди (II),
г) гидроксид меди(II), сульфит меди (II). хлорид меди (II), оксид меди (II).
24. Основание, кислота, соль и кислотный оксид составляют группу веществ:
а) Сu(ОН)2 , КОН. Н2S, АI2 О3; б) Fe(OH)3 H2S1O3, Na2S, P2О5 ;
в) Zn(OH)2 CuO. AI2 (SO4)3 K2S; г) Ba(OH)2: , FeCI3 ,. H3.PO3. Fe2 О3.
25. Соединение с ковалентной неполярной связью образуется между атомами:
а) металлов; б) разных неметаллов; в) с резко различной электроотрицательностью; г) одинаковых неметаллов.
26. Оксид углерода (IV) можно получить при взаимодействии пары веществ:
а) карбоната кальция и азотной кислоты; б) карбоната натрия и гидроксида бария;
в) угольной кислоты и магния; г) гидроксида кальция и угольной кислоты.
27. К реакциям нейтрализации относится реакция, уравнение которой:
а) СаО + H2SO4 → CaSO4 + Н2О ; б) Ba(NO3)2 + K2SO4 → BaSO4 +2KNO3-
в) 2NaOH + CuSO4 → Cu (OH)2 +Na2SO4; г) H3PO4 + 3Ca(OH)2 → Ca3(PO4)2 + 6 Н2О
28. Раствор гидроксида натрия (NaOH) взаимодействует с каждым веществом, указанным в ряду:
a) SiO2, Na2SO4 H2.SO4 CuO; б) CО2, HCI,CuSO4. H3PO4, в) FeO,Cu, Н2 SO3 ЖЬ, Аl(OH)3 г) SО3, AI, NaNO3 Zn(OH)2
29. При взаимодействии железа с соляной кислотой образуется 2,8 л водорода. Масса
«растворившегося» железа: а) 28 г; б) 7 г; в) 14 г: г) 56 г.
30. Молекулярную кристаллическую решетку имеет пара веществ:
а) вода и оксид углерода (IV); б) оксид кремния и оксид серы (IV);
в) сульфид калия и хлор; г) трафит (С) и оксид углерода (II).
31. В атоме брома число электронных слоев и чисто электронов внешнего слоя соответственно равны
а) 4,5 б) 3,7 в)4,7 г) 4,6
32. К солям относится группа веществ
a) NaNO3 MH3 КCL б) NH4 .С1. KI. Na2CO2 в) Н3РО4 K2SO4 AIN г) Fe2 О3. FeCI2 FeCI3
33. Соединения с ионным типом связи образуются в том случае, когда взаимодействуют атомы
а) одинаковых неметаллов б) с одинаковой электроотрицательностью
в) с резко различной электроотрицательностью г) разных неметаллов
34. В соответствии с сокращенным ионным уравнением Сu2 + 2OН = Сu(ОН)2, взаимодействует пара электролитов а) CuSO, и Fе (ОН)2 б) Cu2SO4 и NaOH в) CuCl2 и Са (ОН)2 г) КОН и Cu2S
35. Процесс восстановления хлора показан схемой
a) CI-4 → Сl7 6) С1-1 → С1-1 в) С!6→ Сl7 г) Сl-1→ С16
36. Масса соли, полученной при взаимодействии избытка гидроксида натрия с 33,6 л (н.у.) оксида углерода (IV) -
а) 79,5 г б) 15,9 г в) 159 г г) 106 г
37. В уравнении реакции получения фосфата кальция Ca3 (PO3)2 при взаимодействии фосфорной кислоты и гидроксида кальция коэффициент перед формулой воды равен а)3 б) 6 в) 2 г)4
38. Основание и соль могут получиться в результате взаимодействия между:
a) NaOH и Fe2 (SO4)3 б) Сu(ОН2), и ZnCl2 в) Ba(OH)2 c и KNO3 г) КОН и H2SO4
39. Реакция Fe + S = FeS + 95.4 кДж является реакцией
а) ионного обмена, экзотермической, необратимой б) окислительно-восстановительной, экзотермической, необратимой в) ионного обмена экзотермической, необратимой г) окислительно-восстановительной, экзотермической, обратимой
40. Кальций и нитрат серебра можно использовать для осуществления реакций по цепочке превращений
а) КС1 → . СаСl2 → AgCI 6)NaCI → AgCI → Ag в) СаСl2 → Сl2 НСl г) НСl → СаСl2 → AgCI
41. Вертикальные группировки элементов, объединяющие в основном сходные по свойствам элементы, называются:
а) большие периоды б) группы в) ряды г) малые периоды
42. Вариант заполнения электронами Р подуровня, который соответствует правилу Гунда:
43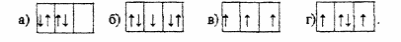
. Реакция, идущая до конца;
а) NaNО3 + HCL б) KNО3 + HCI в) КОН + НС1 г) K2CО3 + NaCI
4 4 . Амфотерное основание:
a) NaOH в) Ca(OH)2 б) КОН г) Zn(OH)2
45. В растворах щелочей фенолфталеин становится:
а) малиновым б) красным в) синим г) фиолетовым
46. Заряд иона комплексообразователя в соединении К4 Fе(СN)6]:
а) 1+ в) 3 + б) 2+ г) 4 +
47. Нейтральная среда:
а) рН=7 б) рН=13 в) рН=11 г) рН=9
48. Ионы, которые не могут существовать одновременно в растворе:
а) К + и РО43- б) Nа+ и SO42- в) Zn2+ и ОH- г) К+ и NO3-
49. С соляной кислотой не будет взаимодействовать:
а) Си б) Fe в) А1 г) Zn
50. Отрицательная: степень окисления азота в соединении:
a) N2O б) NO в) NО2 г) Na3N
51. Названию гидрокарбонат натрия соответствует формула:
a) NaHCO3 б) Na2СО3 в) NaNO3 г) Na2SO3
52. Какова электронная конфигурация иона AI3+
а) Is б) Is2 2s2 2p6 в) Is2 2s2 2p6 3s2 Зр6 г) Is2 2s2 2p6 3s2 Зр1
53. Названию хлорид кальция соответствует формула:
CaCI2 б) КС1 в) Са(СlO)2 г) СаО
54. В ряду элементов натрий магний алюминий
а) увеличивается число электронных слоев в атомах б) увеличивается число электронов во внешнем и электронном слое в) уменьшается число протонов в ядрах атомов г) уменьшается степень окисления элементов в соединениях с кислородом
55. С помощью раствора, содержащего сульфат-ионы, можно распознать
а) катионы натрия б) катионы бария в) гидроксид-ионы г) катионы алюминия
56. Гидроксид меди (II) можно получить при взаимодействии
а) СиО и Н2О б) СиО и H2SO4 в) СиО и КОН г) NaOH и CuSO4
57. Соли, при взаимодействии которых с растворами, содержащими ионы водорода, образуется газ, называются
а) нитраты б) фосфаты в) карбонаты г) сульфаты
58. С увеличением заряда ядра металлические свойства в группах:
а) усиливаются б) ослабевают в) не изменяются
59. Кислород проявляет положительную степень окисления в соединении:
a) Na2O б) КМnО4 в) Н2О2 г) OF2
60. Гидрокснд кальция реагирует с:
a) NaOH б) Nа2О в) ВаО г) НС1
61. В ряду веществ: K2SO4 → H2SО3 → S → FeS - степень окисления серы:
а) повышается от 0 до + 4 б) повышается от - 2 до + 6; в) понижается от + 6 до - 2.
Доказать.
62. Изменение свойств оксидов от кислотных к основным происходит в ряду:
а) MgO → AI2O3 → SiO2 → Р2О5 ; б) SO3 → СО2 → ВеО → Li2 О;
в) ВеО → MgO → СаО → А12О3; г) А12О3 → SiO2 → CQ2 → В2О3.
63. В веществе, название которого фосфат калия, степень окисления фосфора равна
а)+5 б)+3 в)-3 г)-5
64. Ковалентная полярная связь и степени окисления химических элементов - 3 и +1 в соединении
а) СН4 б) РН3 в) N2 О3 г) AICI3
65. Для получения 13,35г хлорида алюминия потребуется хлор, объемом равным
а) 3,36 л б) 6.72 л в) 11,2 л г) 22,4 л
66.Нерастворимое вещество образуется при взаимодействии растворов
а) карбоната натрия и азотной кислоты б) нитрата меди (II) и хлорида натрия
в) гвдроксида кальция (II) и соляной кислоты г) сульфата железа (III) и гидроксида калия
67. Сокращенное ионное уравнение Са2 + СО23 = СаСО3 можно составить для реакции между веществами
а) Na2СО3 и H:2SO4 б) К2СО4 и СаС12 в) Са(ОН)2 и НС1 r)Ca(NO3)2 и NaOH
68. Химическая связь элементов в бромоводороде
а) ионная б) полярно – ковалентная в) металлическая г) ковалентная неполярная
69. Гидроксид- ионы ОН можно обнаружить в растворе с помощью
а) фенолфталеина б) лакмуса синего в) хлорида натрия г) метилоранжа
70. .Вещества, формулы которых Fe(OH)3, FeO, Fe 2 (SО4)3 FeS. соответственно имеют названия:
а) гидроксид железа (III). оксид железа (II). сульфат железа (III), сульфид железа (II).
б) гидроксид железа (III), оксид железа (II), сульфит железа (III), сульфид железа (II).
в) гидроксид железа (III), оксид железа (II). сульфат железа (II), сульфид железа (II).
г) гидроксид железа (II). оксид железа (11). сульфат железа (III). сульфид железа (II).
71. Ковалентная полярная связь и степени окисления химических элементов -3 и +1 в соединении:
а) СН4; б) СН3; b) N2 О3 г)А1Сl3.
72.Реакция между оксидом меди (II) и серной кислотой относится к реакциям
а) обмена б) замещения в) соединения г) разложения
73. Уравнение окислительно-восстановительной реакции
a) 2Fe(ОH)3 = Fе2O3 + ЗН2О б) СаО +Н2О = Са(ОН)2
в) NaOH + НI = Nal + Н2О г) 2А1 + 3S = А12S3
74. При взаимодействии растворов гидроксида кальция и карбоната натрия можно получить:
а) карбонат кальция, углекислый газ и воду; б) гидроксид натрия, углекислый таз и воду;
в) карбонат кальция и гидроксид натрия; г) гидрокарбонат натрия и пигхжарбонат катьция.
75. Гидроксид меди (II) можно получить при взаимодействии
а) СuО и Н2О б) СuО и H2SO4 в) Сu и КОН г) NaOH и CuSO4
76. Реакция натрия с водой относится к реакциям:
а) соединения; б) замещения; в) разложения; г) обмена.
Запишите уравнения реакций.
77. С каждым из веществ, формулы которых BaCl2. Cu(OH)2, Fe, будет взаимодействовать
а) сульфат цинка; в) гидроксид натрия; б) нитрат магния; г) серная кислота.
78. В соляной кислоте полностью «растворилась» цинковая пластинка массой 16,25г
Объем выделившегося при этом водорода:
а) 11,2 л; б) 2,24 л: в) 5,6 л; г) 1.12 л
79. Кислотными оксидами является группа веществ:
а) Р2О5, СО, SO2 в) CuO, SO2. SO3 б) . SO3 CO, SO2; r) N 2, O5, СО2 SO3.
80. Основания соответствуют химическим элементам, имеющим следующие порядковые номера в периодической системе:
а) 20.16,12; в) 13, 14. 15; б) 12,20,19: г) 6, 11,12.
81. С увеличением заряда ядра металлические свойства в группах:
а) усиливаются б) ослабевают в) не изменяются
82. Порядковый номер элемента показывает:
а) высшую положительную степень окисления элемента
б) высшую отрицательную степень окисления элемента
в) атомную массу элемента
г) число электронов
83. Сложные вещества, состоящие из двух элементов, один из которых кислород, называются:
а) оксиды б) кислоты в) основания г) соли
84. Кислотный оксид:
a) SО3 б) К2О в) А12Оз г) Na2O
85. Кислая среда:
а) рН=4 б) рН=8 в) рН=9 г) рН=10
86. Соли, образованные сильным основанием и слабой кислотой, имеют реакцию среды:
а) кислую б) щелочную
в) нейтральную г) близкую к нейтральной
87. Физиологический раствор - это раствор:
а) хлорида магния б) сульфата цинка
в) гидроксида натрия г) 0,9 % хлорида натрия
88. Кислород проявляет положительную степень окисления в соединении:
a) Na2O б) КМnО4 в) Н2О2 г) OF2
89. При взаимодействии концентрированной серной кислоты с медью получаются:
а) CuSO4+ H2 б) СuO + H2SO3
в) CuSO4 + H2 O + SO2 г) CuO + H2S
90. Формула нитрата калия:
а) КNO3 б) Са(NO3)2 в) KNO2 г) Са(NО2)2
91. Реактив, используемый для обнаружения углекислого газа;
а) нитрат серебра б) хлорид бария в) известковая вода г) оксалат аммония
92. Гидрооксид алюминия проявляет свойства:
а) амфотерные б) кислотные в) основные
93. Элементы I группы главной подгруппы называют:
а) щелочные металлы б) щелочноземельные металлы
в) галогены г) инертные газы
94. С разбавленной серной кислотой не реагирует:
а) Сu б) Мg в) Fe r) Zn
95. Формула бихромата калия:
а) K2CrO4 б) Н2 CrO4 в) K2Cr2 O7 г) Сг2О3
96. Для лечения анемий в медицине используют соединения:
а) хрома б) алюминия в) марганца г ) железа
97. Для получения гидроксида меди (II) реакцией обмена может быть использован
а) CuSO4 б) CuS в) Cu2SО4 г) Cu2S
98. Отрицательная: степень окисления азота в соединении:
a) N2O б) NO в) NО2 г) Na3N
99. Явление, когда один и тот же химический элемент образует несколько простых веществ, называется
а) адсорбцией б) аллотропией в) изотопией г) амфотерностью
100. Сильными электролитами являются растворы:
а) гидроксида натрия б) хлорида аммония в) гидроксида железа (Ш) г) соляной кислоты
10I. Степень окисления +5 имеет азот в группе веществ
a) NH3, N2 О5, HNO3 б) NН4Сl N2 O5 HNO3 в) KNO3 N2 О5, HNO3 г) Ba (NO3)2, HNO2 N2O5
102 В атоме кремния число электронных слоев и число электронов внешнего слоя соответственно равны
а) 3, 3 б) 3,2 в) 2,4 г) 3.4
103. В ряду элементов натрий → магний → алюминий
а) увеличивается число электронных слоев в атомах
б) увеличивается число электронов во внешнем электронном слое
в) уменьшается число протонов r ядрах атомов
г) уменьшается степень окисления элементов в соединениях с кислородом
104. Неметаллические свойства усиливаются в ряду элементов
а) Se → S → О б) О → N → С б) B → Be → Li r) N → P → As
105. К солям относится группа веществ
а) NаNO3 , Nib. КО б) NH4C1, Kl, Na3CO3 в) H3 PО4, K2SO4 AIN r) Fe 2O3, FeCl3
106. В водородном соединении фосфора число общих электронных пар
а) 3 б) 2 в) 4 г) 5
107. Сульфат бария можно получить при взаимодействии
а) Ва(ОН)2. и SO2 б) Ва(NO3)2 и К2SO4 в) Н2О и H2S г) Ва(ОН)2 и Н2S
108.Кислоту нельзя получить при взаимодействии веществ
а) Ва(NO3)2 и Н2SO4 б) H2О и Р2О5 в) H2О и СаО г) H2 Cl2
109. Масса меди в 0.5 моль оксида меди (П)СuО
а) 32г б) 64г в) 16г г) 8г
110. Уравнение реакции ионного обмена
а) H2S+3О2 =2SО2+2H2О б) СаСО3 =СаО+СО2
в) Zn + H2SО4 = ZnSО4 +H2 ↑ г) КОН +H2SO4 = K2SO4 +2H2О
111. В процессе реакции, уравнение которой 2Н2S+О2 =2S+2H2О схема превращения серы
a) S0 → S +2 б) S 2→ S0 в) S 2 → S4 r)S4 → S--2
112. При полном разложении 10г карбоната кальция образовался углекислый газ объемом
а) 4.48 л б) 11,2 л в) 22,4 л г)2,24 л
113. При взаимодействии цинка с серной кислотой получили 5,6л водорода. Масса прореагировавшего цинка а) 32,5 г б) 21,7 г в) 16,25 г г) 24,4 г
114. В уравнении реакции между гидроксидом алюминия и серной кислотой коэффициент перед формулой воды равен а) 6 6) 4 в) 3 г) 2
115. Газообразное вещество образуется при взаимодействии
а) ВаСl2 и H2SO4 б) Na2CO3 и НNO3 в) NaOH и СО2 г) Cu(OH)2 и НСl
116. Сокращенное ионное уравнение Сu2 + 2ОН = Сu(ОН)2 можно составить для реакции между веществами
а) CuCl2 и iAgNO3 б)Сu(ОH)2 и H2SO4 в) СuSO4 и Вa(NO3)2: г) Cu(NO3)2 и Са(ОН)2
117. В растворе одновременно не могут быть ионы
а) К и СО32 б)Са2: и СО32 B) Na и SО42 r) Ca2 и ОН
118. Осуществить превращение Сu(ОН)2 → СuSO4 можно с помощью
а) серной кислоты б) сульфата натрия в) сероводорода г) сернистого газа
119. В соответствии с сокращенным ионным уравнением Сu2' + 2ОН = Сu(ОН)2 взаимодействует пара электролитов
а) СuSO4 и Fе(ОН)2 б)Cu2SO4 и NaOH в) CuCl2 и Са(ОН)2 г) КОН и Cu2S
120. Процесс окисления азота показан схемой
a) N+3 → N-3 б) N +4 → N-2 в) N +3 → N-2 г) N8 →N'4
121. В периодах с увеличением заряда ядра неметаллические свойства:
а) усиливаются б) ослабевают в) не изменяются
122. Соединение с коваленгной веполярной связью:
а) О2 б) NaCl в) НС1 г) H2SО4
123. Сложные вещества, состоящие из атомов водорода и кислотных остатков, называются;
а) кислоты б) соли в) оксиды г) основания
124. Из перечисленных веществ указать кислоту:
a) NaOH б) СО2 в) NaCI г) HCI
125. Положительно заряженные ионы:
а) катионы б) анионы в) протоны г) нейтроны
126. Сульфаты обнаруживают с помощью раствора:
а) нитрата серебра б) нитрата натрия в) хлорида бария г) оксалата аммония
127. При разбавлении серной кислоты всегда приливают кислоту в воду.
Разбавление конц. H2SO4 приливанием к ней воды опасно тем, что;
а) может возникнуть пожар б) может произойти разложение воды
в) может выделиться газ г) может произойти разбрызгивание раствора вследствие выделения теплоты
128. Формула ортофосфорной кислоты:
а) HPO2 б) Н3РО3 в) Н3РО4 г) НРО3
129. В медицине используется соединение:
а) К2 О б) NаНСОз в) КОН г) Na2CO3
130. Гидроксид кальция реагирует с:
a) NaOH б) Nа2О в) ВаО г) НС1
131. Поваренная соль - это:
а) хлорид натрии б) карбонат натрия в) гидрокарбонат натрия : г) оксид натрия
132. С разбавленной серной кислотой не реагирует:
а) Сu б) Мg в) Fe r) Zn
133. Название FeSO4:
а) сульфат железа (II) б) сульфат железа (Ш) в) сульфит железа (II) г) сульфит железа (Ш)
134. Газообразное вещество образуется при взаимодействии
а) ВаС12 и H2SO4 б) Na2CO3 и HNO3 в) NаOH и СО2 г) Cu(OH)2 и НС1
135. С помощью соляной кислоты можно определить наличие в растворе
а) сульфата меди (II) б) карбоната калия (II) в) хлорида меди г) нитрата натрия
136. Реакция между оксидом меди (II) и серной кислотой относится к реакциям
а) обмена б) замещения в)соединения г) разложения
137. Явление, когда один и тот же химический элемент образует несколько простых веществ, называется
а) адсорбцией б) аллотропией в) изотопией г) амфотерностью
138. Реакция, идущая до конца;
а) NaNО3 + HCL б) KNО3 + HCI в) КОН + НС1 г) K2CО3 + NaCI
139. В ряду элементов натрий магний алюминий
а) увеличивается число электронных слоев в атомах
б) увеличивается число электронов во внешнем и электронном слое
в) уменьшается число протонов в ядрах атомов
г) уменьшается степень окисления элементов в соединениях с кислородом
140. При взаимодействии концентрированной серной кислоты с медью получаются:
а) CuSO4+ H2 б) СuO + H2SO3 в) CuSO4 + H2 O + SO2 г) CuO + H2S
14I. Степень окисления +6 имеет сера в группе веществ:
а) H2SO4 (N-3Н4)2SO4 SO3 в) H2 SO3 SO3 K2 SO3; б) SO2. H2S, SO3 r) SO3 Na2SO4 H2SO4
142. Химическому элементу, образующему простое вещество с наиболее ярко выраженными металлическими свойствами, соответствует схема строения атома:
а) +4 )2:)2 в) +12 2)8)2 б) +20 ) 2) 8)8 )2 г) +13 )2 )8)3
143. К кислотам относится группа веществ:
а) H2 S5 НNO3 Нвг; в) NH3 НNO3 HJ; б) КСI, НС1, Н2 SO4 г) NaOH, H2SO4 H2S.
144. Ковалентная полярная связь и степени окисления +5 и -2 в веществе:
a)NН3; б)Р2О3; в) Н3Р; r) P2O5.
145. Гидроксид меди (II) можно получить при взаимодействии
а) СuО и Н2О; б) СuО и H2SO4 в) СuО и КОН; в) NaOH и CuSO4
146. Реакция между магнием и соляной кислотой относится к реакциям:
а)соединения; в) разложения; б) обмена: г) замещения,
147. Масса натрия в 0.5 моль карбоната натрия Na2CO3 равна:
а) 9,2 г б) 11,5 г в) 46 г г) 23 г
148. С каждым из веществ, формулы которых ВаСl2 Cu(OH)2, Fe, будет взаимодействовать:
а) сульфат натрия; б) нитрат алюминия; в) гидроксид бария; г) серная кислота
149. При пропускании хлора над нагретым натрием получили 0,5 моль соли. Объем вступившего в реакцию хлора:
а) 5,6 л; 6) 11,2 л; в) 2,8 л: г) 8,4 л.
150. Схеме превращений N" → N -4 соответствует уравнение химической реакции
a) N2 + О2.=2NO б) 4NH3 + 3О2 = 2N2 +6Н2О в) N2 + ЗН2 = 2NH3 r)NH3 + H2О=NH4OH
151.При взаимодействии с водородом сера
а) является восстанови гелем б) является окислителем
в) повышает степень окисления г) не изменяет степень окисления
152. Кристаллическую решетку ионного типа имеет вещество, которое:
а) прочно, плавится при высокой температуре; б) пластично, плавится при высокой температуре;
в) газообразно при 20 "С, хороню растворяется в воде; г) хрупкое, плавится при невысокой температуре.
153. Кислоты состава HR образуют все элементы, имеющие следующие порядковые номера в периодической системе: а) 7,15,33; б) 6, 14, 32; в) 7, 16, 34; г) 15, 16, 17.
154. В ряду элементов натрий → магний → алюминий
а) увеличивается число электронных слоев в атомах
б) увеличивается число электронов во внешнем электронном слое
в) уменьшается число протонов в ядрах атомов
г) уменьшается степень окисления элементов в соединениях с кислородом
155. С увеличением заряда ядра атомов металлические свойства в ряду элементов
Na → Mg → Al → Si
а) усиливаются б) не изменяются в) ослабевает г) изменяются периодически
156. Атомы химических элементов азота и фосфора имеют
а) одинаковое число электронов внешнего слоя б) одинаковое число электронов в атоме
в) разную высшую степень окисления г) одинаковое число электронных слоев
157. Почерневшую при нагревании медную пластину можно вновь сделать блестящей, если обработать ее поверхность
а) соляной кислотой б) известковой водой в) раствором мыла г) нашатырным спиртом
158. Основания соответствуют химическим элементам, имеющим следующие порядковые номера в периодической системе а) 20,16.12 6)12,20.19 в) 13,14,15 г) 6,11,12
159. Среди указанных пар веществ к кислотным оксидам относятся:
а) Na2 и SO3 b) CO и N2O5 б) SiO2 и P2O5 r) SO2 и CuO.
160. Реакция Fe + S = FeS + 95,4 кДж является реакцией
а) ионного обмена, экзотермической, необратимой
б) окислительно-восстановительной, экзотермической, необратимой
в) ионного обмена, эндотермической, необратимой
г) окислительно-восстановительной, экзотермической, обратимой
ДИСЦИПЛИНА: «ОРГАНИЧЕСКАЯ ХИМИЯ»
1. Вещества с общей формулой Сn H2n +2 относятся к классу
а) алканов б) алкинов в) алкенов г) аренов
2. Для осуществления превращения фенол ® фенолят натрия + водород необходимо к фенолу прибавить
а) натрий б) оксид натрия в) гидроксид натрия г) хлорид натрия
3. Вещества с общей формулой Сn Н2n относятся к классу
а) алканов, б) алкинов в) алкенов г) аренов
4. Вещество, формула которого СН3 СН2ОН, является
а) алканом б) спиртом в) альдегидом г) карбоновой кислотой
5. Наиболее распространенный вид химической связи между атомами углерода в органических веществах
а) ионная б) ковалентная неполярная в) ковалентная полярная г) металлическая
6. Образование соединения синего цвета при взаимодействии глюкозы (р-р) с гидроксидом меди (II) (свежеприготовленным) с образованием глюконата меди (II) обусловлено наличием в ее молекуле
а) одной гидроксильной группы б) нескольких гидроксильных групп
в) альдегидной группы г) s -и п-связей
7. Реакция «серебряного зеркала» не характерна для
а) фруктозы б) уксусного альдегида в) глюкозы г) формальдегида
8. Функциональную группу -С =О содержат молекулы
|
ОН
а) сложных эфиров б) спиртов в) альдегидов г) карбоновых кислот
9.Гексахлорциклогексан образуется в результате реакции присоединения
а) хлора к бензолу б) хлора к циклогексану в) хлороводорода к бензолу г) хлора к гексану
10. Характерной химической реакцией для веществ, имеющих общую формулу СnН2n+2 является реакция
а) замещения б) гидрирования в) присоединения г) дегидратации
11. При добавлении к некоторому органическому веществу свежеосажденного гидроксида меди (II) и нагревании образуется красный осадок. Это органическое вещество
а) диэтиловый эфир б) альдегид в) многоатомный спирт г) уксусная кислота
12. Элементарным звеном бутадиенового каучука является
а) — СН2—СН=СН —СН2— б) СН2=СН—СН=СН2
в) — СН2—СН2—СН2—СН2— г) —СН2—СН2—
13. Функциональная группа —ОН характерна для
а) сложных эфиров б) спиртов в) альдегидов г) простых эфиров
14. Метан реагирует с
а) натрием б) бромной водой в) КМпО4 (р-р) г) кислородом
15. Тип реакции взаимодействия этилена с бромом
а) замещение б) гидрирование в) присоединение г) дегидратация
16. При добавлении к некоторому органическому веществу свежеосажденного гидроксида меди (II) в присутствии щелочи образовался раствор ярко- синего цвета. Это органическое вещество
а) этанол б) фенол в ) глицерин г) анилин
17. Элементарное звено —СН2—СН2— имеется в макромолекулах
а) полиэтилена б) полипропилена в) бутадиенового каучука г) бутадиенстирольного каучука
18. Тип реакции взаимодействия фенола с бромной водой
а) замещение б) гидрирование в) присоединение г) дегидратация
19. Формула анилина а) С6Н13ОН б) С6Н5ОН в) C6H5NH2 г) С6Н5 О2
20. Водородная связь образуется между молекулами а) спиртов б)алканов в) алкенов г) алкинов
21. Вещества с обшей формулой СnН2n относят к классу а) алканов в) алкенов б) алкинов г) аренов
22. С раствором перманганата кали» и бромной водой реагируют
а) С3Н6 и C3 Н7CI в) С2Н6 и С6 Н6 б) С2Н4 и С2Н2 г) С2Н4Вг2 и С2Н4
23. Характерным типом химической реакции для веществ, имеющих формулу CnH2n2 является
а) гидрирование в) дегидратация б) замещение г) присоединение
24. Пентен можно отличить от пентона с помощью любого из реактивов
а) раствор перманганата калия и гидроксид меди (II) б) оксид серебра гидроксид меди (II)
в) бромная вода и оксид меди (II) г) бромная вода и раствор перманганата калия
25. Ацетилен получают одностадийно из
а) карбита кальция в) углерода б) карбоната кальция г) гидроксида кальция
26. Формальдегид вступает в реакцию с
а) аммиачным раствором оксида серебра б) этанолом
в) соляной кислотой г) водным раствором .хлорида натрия
27. Гомологом этана является
а) С2Н6 в) С6Н6 б) (СН2)3 г) СН3 - СН2 -СН3
28. При взаимодействии пропилена с бромоводородом получается
а) 1-бромпропан в) 2-бромпропан б) 1.1-дибромпропан г) 2,2-дибромпропан .
29. Структурным звеном полиэтилена является
а) СН3 - СН = СН2 б) -СН2-СН2- в) -СН-СН2 - г) СН2 = СН2
|
СН3
30. Гексахлорциклогексаи образуется в результате реакции присоединения
а) хлора к бензолу в) хлорводорода к бензолу
б) хлора к циклогексану г) хлора к гексану
31. Тип реакции взаимодействие этилена с бромом
а) замещение в) присоединение б) гидрирование г) дегидратация
32. Диметил пропан относится к классу углеводородов, общая формула которого
а) CnH2n . б) CnH в) CnH2n-2 г) CnH2n -6
33. Гомологом СН3 - СН2 СН2-СН=СН2 является
а) пентен-2 б) 2-метилбутен-1 в) гексен-1 г)2-метилбутан
34. Бромбеизол образуется в результате реакции замещения при взаимодействии
а) бензола с Br2 6) толуола с Br2 в) бензола с НBr г) толуола с НBr
35. Органическим веществом, при пропускании которого через бромную воду раствор обесцвечивается, является а) метан б) пропилен в) хлорметан г) этан
36. Ацетилен не может реагировать с а) водородом б) кислородом в) водой г) метаном
37. Вещество, формула которого CH3—СН2 —С =СН2, называется
|
СН3
а) 3-метилбутан б) 2-метилбутан . в) З-метилбутен-3 г) 2-метнлбутен-1
38. С раствором перманганата калия реагируют
а) пропан и хлорэтан б)этилен и ацетилен в) этан и циклогексан г) этилен и бензол
39. Метиловый спирт не превращается в алкен при действии концентр. серной кислоты, потому что
а) атом углерода находится в sp-гибридизации б) молекула спирта не содержит С-С связей
в) молекула спирта не содержит двойной связи г) содержит одну гидроксильную группу
40..Пропанол-2 имеет формулу
а) СН3-СН—СН3 б) СН3-СН2 -СН2 -ОН в) СН3-СН2 -СН2 -ОН г) СН3-СН2 -СООН
I
ОН
41. Вещество, формула которого СН3СН2ОН, является
а) алканом б) спиртом в) альдегидом г) карбоновой кислотой
42. п-Связь между атомами углерода имеется в молекуле
а) пентана б) пропанола в) циклопентана г) пропена
43. С этиламином реагирует
а) вода б) этанол в) оксид углерода (IV) г) аммиачный раствор оксида серебра
44. Пентен можно отличить от пентана с помощью любого из реактивов
а) раствор перманганата калия и гидроксид меди (П) б) оксид серебра и гидроксид меди (П)
в) бромная вода и оксид меди (II) г) бромная вода и раствор перманганата калия
45. Функциональную группу —С=О содержат молекулы
Н
а) сложных эфиров б) спиртов в) альдегидов г) карбоновых кислот
46. При взаимодействии пропилена с бромоводородом получается
а) 1-бромпропан б) 1, 1-дибромпропан в) 2-бромпропан г) 2,2-дибромпропан
47. Для алкенов наиболее характерны реакции
а) замещения б) обмена в) присоединения г) дегидратации
48. При добавлении к некоторому органическому веществу бромной воды образовался белый осадок. Это органическое вещество а) гексан б) фенол в) циклогексан г) бензол
49. Структурным звеном полиэтилена является
а) СН3—СН=СН2 б)—СН2—СН2 — в) —СН—СН2— г) СН2 = СН2
СН3
50. Гомологом 2-метилпентена-1 является
а) СН3— СН— СН2— СН3 б) СН3— СН2— С=СН2
СН3 СН3
в) СН3—(СН2)4—СН3 г) СН3—СН2—СН=СН—СН3
51. При окислении этанола оксидом меди (II) образуется
а) формальдегид б) ацетальдегид в) муравьиная кислота г) уксусная кислота
52. Этилацетат можно получить при взаимодействии
а) метанола с муравьиной кислотой б) этанола с муравьиной кислотой
в) метанола с уксусной кислотой г) этанола с уксусной кислотой
53. Гомологом гексана является
а) С6 Н14 б) С7Н16 в) С6Н6 г) С7 Н14
54. В схеме превращений
+Н2О +Н2 +Na
С2Н2 ® Х ® Y ® C2H5ONa формулы веществ X и Y
Hg2+H+
а) Х— С2Н5ОН; Y —СНзСООН б) X — СН3С=О; Y — С2Н5ОН
Н
в) Х - СНзСООН; Y —С2Н5ОН г) Х —СН3С=О; Y —СНзСООН
Н
55. Метанол получают а) гидратацией этилена б) окислением формальдегида в) гидратацией ацетилена г) взаимодействием СО с Н2
56. Чтобы сместить химическое равновесие реакции
СНзСООН + СН3ОН ® СНзСООСНз + Н2О +Q в сторону исходных веществ, необходимо
а) повысить температуру б) отделить сложный эфир в) добавить спирт г) применить катализатор
57. Этанол может реагировать с
а) натрием и кислородом б) хлоридом меди (II) и оксидом меди (II)
в) уксусной кислотой и метаном г) этиленом и формальдегидом
58. Этанол может реагировать с
а) натрием и кислородом б) хлоридом меди (II) и оксидом меди (II)
в) уксусной кислотой и метаном г) этиленом и формальдегидом
59. Функциональную группу —С=О содержат молекулы
Н
а) ацетальдегида и одной из форм глюкозы б) формальдегида и сахарозы
в) уксусной кислоты и этанола г) фенола и метилацетата
60. С раствором перманганата калия и бромной водой реагируют
а) СзН6 и СзН7С1 б) С2Н4 и С2Н2 в) С2Н6 и С6Н6 г) С2Н4Вг2 и С2Н4
61. Вещества с общей формулой СпН2n-2: относят к классу
а) алканов б) алкинов в) алкенов г) аренов
62. Гомологом этана является
а) С2Н4, б) (СН2)3 в) С6Н6 г) СН3-СН2-СН3
63. Наиболее распространенный вид химической связи между атомами углерода в органических веществах
а) ионная б) ковалентная неполярная б) ковалентная полярная г) металлическая
64. При взаимодействии пропилена с бромводородом получается
а) 1-бромпропан б) 1,1-дибромпропан в) 2-бромпропан, г) 2-дибромпропан
65. Для алкенов наиболее характерны реакции
а) замещения б) обмена в) присоединения г) дегидратации
66. Свежеосажденный гидроксид меди (II) взаимодействует с
а) этиленгликолем б) этанолом в) бензолом г) этеном
67. Гомологом 2-метилпентена-1 является
а) СН3-СН-СН2-СН3 б) СН3-СН2-С= СН2 в) СН3 — (СН2)4 -СН3 г) СН3-СН2-СН=СН-СН3
I I
СН3 СН3
68. Гексахлорциклогексан образуется в результате реакции присоединения
а) Сl к бензолу б) Сl к циклогексану в) Н Сl к бензолу г) Сl к гексану
69. При присоединении брома к пропилену образуется
а) 1,3-дибромпропан б) 1.1-дибромпропан в) 2.2-дибромпропан г) 1,2-дибромпропан
70. Полиэтилен получают, используя реакцию
а) гидрирования б) изомеризации в) поликонденсации г) полимеризации
71. Элементарным звеном бутадиенового каучука является
а) -CH2-CH=CH-СН2- б) -CH2=CH-CH=СН2- в) -CH2-CH2 - СH2-СН2- г) -CH2-CH2 -
72. Тип реакции взаимодействия этилена с бромом
а) замещение б) гидрирование в) присоединение в) дегидратация
73. Уравнение реакции получения ацетилена в лаборатории
а) С2 Н5 ОН -► С2:Н4 +Н2О б) СаС2+2Н3О -►С2Н2 +Са(ОН)2
в) С2Н2:+ Н2О -►СН3СНО г)2СН2 -►С2Н2 +3H2
74. Ацетилен не может реагировать с а) водородом б) кислородом в) водой г) метаном
75. Структурное звено полипропилена
а) СН3-СН= СН2 б) -СН2 — СН2 в)-СН—СН2- г) СН2= СН2
I
СН3
76. Вещество, формула которого СН3—СН2—С= СН2 называется
I
СН3
а) 3-метидбутан б) 2-метилбутан в) З-метилбутен-3 г) 2-метилбуген-1
77. С раствором перманганата калия реагируют
а) пропан и хлорзтан б) этилен и ацетилен в) этан и циклогексан г) этилен и бензол
78. Число изомеров углеводорода С5 Н12 равно а) 1 б) 2 в) 3 г) 4
79. Коэффициент перед формулой кислорода «уравнении реакции горения этана равен
а) 3 б) 5 в) 7 г) 9
80. Этилен гндратируют с целью получения
а) спирта б) простого эфира в) альдегида г) карбоновой кислоты
81. В нециклической форме глюкозы функциональные группы
а)—С = О и—С = О б) —ОН и — С = О в) —ОН и — С = О г) - С = О и — NH2
| | | | |
Н ОН Н ОН Н
82. С раствором перманганата калия и бромной водой реагируют
а) СзН6 и СзН7С1 б) С2Н4 и С2Н2 в) С2Н6 и С6Н6 г) С2Н4Вг2 и С2Н4
83 .Характерным типом химической реакции для веществ, имеющих формулу Сn Н2n+2, является
а) гидрирование б) замещение в) дегидратация г) присоединение
84. При добавлении к некоторому органическому веществу свежеосажденного гидроксида меда (II) и нагревании образовался красный осадок. Это органическое вещество
а) фенол б) формальдегид в) этилен г) уксусная кислота
85. К природным высокомолекулярным соединениям относится
а) полиэтилен б) глюкоза в) клетчатка г) сахароза
86. Гомологом этана является
а) С2Н4 б) (СН2)3 в) С6Н6 г) СН3—СН2—СН3
87. В схеме превращений - Н2О
(С6Н1005)n ® Х ® С2Н5ОН ® Y ® (—СН2—СН2—)п веществами X и Y могут быть
а) X — этилен; Y — этан б) X — пропанол; Y —- этилен
в) X — глюкоза; Y — этилен г) X — глицерин; Y — ацетилен
88. Метилацетат можно получить при взаимодействии
а) метанола с муравьиной кислотой б) этанола с муравьиной кислотой
в) метанола с уксусной кислотой г) этанола с уксусной кислотой
89. Вещество, формула которого С6 Н6, относится к классу
а ) алканов б) алкинов в) алкенов г) аренов
90. Изомером бутанола-1 является
а) СН3—СН(ОН)—СН2-ОН б) СН3—О—С3Н7
в) СН3—СН(ОН)—(СН2)2—СН3 г) СН3—(СН2)2—СН2—ОН
91. Веществами X и Y в схеме превращения
+Х +Y
С2Н6 ® С2Н5С1 ® С2Н5ОН могут быть
а) Х—НС1; Y —КОН б) X--CL2; Y —КОН (водн, р-р)
в) Х —HCL; Y —Н2О г) Х—Na CL; Y —Н2О
92. Полиэтилен получают, используя реакцию
а) гидрирования б) изомеризации в) поликонденсации г) полимеризации
93. Бутадиен относится к классу веществ, общая формула которого
а) Сп Н2п+2 б) Сп Н2n-2 в) СпН2п г) Сn Н2п+1ОН
94. При окислении пропаналя образуется
а) СН3—СН2—СООН б) СН3—СН2—СНО
в) СН3—СН2—СН2—СООН г) СН3—СН2—СН2—СНО
95. Реакцию с гидроксидом меди (II) можно использовать для обнаружения
а) циклогексана б) пропанола в) глюкозы г) фенола
96. В основе применения ацетилена для сварки и резки металлов лежит химическая реакция
а) СаС2 + 2Н2 О = С2Н2 + Са(ОН)2 б) 2СН4 ® С2Н2 + ЗН2
в) С2Н2 + Н2 ® С2Н4 г) 2С2Н2 + 5О2 ® 4СО 2 + 2Н2О
97. Если к СНзСООН прилить СНзОН, конц. H2SО4 и смесь нагреть, то образуется
а) этилформиат б) этилацетат в) метилацетат г) химическая реакция не протекает
98. Веществами X и Y в схеме превращений
+Х +Y
С3Н8 ® С3Н7Вг ® С3Н7ОН являются
а) X — НВг; Y — NaOH (p-p) б) X—Br2 Y—Н2 О
в) X — НВг; Y — Cu(OH)2 г) Х— Вг2 Y —Cu(OH)2
99. Гомологом ацетилена не является
а) НС≡С—СН2—СНз б) СН2=СН—СНз в) СН3—С≡СН г) СН≡С—СН2—СН2 СН3
100. В схеме превращений
+Х +Y
СН3С=О ®ОН3 СООН ® СН2—СООН
| |
Н С1 веществами X и Y могут быть
а) Х— [О]; Y —С12 б) Х —Н2 Y—С12
в) Х —[О]; Y —HC1 г) Х—Н2 Y—НС1
101. С раствором перманганата калия и бромной водой реагируют
а) С3Н6 и С3 Н7С1 б) С2Н4 и С2Н2 в) С2:Н6 и С,Н г) C2H4 Br2 и С2 Н4
102. При взаимодействии пропилена с бромводородом получается
а) 1-бромпропан б) 1,1-дибромпропан в)2-бромпронап г) 2,2-дибромпропан
103. Тип реакции взаимодействие этилена с бромом
а) замещение б) гидрирование в) присоединеннс г) дегидратация
104. Деметил пропан относится к классу углеводородов, общая формула которого
а) CnH2 n +2 б) CnH2 n в) CnH2 n -2 г) CnH2 n +1
105. Тип реакции взаимодействия этилена с бромом
а) замещение б) гидрирование в) присоединение г) дегидратация
106. Уравнение реакции получения ацетилена в лаборатории
а) С2 H5 OH -► C2 Н4 +Н2 О б) СаС2 :+2Н2 О -► С2 H2 +Са(ОН)2
в) С2 H2 + Н2 О-► СН3 СНО г) 2СН4 -► С2 H2 +3Н2
107. Этилен гндратируют с целью получения
а) спирта б) простого эфира в) альдегида г) карбоновой кислоты
108. При присоединении брома к пропилену образуется
а) 1.3-дибромпропан б) 1.1.-дибромпропан в) 2.2-дибромпропан г) 1.2-дибромпропан
109. Свежеосажденный гидроксид меди (II) взаимодействует с
а) этиленгликолсм б) этанолом в) бензолом г) этеном
110. Гомологом СН3- СН2 СН2 -CH=СН2 является
а) пентен-2 б) 2-метилбутен-1 в) гексен-1 г) 2-метилбутан
111. Бромбензол образуется в результате реакции замещения при взаимодействии
а) бензола с бромом б) толуола с бромом
в) бензола с бромводородом г) толуола с бромводородом
112. Органическим веществом, при пропускании которого через бромную воду раствор обесцвечивается, является а) метан б) пропилен в) хлорметан г) этан
113. Ацитилен не может реагировать с а) водородом б) кислородом в) водой г) метаном
114. Вещество, формула которого СН3—СН2 —С =СН2, называется
I
СН3
а) 3-мегилбутан б) 2-метилбутан в) З-метилбутен-3 г) 2-метилбутен-1
115. С раствором перманганата калия реагируют
а) пропан и хлорзтан б) этилен и ацетилен в) этан и циклогексан г) этилен и бензол
116. Характерным типом химической реакции для веществ, имеющих форму является:
а) гидрирование б) замещение в) дегидратация г) присоединение
117. Пентем можно отличить от пентона с помощью любого из реактивов
а) раствор перманганата калия и гидроксид меди (II) б) оксид серебра гидроксид меди ((I)
в) бромная вода и оксид меди (II) г) бромная вода и раствор перманганата калия
118. Пропанол-2 имеет формулу
а) СН3-СН— СН3 б) СН3 -СН2-СН2-ОН в) СН3-СН2 -СН2-ОН г) СН3-СН2 -СООН
I
ОН
119. Формальдегид вступает в реакцию с
а) аммиачным раствором оксида серебра б) этанолом
в) соляной кислотой г) водным раствором хлорида натрия
120. Структурным звеном полиэтилена является
а) СН3-СН=СН2 б) -СН2-СН2- в) -СН-СН2- г) СН2=СН2
I
СН
121. Гомологами являются
а) С2 Н6 и С2Н4 б) Н— СН = О и СНзСООН
в) СН3— СН2— СН2— ОН и НО— СН2— СН3 г) СНз— NO2 и СН3— NH2
122. При бромировании фенола избытком брома образуется
а) 2-бромфенол б) 2,3-дибромфенол в) 2, 5-дибромфенол г) 2, 4, 6-трибромфенол
123. Веществом Х4 в схеме превращений
+Br2,t +H20 +[0] +Ag2О
С2Н6 ® X1 ® Х2 ® Х3 ® Х4
(NaOH)
является а) альдегид б) кетон в) первичный спирт г) карбоновая кислота
124. Ацетилен получают одностадийно из
а) карбида кальция б) карбоната кальция в) углерода г) гидроксида кальция
125. Для проведения реакции С2Н2 + НОН ® СН3СНО необходимо
а) добавить щелочь б) использовать раствор сульфата ртути (II) и кислоты
в) увеличить концентрацию ацетальдегида г) уменьшить концентрацию ацетилена
126. Вещество, формула которого СН3СН2ОН, является
а) алканом б) спиртом в) альдегидом г) карбоновой кислотой
127. Формула изомера пропионовой кислоты ОН
а) СН3—С=О б) СНз—С = О в) СНз—СН—С = О г) СН3СН2О - С = О
ОН О - СН3 СН3 ОН
128. Веществами X и Y в схеме превращения
+Х +Y
С2Н5С1 ® С2Н5ОН ® C2H5ONa могут быть
а) Х—КОН; Y—NaCl б) Х—Н2 О; Y—NaOH
в) X — КОН (водн. р-р); Y — Na г) Х—О2 Y—Na
129. Формула фенола
а) С6Н13ОН б) С6Н5ОН в) C6H5NH2 г) С6Н5NO2
130. Водородная связь не образуется между молекулами
а) карбоновых кислот б) нуклеиновых кислот в) спиртов г) алкинов
131. При взаимодействии анилина с избытком бромной воды образуется
а) 2,4,6-трибромбензол б) 2,4,6-триброманилин в) 2,5-диброманилин г) 2-броманилин
132. Реактивом на глицерин является
а) бромная вода б) хлороводород
в) аммиачный раствор Ag2O г) гидроксид меди (II) (свежеприг.)
133. К классу углеводов относится вещество, формула которого
а) С6Н5ОН б) СН3—(СН2)4—СООН в) С6Н1206 г) С3Н7—О—С3Н7
134. Наличие альдегидной группы в органическом веществе можно установить с помощью
а) бромной воды б) индикатора — лакмуса
в) аммиачного раствора Ag2О г) гидроксида натрия
135. Органическим веществом, при добавлении которого к раствору перманганата калия раствор обесцветится, является а) циклогексан б) гексанол-1 в) бензол г) гексин
136. К природным высокомолекулярным соединениям относится
а) полистирол б) сахароза в) целлюлоза г) капрон
137. В результате реакции поликонденсации может образоваться
а) полипропилен б) полистирол в) бутадиенстирольный каучук г)фенолформальдегидная смола
138. При горении метиламина образуются углекислый газ и
а) аммиак и водород б) азот и водород в) аммиак и вода г) азот и вода
139. Вещества с общей формулой СnН2n-2 могут относиться к классам
а) алкинов и алкенов б) алкинов и алкадиенов
в) алкенов и алкадиенов г) алкенов и циклопарафинов
140. Изомерами являются
а) метилбензол и фенол б) этилацетат и масляная кислота
в) хлорэтан и дихлорэтан г) бутан и 2,2-диметилпропан
141. Вещества с общей формулой CnH2n относят к классу
а) алканов б) алкинов в) алкенов г) аренов
142. Гомологом этана является а) С2Н4 б) (СН2)3 b)C6 H6 г) СH3 -СH2 -СH3
143. Наиболее распространенный вид химической связи между атомами углерода в органических веществах
а) ионная б) ковалентная неполярная б) ковалентная полярная г) металлическая
144. При взаимодействии пропилена с бромводородом получается
а) I-бромпропан б) 1,1-дибромпропан в) 2-бромпроиан г) 2,2-дибромпропан
145. Для алкенов наиболее характерны реакции
а) замещения б) обмена в) присоединения г) дегидратации
146. Гомологом 2-метилпентена-1 является
а) Н3-СН-СН2-СН3 б) СН3-СН2-С= СН2 в) СН3-( СН2)4-СН3 г) СН3 -СН2 -СН=СН-СН3
I I
СН3 СН3
147. Гексахлорциклогексан образуется в результате реакции присоединения
а) хлора к бензолу б) хлора к циклогексану
в) хлорводорода к бензолу г) хлора к гексану
148. Веществами X и Y в схеме превращений
+Х +Y
С2 Н6------► С2 Н5Cl------► С2 Н5ОН
а) Х-НCI.Y-KOH б) Х-СI2 Y-KОН (водн.p-p) в) Х-НC1.Y-H2О г) Х-NaCl.Y-H2О
149. Полиэтилен получают, используя реакцию
а) гидрирования б) изомеризации в) поликонденсации г) полимеризация
150. Элементарным звеном бутадиенового каучука является
а) -СН2 - СН= СН -СН2 - б) СН2 = СН- СН= СН2 - в) -СН2-СН2-СН2-СН2- г) -СН2-СН2-
151. Тип реакции взаимодействия этилена с бромом
а) замещение б) гидрирование в) присоединение г) дегидратация
152. Уравнение реакции получения ацетилена в лаборатории
а) С2 Н5 ОН ----►С2 Н4 +Н2О б) СаС2+2Н2 О ----► С2Н2 +Са(ОН)2
в) С2 Н2 +Н2О ----►СН3СНО г) 2СН4 ----► С2 Н2 + 3Н2
153. Ацетилен не может реагировать с
а) водородом б) кислородом в) водой г) метаном
154. Структурное звено полипропилена
а) СН3-СН=СН2 б)-СН2 —СН2 - в)-СН—СН2- г) СН2 =СН2
I
СН3
155. Вещество, формула которого СН3—СН2—С=СН2. называется
I
СН3
а) 3-метилбутан б) 2-метилбутан в) З-метилбутен-3 г) 2-метилбутен-1
156. С раствором перманганата калия реагируют
а) пропан и хлорэтан б)этилен и ацетилен в) этан и циклогексан г) этилен и бензол
157. Число изомеров углеводорода C5 H12 равно
а) 1 б) 2 в) 3 г) 4
158. Коэффициент перед формулой кислорода в уравнении реакции горения этана равен
а) 3 б) 5 в) 7 г) 9
159. Этилен гидратируют с целью получения
а) спирта б) простого эфира в) альдегида 4) карбоновой кислоты
160. При присоединении брома к пропилену образуется
а) 1,3-дибромпропан б) 1,1-дибромпропан в) 2.2-дибромпропан г) 1 ,2-дибромпропан












