Просмотр содержимого документа
«Технологическая карта к уроку "Азотная кислота"»
| HNO3 - Азотная кислота 

Опытным путём доказано, что в молекуле азотной кислоты между двумя атомами кислорода и атомом азота две химические связи абсолютно одинаковые – полуторные связи. Степень окисления азота +5, а валентность равна IV. Физические свойства Азотная кислота HNO3 в чистом виде - бесцветная жидкость с резким удушливым запахом, неограниченно растворимая в воде; t°пл.= -41°C; t°кип.= 82,6°С, r = 1,52 г/см3. В небольших количествах она образуется при грозовых разрядах и присутствует в дождевой воде. N2 + O2 грозовые эл.разряды→ 2NO 2NO + O2 → 2NO2 Получение 1. Лабораторный способ KNO3 + H2SO4(конц) → KHSO4 + HNO3 (при нагревании) 2. Промышленный способ Осуществляется в три этапа: a) Окисление аммиака на платиновом катализаторе до NO 4NH3 + 5O2 → 4NO + 6H2O (Условия: катализатор – Pt, t = 500˚С) б) Окисление кислородом воздуха NO до NO2 2NO + O2 → 2NO2 в) Поглощение NO2 водой в присутствии избытка кислорода 4NO2 + О2 + 2H2O ↔ 4HNO3 или 3NO2 + H2O ↔ 2HNO3+NO (без избытка кислорода) Применение в производстве минеральных удобрений; в военной промышленности; в фотографии — подкисление некоторых тонирующих растворов; в станковой графике — для травления печатных форм (цинкографических типографских форм и магниевых клише). в производстве взрывчатых и отравляющих веществ.
Химические свойства
|
Очень сильная кислота. Индикаторы в её растворе изменяют цвет на красный. Диссоциирует в водном растворе практически нацело:
HNO3 → H+ + NO3-
Реагирует с основными оксидами
K2O + 2HNO3 → 2KNO3 + H2O
K2O + 2H+ + 2NO3- → 2K+ + 2NO3- + H2O
K2O + 2H+ → 2K+ + H2O
Реагирует с основаниями
HNO3 + NaOH → NaNO3 + H2O
H+ + NO3- + Na+ + OH- → Na+ + NO3- + H2O
H+ + OH- → H2O
Реагирует с солями, вытесняет слабые кислоты из их солей
2HNO3 + Na2CO3 → 2NaNO3 + H2O + CO2
2H+ + 2NO3- + 2Na+ + СO32- → 2Na+ + 2NO3- + H2O + CO2
2H+ + СO32- → H2O + CO2
СПЕЦИФИЧЕСКИЕ СВОЙСТВА АЗОТНОЙ КИСЛОТЫ
Самое характерное свойство азотной кислоты — это её ярко выраженная окислительная способность. Сильным окислителем она является за счёт атома азота в степени окисления +5.
Например, при взаимодействии азотной кислоты с металлами образуются нитрат металла, продукт восстановления азотной кислоты (X) и вода.
Это можно представить в общем виде, как:
Me + HNO3 → MeNO3 + X + H2O (здесь Ме — одновалентный металл).
Азотная кислота - сильный окислитель
N+5 → N+4→ N+2→ N+1→ No → N-3
N+5 + 8e-→N-3 окислитель, восстанавливается.
Состав продукта восстановления азотной кислоты (Х) зависит от многих факторов, но прежде всего от концентрации кислоты в растворе и от природы металла. 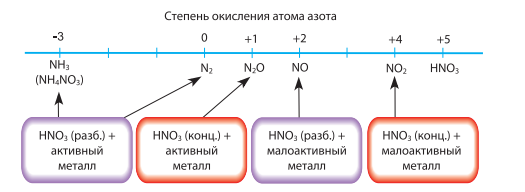
Под действием света, при нагревании азотная кислота частично разлагается с выделением NО2 и за cчет этого приобретает светло-бурый цвет:
4НNО3 свет→ 4NО2↑(бурый газ) + 2Н2О + О2
Азотная кислота окисляет многие органические вещества. Бумага и ткани разрушаются вследствие окисления образующих эти материалы веществ.
Концентрированная азотная кислота вызывает сильные ожоги при длительном контакте и пожелтение кожи на несколько дней при кратком контакте. Пожелтение кожи свидетельствует о разрушении белка и выделении серы.





















