| Тема урока. Кислородные соединения углерода | Тип урока: комбинированный: усвоение новых знаний и умений на основе раннее полученных предметных знаний и умений. |
|
| Цели. Обучающие. Цель: изучить состав, строение и свойств соединений углерода с целью осознанного применения соединений углерод в жизни, используя знания о свойствах изученных соединений углерода. Развивающие: Воспитательные: |
|
| Задачи урока: Обучающие:
Используя знания учащихся о веществах и их строении, определить возможные кислородные соединения углерода, их состав, строение, выдвинуть предположение о их физических и химических свойствах. Доказать на практике справедливость вдвинутых предположений о физических и химических свойствах соединений углерода. Исходя их жизненного опыта, перечислить области применения кислородных соединений углерода. Объяснить какие свойства изученных веществ лежат в основе их применения. Продолжить формирование умения структурировать изучаемый материал. Развивающие: .Развивать познавательную деятельность и самостоятельность в получении знаний учащимися через наблюдение демонстрационного эксперимента и проведение лабораторных опытов. Формировать умения наблюдать, анализировать, обобщать в ходе самостоятельного проведения лабораторного эксперимента. Формировать умение логически последовательно формулировать выводы из сделанных наблюдений. Воспитательные: Формирование самостоятельности и ответственности за результат выполнения эксперимента, Формирование навыка сотрудничества в ходе выполнения эксперимента. Развитие навыков самооценки. |
|
| Организация деятельности учащихся на уроке: фронтальная, парная, индивидуальная.
|
|
| Планируемые результаты урока: |
| Предметные. Знать/понимать: 1.1 Химическую символику: формулы: водородного соединение углерода-метана, оксида углерода (II) и оксида углерода (IV). 1.2 Способы получения, свойства и применение перечисленных соединений. 2.Уметь: 2.1 Называть изученные вещества по их химическим формулам; 2.2 Характеризовать: физические свойства оксидов углерода; химические свойства оксида углерода (IV) (как типичного кислотного оксида); 3. Определять: 3.1 Принадлежность оксидов углерода к определённому классу соединений; степень окисления атома углерода и тип химической связи в оксидах; 4. Составлять: 4.1 уравнения химических реакций, характеризующие свойства оксида углерода (IV); 5. Распознавать опытным путём: углекислый газ среди других газов; | Метапредметные Уметь: 1. Наблюдать 2.Фиксировать результаты наблюдений; 3. Делать выводы из результатов наблюдений. 4. Аргументировать свой ответ. | Личностные Овладение: 1. Навыками выполнения экспериментальной работы по инструкции; 2. Навыками постановки цели, навыками планирования своей деятельности для достижения этой цели. 3. Использовать приобретённые знания в практической деятельности и повседневной жизни для: безопасного обращения с оксидом углерода (II) и углекислым газом.. |
| Ресурсы урока: Интерактивная доска, проектор, беспроводная мышка; Периодическая система химических элементов; Реактивы и оборудование для проведения демонстрационных и лабораторных опытов; Презентации: - интерактивный тест по теме углерод; - таблицы: физические свойства оксидов углерода и оформление лабораторного опыта. Видеофрагмент «Взаимодействие горение магния в углекислом газе» электронный адрес: https://youtu.be/Oj9QAow3LC8 Реактивы и оборудование для проведения лабораторного опыта. 7. Раздаточный материал с цепочкой переходов. 8. Учебники. Тетради. |
| Основные этапы урока 1.Организационный этап . 2. Этап актуализации знаний. 3.Этап постановки цели и задач урока. Мотивация учебной деятельности учащихся. 4. Этап изучения новых знаний и способов деятельности 5.Этап обобщения и систематизации (слово учителя) 6.Этап контроля и самоконтроля: выполнение заданий.. 7. Этап коррекции знаний. (Ответы на вопросы учащихся по теме) 8.Этап информации о домашнем задании 9..Этап рефлексии (оценить на сколько полезна для вас полученная на уроке информация) |
|
I. Организационный момент – 1 мин. 1. Приветствие учащихся. 2. Контроль готовности учащихся к уроку: наличие учебных принадлежностей, подготовка рабочего места. |
|
II. Актуализация знаний. 3 мин.
|
| Содержание деятельности учителя | Содержание деятельности учащихся | Форма работы учащихся | Результат |
3 |
| 1. Учитель предлагает учащимся вспомнить материал, изученный на предыдущих уроках: - учащиеся выполняют интерактивный тест по теме «Углерод». Слайды №№ 1-31
| Учащиеся по очереди отвечают на вопросы теста. | Фронтальный опрос | Повторение предыдущего материала |
|
III .Этап постановки цели и задач урока. Мотивация учебной деятельности учащихся – 3 мин.
|
|
| Содержание деятельности учителя | Содержание деятельности учащихся | Форма работы учащихся | Результат |
|
| Слово учителя. 1. Кто запомнил, какие бинарные соединения упоминались в тексте? Предполагаемый ответ: метан, ацетилен, оксид углерода (II), оксид углерода (IV). 2. Учитель предлагает определить признак, по которому можно классифицировать эти вещества. Предполагаемый ответ: наличие атомов водорода и кислорода в составе веществ. 3. Учитель записывает схему классификации на доске. Слово учителя. Метан и ацетилен относятся к органическим соединениям. Изучением их свойств и их использование человеком в своей жизнедеятельности будем изучать в IV четверти, а изучение кислородосодержащих соединений углерода и будет целью нашего урока. 3. Учитель предлагает выдвинуть предположения: зачем люди изучают эти соединения? Стоит ли тратить на это время? 4. Учитель предлагает сделать вывод из всего выше сказанного. | 1. Учащиеся отвечают на вопросы.
2. Учащиеся высказывают свои предположения.
3. Учащиеся формулируют вывод. |
Фронтальный опрос | Оформление темы урока в тетрадь.. |
3 |
|
4.Этап изучения новых знаний и способов деятельности – 29 мин | Время |
| 1. Запишите тему урока. Кислородные соединения углерода. Учащимся предлагается записать тему урока в тетради. Слово учителя. Нахождение оксидов углерода в природе.
| Работа в тетради. Записывают тему урока. Работа учащихся в тетради 1. Учащиеся конспектируют |
Индивидуальная работа | Формулировка вывода: нахождение СО2 в природе. | 3
|
| Содержание деятельности учителя | Содержание деятельности учащихся | Форма работы учащихся | Результат |
|
|
2. Учитель предлагает следующий пункт плана по изучению этих веществ. Физические свойства оксидов углерода.
3. Учитель демонстрирует ряд экспериментов, демонстрирующих получение и физические свойства оксидов углерода (IV). 4. Химические свойства оксида углерода (IV) Учитель просит описать наблюдаемые явления 4.1. Получение углекислого газа действием соляной кислотой на карбонат кальция. (Получение углекислого газа проводится в аппарате Киппа). Учитель записывает уравнение реакции. 4.2. На столе стоит стакан, учитель заполняет его водой и пропускает через воду газ. 4.3. На столе стоят два стеклянных стакана объемом 100 мл. Один из них заполняют углекислым газом, а второй оставляют без изменений. 4 Подготавливают тлеющую лучину и подносят по очереди сначала в пустому стакану, а потом с к стакану, заполненному углекислым газом. УЧИТЕЛЬ объявляет, что вторую часть таблицы учащиеся заполнят дома, изучив параграф 34.
5. Химические свойства углекислого газа. Опыт №1. I. 1. Взаимодействие углекислого газа с водой. В пять стаканов наливают: 1-вода , 2-раствор гидроксида натрия 3-раствор соляной кислоты В каждую пробирку добавляют лакмус. Учитель обращает внимание учащихся на изменение цвета растворов. II. Через воду в 1–ом стакане учитель пропускает углекислый газ.
Опыт №2. 1. В стакан учитель наливает раствор гидроксида натрия и добавляет несколько капель фенолфталеина. 2. Через полученный раствор пропускается углекислый газ.
| материал в тетрадь. 2. Оформляют таблицу по образцу. (слайд) № 51
4. Наблюдают и фиксируют наблюдения 4.1 К доске вызывается ученик записать уравнение реакции, получения углекислого газа. 4.2-4.4. Учащиеся наблюдают, отвечают на вопросы учителя и заполняют таблицу. Ответы учащихся вносятся в таблицу. Сверяют записи в тетради с записями на доске. Слайд 52
5.1 . Учащиеся наблюдают изменение цвета растворов и делают вывод о кислотном характере раствора углекислого газа в воде. * К доске вызывается ученик записать уравнение реакции, отражающее данное явление.
5.2 Учащиеся наблюдают обесцвечивание раствора, делают вывод, что о том, что углекислый газ взаимодействует со щелочами. * К доске вызывается ученик записать уравнение реакции, отражающее данное явление. |
Фронтальная беседа.
Индивидуальная работа и парная работа
Фронтальная беседа. |
Заполнение таблицы
Составление конспекта |
3
5
6 |
| 6. Повторение основных правил по ОТ. Учитель предлагает учащимся самостоятельно выполнить лабораторный опыт по изучению взаимодействия углекислого газа с известковой водой. По инструкции. Лабораторный опыт №38 . Учебник стр. 246 Учащимся предложено найти в учебнике уравнения реакций , отражающих данное явление. | Выполнение лабораторных опытов.
| Парная работа
| Формулировка цели | 8 |
| Содержание деятельности учителя | Содержание деятельности учащихся | Форма работы учащихся | Результат |
|
| 4. Учитель записывает соответствующие уравнения химических реакций для того, чтобы учащиеся могли проверить правильность выполнения работы. Напоминает учащимся о способности многоосновных кислот образовывать кислые соли.
| 6. Учащиеся выполняют лабораторный опыт № 38 и заполняют свои наблюдения в таблицу. Слайд № 52. * Учащиеся наблюдают выпадение осадка и дальнейшее его растворение. *Записывают уравнение реакции и названия веществ. *Учащиеся выполняют оформление лабораторного опыта *проверяют правильность записи уравнений. | Парная работа
| Формулировка цели |
|
| Опыт № 4. Просмотр видео фрагмента. Горение магния в оксиде углерода (IV) | 7. Учащиеся т и записывают уравнения реакции и схему электронного баланса, определяют окислитель и восстановитель. |
|
| 4 |
| V. Этап обобщения и систематизации (слово учителя) | 1 |
| VI. Этап контроля и самоконтроля:. Учитель предлагает учащимся все закрыть, раздает карточки с цепочкой перехода, ставит перед учащими задачу: предложить способ выполнения этой цепочки.(Учащиеся должны только предложить вариант перехода от одного вещества к другому, записывать уравнение реакции не нужно. CaCO3-CaO-Ca(OH)2-CaCO3-Ca(HCO3)2-CaCO3
| Учащиеся выполняют задание.
|
3 |
| VII.Этап коррекции, исправления ошибок и подведения итогов. Учитель проверяет записи учащихся. | Учащиеся сверяют свои ответы с записью на доске. | 1 |
|
VIII.Этап информации о домашнем задании: |
| Параграф 34, 1. На основе информации учебника закончить заполнение таблицы о физических свойствах оксида углерода (II) 2. Упр. 6 (а) стр 249 закончить запись уравнений реакций: для окислительно -восстановительных записать схемы электронного баланса, для реакций ионного обмена необходимо записать уравнения реакций в молекулярном и ионном виде. | Учащиеся записывают задание в дневник. | 2 |
| IX. Этап рефлексии |
|
| Учитель предлагает учащимся (оценить на сколько полезна для них полученная на уроке информация) | Обмен мнениями. | 2 |
Тест.
1. В оксид содержится CO2 атмосфере углерода (IV).
2. Это образуется при топлива соединение дыхании и сгорании, а также при органических гниении веществ.
3. Поэтому углекислого в сельской газа вблизи заводов, концентрация в конечно же выше городской магистралей местности, фабрик и транспортных , в воздухе, чем местности.
4. Гораздо и океанов газа больше, чем в водах содержится в воздухе, углекислого морей.
5. При называют угольной образуется растворении оксида углерода в воде угольная угольный кислота, поэтому СО2 еще ангидрид или ангидрид кислоты.
ПРИЛОЖЕНИЕ. №1
3. Стр. 247 упр. 6 (а)
4. Закончить оформление лабораторного опыта







 Адсорбции
Адсорбции 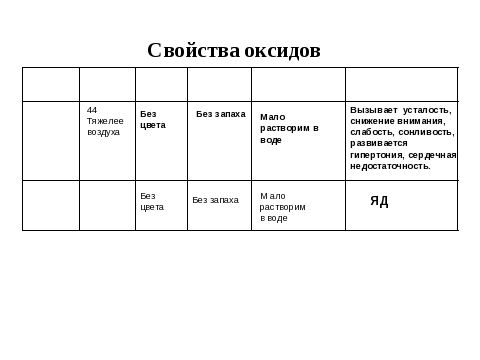 ПРИЛОЖЕНИЕ №2
ПРИЛОЖЕНИЕ №2










