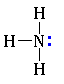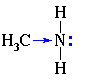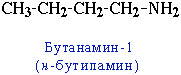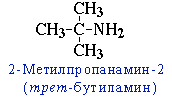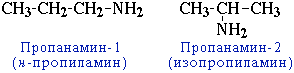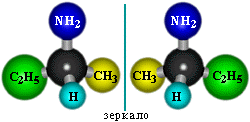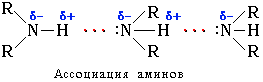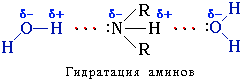Урок 1. Амины.
Содержание урока:
- определение класса;
- классификация аминов;
- строение;
- структурная изомерия и номенклатура аминов;
- первичные насыщенные амины, общая формула, функциональная группа первичных аминов, её электронное строение;
- физические свойства.
В органической химии существуют соединения, в состав которых, кроме углерода, кислорода, водорода, входит азот. Такие соединения относят к азотсодержащим органическим соединениям. Они классифицируются в зависимости от состава и строения.
Видео
https://www.youtube.com/watch?v=AH92Kp5CJug&nohtml5=False
Амины – азотсодержащие органические вещества, производные аммиака (NH3), в молекулах которых один или несколько атомов водорода замещены на углеводородный радикал (- R или – CnH2n+1).
Классификация аминов:
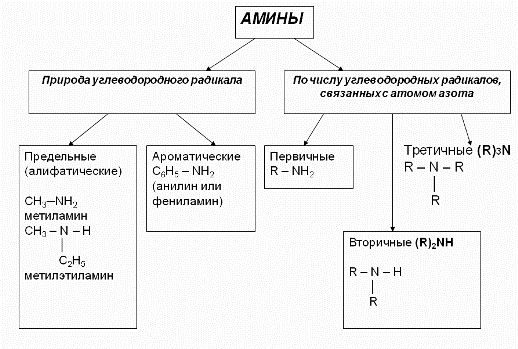
Существуют также четвертичные соли и основания, которые можно рассматривать как производные катиона аммония (не аммиака!), в котором все четыре атома водорода замещены на углеводородные группы:
[(CH3)4N]+Br– – четвертичная аммониевая соль;
[(CH3)4N]+ОН– – четвертичное аммониевое основание.
Также амины могут быть насыщенными (R – остатки алканов или циклоалканов) или ненасыщенными (R – остатки алкенов, алкинов или циклоалкенов). По природе углеводородных заместителей: алифатические, алициклические, ароматические и смешанные. По числу аминогрупп – на моноамины, диамины и т.п.
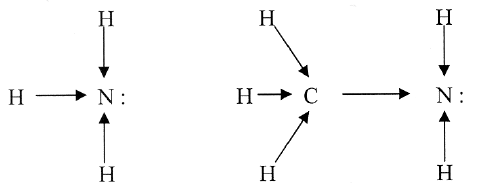
Строение. Амины – производные аммиака, поэтому, подобно аммиаку. Их молекулы имеют пирамидальное строение.
Как и в молекуле аммиака, атом азота в составе аминов содержит неподеленную электронную пару:
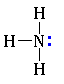
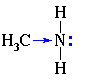
Наличие неподеленной пары электронов, способной к образованию связи с ионом Н+ по донорно-акцепторному механизму (подобно молекуле аммиака), обусловливает свойства аминов как органических оснований.
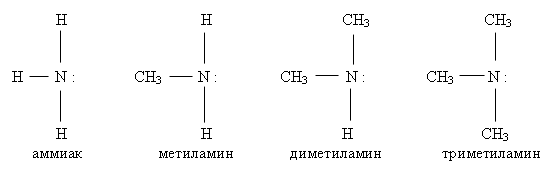
Амины – производные алканов – боле сильные основания, чем аммиак. Они отличаются от аммиака только углеводородными радикалами, которые, очевидно, оказывают влияние на атом азота.
Радикал отталкивает электронную плотность, следовательно электронная плотность на атоме азота в амине больше, чем в молекуле аммиака. Значит, амин сильнее притягивает к себе протоны воды и кислот, то есть является более сильным основанием.
Структурная изомерия
- углеродного скелета, начиная с С4H9NH2:
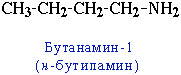

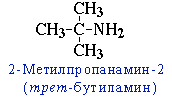
- положения аминогруппы, начиная с С3H7NH2:
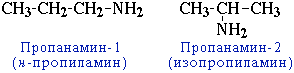
- изомерия аминогруппы, связанная с изменением степени замещенности атомов водорода при азоте, т.е. между типами аминов:
Пространственная изомерия. Возможна оптическая изомерия, начиная с С4H9NH2:
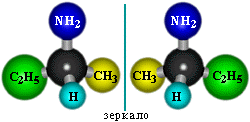
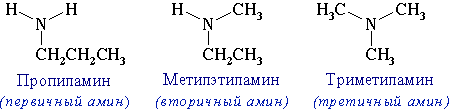
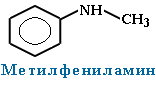
Номенклатура. Систематические названия образуют из названий углеводородных радикалов и суффикса амин.
CH3-NH2 Метиламин
CH3-CH2-NH2 Этиламин
Различные радикалы перечисляются в алфавитном порядке.
CH3-CH2-NH-CH3 Метилэтиламин
При наличии одинаковых радикалов используют приставки ди и три.
(CH3)2NH Диметиламин
Первичные амины часто называют как производные углеводородов, в молекулах которых один или несколько атомов водорода замещены на аминогруппы -NH2. В этом случае аминогруппа указывается в названии суффиксами амин (одна группа -NH2), диамин (две группы -NH2) и т.д. с добавлением цифр, отражающих положение этих групп в главной углеродной цепи.
Например:
CH3-CH2-CH2-NH2 пропанамин-1
H2N-CH2-CH2-CH(NH2)-CH3 бутандиамин-1,3
Насыщенные первичные амины.
Общая формула – CnH2n+1– NH2
Функциональная группа – NH2 (основные свойства определяет неподеленная электронная пара атома азота).
Физические свойства.
Видео
https://www.youtube.com/watch?v=O0h2OrmIOC8&nohtml5=False
Амины широко распространены в природе, так как образуются при гниении живых организмов. Например, с триметиламином вы встречались неоднократно. Запах селедочного рассола обусловлен именно этим веществом. Обиходное словосочетание “трупный яд”, встречающиеся в художественной литературе, связано с аминами.
Метиламин, диметиламин и триметиламин — газы, средние члены алифатического ряда - жидкости, высшие — твердые вещества. Низшие амины имеют характерный «рыбный» запах, высшие не имеют запаха.
Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).
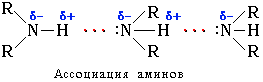
Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:

Третичные амины не образуют ассоциирующих водородных связей (отсутствует группа N–H). Поэтому их температуры кипения ниже, чем у изомерных первичных и вторичных аминов (триэтиламин кипит при 89 °С, а н-гексиламин – при 133 °С).
По сравнению со спиртами алифатические амины имеют более низкие температуры кипения (т. кип. метиламина -6 °С, т. кип. метанола +64,5 °С). Это свидетельствует о том, что амины ассоциированы в меньшей степени, чем спирты, поскольку прочность водородных связей с атомом азота меньше, чем с участием более электроотрицательного кислорода.
При обычной температуре только низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха. Ароматические амины – бесцветные высококипящие жидкости или твердые вещества.
Амины способны к образованию водородных связей с водой:
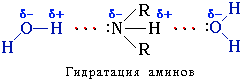
Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей.
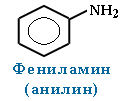
Но также, следует знать, что амины – это вещества, которые довольно таки токсичны. Они представляют опасность при вдыхании их паров, а также при контакте с кожным покровом. А такие амины, как, например, анилин, обладает способностью проникновения через кожу в кровь и может нарушить функции гемоглобина, и тем самым привести к летальному исходу.
При попадании аминов в кровь появляются такие симптомы, как одышка, посинение губ, носа и кончиков пальцев. Также при отравлении наблюдается учащенное дыхание и сердцебиение. А в некоторых случаях может дойти и до потери сознания.
В случае отравления или попадания амина на незащищенные участки кожи, необходимо как можно быстрее, очистить пораженный участок кожного покрова с помощью спирта и ваты. Но это следует делать очень аккуратно, стараясь не увеличивать пораженные участки кожи. В случае отравления парами аминов, следует сразу же пострадавшему обеспечить доступ к свежему воздуху и вызвать врача.
При отравлении алифатическими аминами может произойти нарушение функций печени, поражение нервной системы и проницаемости кровеносных сосудов.
Вдыхание ароматических аминов может привести к угнетению центральной нервной системы, а также вызвать рак мочевого пузыря.