Просмотр содержимого документа
««Типы химических реакций: реакции замещения»»

Презентация к уроку по теме: «Типы химических реакций: реакции замещения» 8 класс
Презентацию составила:
Храмова Наталья Владимировна
учитель химии
МБОУ школа №71
Г.Дзержинск

Содержание
- Повторение 1: Тип химической реакции?
- Повторение 2 Задание для самостоятельного выполнения
- Тема урока:«Типы химических реакций: реакции замещения»
- Сформулируйте определение . Реакции замещения – это…
- Эксперимент №1: взаимодействие кислот с металлами
- Эксперимент № 2: взаимодействие растворов солей с металлами Ряд активности металлов (электрохимический ряд напряжений)
- Задание № 1. Используя ряд активности металлов, продолжите возможные уравнения реакций замещения
- Задание №2 . Решите проблему

Тип химической реакции?
Расставьте коэффициенты в уравнениях
химических реакций:
Ca + O 2 =
Li + O 2 =
S + O 2 =

Тип химической реакции?
Расставьте коэффициенты в уравнениях химических реакций.
Укажите условия течения реакций.
CaCO 3 оксид кальция +углекислый газ
H 2 O водород + кислород
H 2 O 2 вода+ кислород
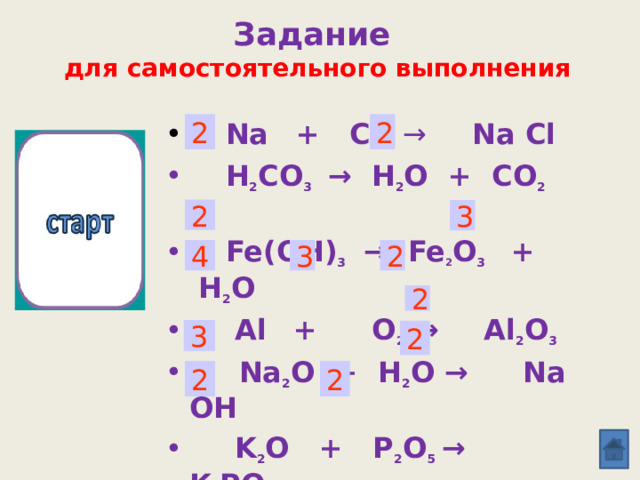
Задание
для самостоятельного выполнения
- H 2 CO 3 → H 2 O + CO 2 ↑
- Fe(OH) 3 → Fe 2 O 3 + H 2 O
- Al + O 2 → Al 2 O 3
- Na 2 O + H 2 O → Na OH
- K 2 O + P 2 O 5 → K 3 PO 4
- Ag Br → Ag + Br 2
2
2
10
9
8
7
5
6
4
3
2
1
0
2
3
2
4
3
2
3
2
2
2

Тема урока: «Типы химических реакций: реакции замещения»
С
Д
С ОМ
Д ОМ

Сформулируйте определение Реакции замещения – это…
H Cl + Zn = Zn Cl 2 + H 2
Какие вещества принимают участие
в химической реакции?
Расставьте коэффициенты в уравнении реакции.
2 H Cl + Zn = Zn Cl 2 + H 2
сложное + простое = сложное + простое вещество вещество вещество вещество

Эксперимент №1: взаимодействие кислот с металлами
- Вспомните правила техники
безопасности при работе с кислотами.
2. Эксперимент: насыпьте 1-2 г
порошка магния (пробирка №1);
порошка железа (пробирка № 2);
порошка меди (пробирка №3)
2. Затем прилейте 2- 3 мл соляной кислоты.
3. Наблюдайте. Сделайте выводы о скорости и возможности протекания реакций.
Cu
Fe
Mg
H Cl

Эксперимент № 2 взаимодействие растворов солей с металлами
- В 1 пробирку налейте 3 мл сульфата меди (II) Опустите стальную скрепку.
- Наблюдайте. Сделайте выводы.
Продолжите уравнения химических реакции:
CuSO 4 + Fe =
Fe
Fe
CuSO 4

Ряд активности металлов (электрохимический ряд напряжений металлов)
Li K Ba Ca Na Mg Al Mn Zn Cr Co Fe Sn Pb H 2 Cu Hg Ag Au
- Чем ближе металл расположен к левому
краю ряда, тем он более активен;
- активные металлы (кроме щелочных - Li, Na, K, Rb, Cs и щелочноземельных - Ca, Sr, Ba) вытесняют ионы менее активных металлов из растворов солей;
- металлы, расположенные в ряду активности
до водорода , вступают в реакции замещения с кислотами ,вытесняя из них водород.
Н.Н. Бекетов

Задание № 1
Используя ряд активности металлов,
Li K Ba Ca Na Mg Al Mn Zn Cr Co Fe Sn Pb H 2 Cu Hg Ag Au
продолжите возможные уравнения реакций:
- Mg + HCl =
- Fe + HCl =
- Cu + HCl =
- CuCl 2 + Mg=
- FeSO 4 + Cu=
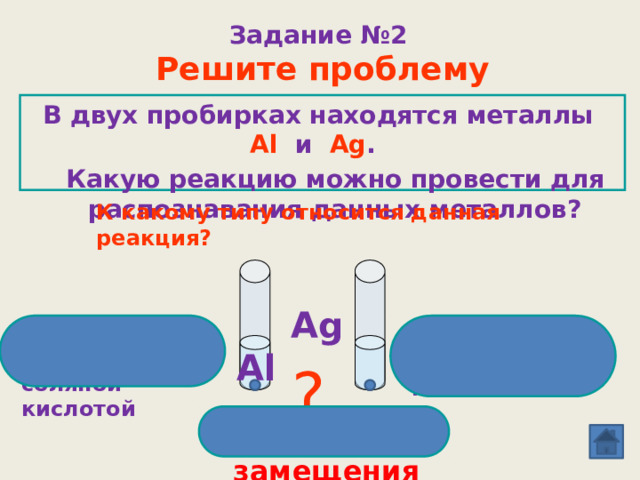
Задание №2
Решите проблему
В двух пробирках находятся металлы Al и Ag .
Какую реакцию можно провести для распознавания данных металлов?
К какому типу относится данная реакция?
?
Ag Al
Ag не реагирует с соляной кислотой
Al реагирует с соляной
кислотой
Реакция замещения
Информационные ресурсы
- Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М.: Просвещение, 2019.
- Габриелян О.С. Учебник для общеобразовательных учреждений. Химия. 8 класс. М.: Просвещение, 20109.
- http ://yandex.ru/yandsearch?text=%D0%BA%D0%B0%D1%80%D1%82%D0%B8%D0%BD%D0%BA%D0%B8+%D0%BF%D0%BE+%D1%85%D0%B8%D0%BC%D0%B8%D0%B8&sid=209511295850477772278&lid=v11.search&lr=51
- http://chemistry-chemists.com/
- http://yandex.ru/yandsearch?text=%D0%9D.%D0%9D.%D0%91%D0%B5%D0%BA%D0%B5%D1%82%D0%BE%D0%B2&lr=51
- http://ru.wikipedia.org/wiki/ Бекетов_Н .
- http://www.hemi.nsu.ru/ucheb188.htm
- http://www.google.ru/search?hl=ru&newwindow=1&client=opera&hs=42v&rls=ru&q=%D1%80%D0%B5%D0%B0%D0%BA%D1%86%D0%B8%D0%B8+%D0%B7%D0%B0%D0%BC%D0%B5%D1%89%D0%B5%D0%BD%D0%B8%D1%8F&aq=f&aqi=g9&aql=&oq =






























