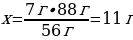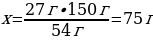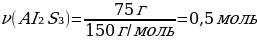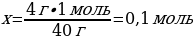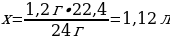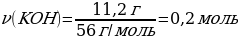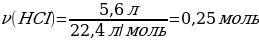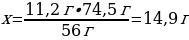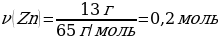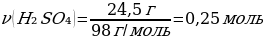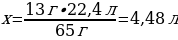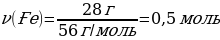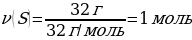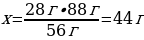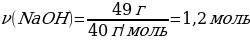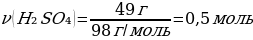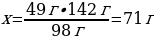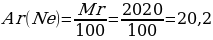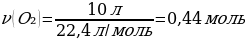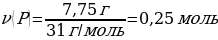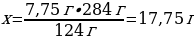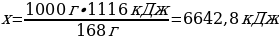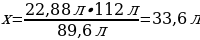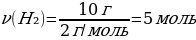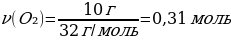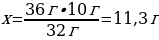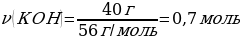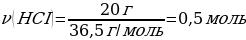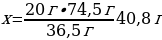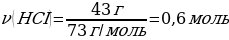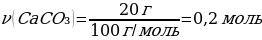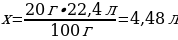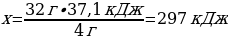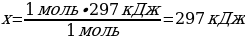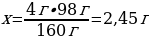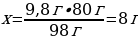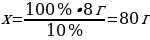ҰБТ – ке дайындық.
Бейорганикалық есептер жинағы
1.7 г темір күкіртпен әрекеттескенде түзілген темір(ІІ) сульфидінің массасы (г)
А) 10
В) 11
С) 12
D) 13
Е) 14
Шешуі: Ғе + S → ҒеS
М(Ғе) = 56 г/моль
m(Ғе) = ν · М(Ғе) = 1 моль · 56 г/моль = 56 г
М(ҒеS) = 88 г/моль
m(ҒеS) = ν · М(ҒеS) = 1 моль · 88 г/моль = 88 г
7 г Ғе ----- х г ҒеS
56 г Ғе ---- 88 г ҒеS
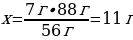
{дұрыс жауабы}= В
2. 27 г алюминий күкіртпен әрекеттескенде түзілген алюминий сульфидінің массасы (г) және зат мөлшері (моль)
А) 65 г; 0,2 моль
В) 55 г; 0,3 моль
С) 85 г; 0,4 моль
D) 75 г; 0,5 моль
Е) 150г; 1 моль
Шешуі: 2АІ + 3S → АІ2S3
М(АІ) = 27 г/моль
m(АІ) = ν · М(АІ) = 2 моль · 27 г/моль = 54 г
М(АІ2S3) = 150 г/моль
m(АІ2S3) = ν · М(АІ2S3) = 1 моль · 150 г/моль = 150 г
27 г АІ ----- х г АІ2S3
54 г АІ ---- 150 г АІ2S3
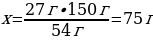
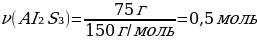
{дұрыс жауабы}= D
3. 4 г натрий гидроксиді тұз қышқылы мен әрекеттескенде түзілген тұздың зат мөлшері (моль)
А) 0,05
В) 0,1
С) 5,85
D) 4
Е)0,2
Шешуі: NaOН + НСI → NaСІ + Н2О
М(NaOН) = 40 г/моль
m(NaOН) = ν · М(NaOН) = 1 моль · 40 г/моль = 40 г
4 г NaСІ ----- х моль NaСІ
40 г NaОН ---- 1 моль NaСІ
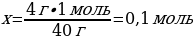
{дұрыс жауабы}= В
4.1,2 г магний тұз қышқылымен артық мөлшерімен әрекеттескенде түзілген сутегінің (қ.ж.) көлемі (л)
А) 1,24
В) 1,12
С) 1,65
D) 1,82
Е) 4,48
Шешуі: Мg + 2НСI → МgСІ2 + Н2
М(Мg) = 24 г/моль
m(Мg) = ν · М(Мg) = 1 моль · 24 г/моль = 24 г
1,2 г Мg ----- х л Н2
24 г Мg ----- 22,4 л Н2
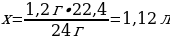
{дұрыс жауабы}= В
5. 11,2 г калий гидроксиді 5,6 л хлорсутекпен әрекеттескенде түзілген тұздың массасы (г)
А) 5,6
В) 11,2
С) 14,9
D) 18,6
Е) 19,4
Шешуі: КOН + НСI → КСІ + Н2О
М(КOН) = 56 г/моль
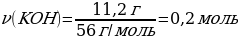
Vm = 22,4 л/моль
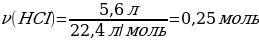
ν(HСІ) ν(КOН)
М(КСІ) = 74,5 г/моль
m(КСІ) = ν · М(КСІ) = 1 моль · 74,5 г/моль = 74,5 г
11,2 г КОН ----- х г КСІ
56 г КОН ---- 74,5 г КСІ
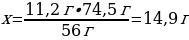
{дұрыс жауабы}= С
6. 13 г мырыш 24,5 г күкірт қышқылымен әрекеттескенде түзілген сутегінің (қ.ж.) көлемі (л)
А) 1,12
В) 2,24
С) 3,36
D) 4,48
Е) 6,72
Шешуі: Zn + Н2SO4→ ZnSO4 + Н2
М(Zn) = 65 г/моль
m(Zn) = ν · М(Zn) = 1 моль · 65 г/моль = 65 г
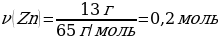
М(H2SO4) = 98 г/моль
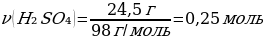
ν(Zn) ν(H2SO4)
Vm = 22,4 л/моль
V(Н2) = ν · Vm = 1 моль · 22,4 л/моль
13 г Zn ----- х л Н2
65 г Zn ---- 22,4 л Н2
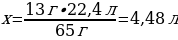
{дұрыс жауабы}= D
7. 28 г темірді 32 г күкіртпен қосып қыздырғанда түзілген темір(ІІ) сульфидінің массасы (г)
А) 32
В) 38
С) 44
D) 60
Е) 63
Шешуі: Ғе + S → ҒеS
М(Ғе) = 56 г/моль
m(Ғе) = ν · М(Ғе) = 1 моль · 56 г/моль = 56 г
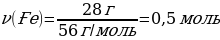
М(S) = 32 г/моль
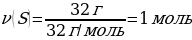
ν(S) ν(Ғе)
М(ҒеS) = 88 г/моль
m(ҒеS) = ν · М(ҒеS) = 1 моль · 88 г/моль = 88 г
28 г Ғе ----- х г ҒеS
56 г Ғе ---- 88 г ҒеS
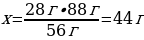
{дұрыс жауабы}= С
8. 49 г натрий гидроксиді мен 49 г күкірт қышқылының ерітінділерін араластырғанда түзілетін тұздың массасы:
А) 24
В) 49
С) 71
D) 87
Е) 98
Шешуі: 2NaOH + H2SO4 = Na2SO4 + 2H2O
М(NaOH) = 40 г/моль
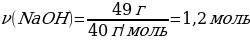
М(H2SO4) = 98 г/моль
m(H2SO4) = ν · М(H2SO4) = 1 моль · 98 г/моль = 98 г
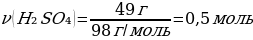
ν(NaOH) ν(H2SO4)
М(Na2SO4) = 142 г/моль
m(Na2SO4) = ν · М(Na2SO4) = 1 моль · 142 г/моль = 142 г
49 г H2SO4 ----- х г Na2SO4
98г H2SO4 ---- 142г Na2SO4
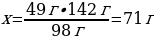
{дұрыс жауабы}= С
9. Табиғатта кездесетін 2010Nе – 20 изотопының массалық үлесі 90%,2210Nе – 22 изотопының массалық үлесі 10%. Неон элементінің салыстырмалы атомдық массасы
А) 20,2
В) 19,5
С) 18,2
D) 17,5
Е) 14
Шешуі: Мг(Ne) = w Ne· Ar(20Ne) + w Ne· Ar(22Ne)
Мг(Ne) = 90 · 20 + 10 · 22 = 1800 + 220 = 2020
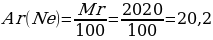
{дұрыс жауабы}= А
10. Хлор элементінің табиғатта кездесетін изотоптары СІ -35 және СІ-37. Элементтің салыстырмалы атомдық массасы-35,5. Табиғаттағы әр изотопының массалық үлесі
А) 85% және 15%
В) 75% және 25%
С) 65% және 35%
D) 55% және 45%
Е) 50% және 55%
Шешуі: СІ = 35
35х + 37(100-х) = 35,5 · 100
35х +3700 -37х = 3550
2х =3700 -3550
2х = 150
х =75%
СІ = 35
37х + 35(100-х) = 35,5 · 100
37х +3500 -35х = 3550
2х =3550 -3500
2х = 50
х =25%
{дұрыс жауабы}= В
11.7,75 г фосфор 10 л (қ.ж.) оттегімен әрекеттескенде тұзілген оксидтің массасы (г)
А) 18,75
В) 17,75
С) 19,75
D) 16,75
Е) 15,75
Шешуі: 4Р + 5О2→ 2Р2О5
Vm = 22,4 л/моль
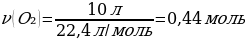
М(Р) = 31 г/моль
m(Р) = ν · М(Р) = 4 моль · 31 г/моль = 124 г
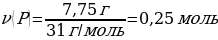
ν(О2) ν(Р)
М(Р2О5) = 142 г/моль
m(Р2О5) = ν · М(Р2О5) = 1 моль · 142 г/моль = 284 г
7,75 г Р ----- х г Р2О5
124 г Р ---- 284 гР2О5
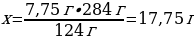
{дұрыс жауабы}= В
12. Темірдің жану реакциясының термохимиялық теңдеуі: 3Fе + 2О2 → Ғе3О4 + 1116 кДж болса, 1 кг темір жанған кезде бөлінетін жылу мөлшері (кДж)
А) 6642,8
В) 3321,4
С) 1660,7
D) 1328,5
Е) 1107,1
Шешуі: 3Fе + 2О2 → Ғе3О4 + 1116 кДж
М(Ғе) = 56 г/моль
m(Ғе) = ν · М(Ғе) = 3 моль · 56 г/моль = 168 г
1000 г Ғе ----- х кДж
168 г Ғе ---- 1116 кДж
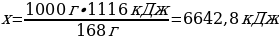
{дұрыс жауабы}= А
13. Газ күйіндегі аммиакты NН3 катализатор қатысында оттегімен тотықтырғанда азот (ІІ) оксиді және су түзіледі. 26,88 л аммиакпен реакцияға түскен оттегінің көлемі (л)
А) 10,6
В) 15,6
С) 20,6
D) 33,6
Е) 30,6
Шешуі: 4NH2 + 5O2→ 4NO + 6H2O
Vm = 22,4 л/моль
V(NH2) = ν · Vm = 4 моль · 22,4 л/моль = 89,6 л
V(O2) = ν · Vm = 5 моль · 22,4 л/моль = 112 л
22,88 л NH2----х л O2
89,6 л NH2---- 112 л O2
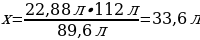
{дұрыс жауабы}= D
14. 10 г сутегі 10 г оттегімен әрекеттескенде түзілген судың массасы (г)
А) 1,3
В) 11,3
С) 20,3
D) 50,3
Е)25,3
Шешуі: 2H2+ O2 → 2H2O
М(H2) = 2 г/моль
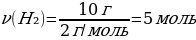
М(O2)= 32 г/моль
m(O2) = ν · М(O2) = 1 моль · 32 г/моль = 32 г
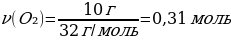
ν(Н2) ν(О2)
М(H2О)= 18 г/моль
m(H2О) = ν · М(H2О) = 2 моль · 18 г/моль = 36 г
х г H2О ----10 г O2
36 г H2О ---- 32 г O2
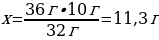
{дұрыс жауабы}= В
15. 200 г 20% -тік калий гидроксидінің ерітіндісі мен 200 г 10%-ті тұз қышқылының ерітіндісімен әрекеттескенде, түзілген тұздың массасы (г)
А) 53,2
В) 40,8
С) 4,08
D) 408
Е) 5,32
Шешуі: КOН + НСI → КСІ + Н2О
m(КОН) = 200 г · 0,2 = 40 г
М(КOН)= 56 г/моль
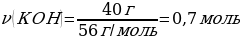
m(НСІ) = 200 г · 0,1 = 20 г
М(НСІ)= 36,5 г/моль
m(НСІ) = ν · М(НСІ) = 1 моль · 40 г/моль = 40 г
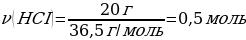
ν(КОН) ν(НСІ)
М(КСІ)= 74,5 г/моль
m(КСІ) = ν · М(КСІ) = 1 моль · 74,5 г/моль = 74,5 г
20 г НСІ ----- х г КСІ
36,5 г НСІ ---- 74,5 г КСІ
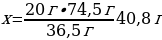
{дұрыс жауабы}=В
16. Көлемі 200 мл, тығыздығы 1,075 г/мл 20% -тік тұз қышқылы ерітіндісімен массасы 20 г мәрмәр әрекеттескенде, түзілген көмір қышқыл газының (қ.ж.) көлемі
А) 4,48 л
В) 2,24 мл
С) 44,8 л
D) 44,8 мл
Е) 22,4 л
Шешуі: CaCO3 + 2НСІ → СаСІ2 + СО2↑+ Н2О
mеріт.(НСІ) = 220 мл · 1,075 г/мл = 215 г
m(НСІ) = 215 · 0,2 = 43 г
М(НСІ)= 73 г/моль
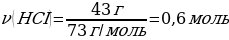
М(CaCO3)= 100 г/моль
m(CaCO3) = ν · М(CaCO3) = 1 моль · 100 г/моль = 100 г
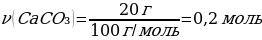
ν(НСІ) ν(CaCO3)
Vm = 22,4 л/моль
V(СO2) = ν · Vm = 1 моль · 22,4 л/моль = 22,4 л
20 г CaCO3 -----х л CO2
100 г CaCO3 ----22,4 л CO2
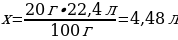
{дұрыс жауабы}=А
17. 4 г күкіртті жаққанда 37,1 кДж жылу бөлінді, 1 моль күкірт жанғанда бөленген жылу мөлшері (кДж)
А) 297
В) 287
С) 267
D) 259
Е) 371
Шешуі: S + О2 → SО2 + 37,1 кДж
М(S) = 32 г/моль
m(S) = ν · М(S) = 1 моль · 32 г/моль = 32 г
4 г S ----- 37,1 кДж
32 г S ---- х кДж
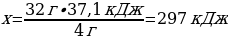
1 моль S ----- х кДж
1моль S ---- 297 кДж
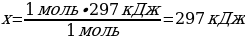
{дұрыс жауабы}= А
18.40 г 10%-тті мыс сульфаты натрийгидроксидімен әрекеттескенде түзілген мыс (ІІ) гидроксидінің массасы.
А) 3,45 г
В) 2,75 г
С) 2,45 г
D) 3,15 г
Е) 2,65 г
Шешуі: CuSO4 + 2NaOH→ Nа2SO4 + Сu(ОН)2
М(CuSO4)= 160 г/моль
m(CuSO4) = ν · М(CuSO4) = 1 моль · 63 г/моль = 63г
М(Сu(ОН)2)= 98 г/моль
m(Сu(ОН)2) = ν · М(Сu(ОН)2) = 1 моль · 98 г/моль = 98 г
m(CuSO4) = 40 г · 0,1 = 4 г
4 г CuSO4 -----х г Сu(ОН)2
160 г CuSO4 ----98 г Сu(ОН)2
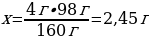
{дұрыс жауабы}=С
19. 20 г 49% -тті күкірт қышқылын бейтараптауға жұмсалған 10%-тті натрий гидроксидінің массасы.
А) 4 г
В) 0,8г
С) 800г
D) 80 г
Е) 8 г
Шешуі: 2NaOH + H2SO4→ Na2SO4 + 2H2O
М(NaOH) = 40 г/моль
m(NaOН) = ν · М(NaOН) = 2 моль · 40 г/моль = 80 г
М(H2SO4) = 98 г/моль
m(H2SO4) = ν · М(H2SO4) = 1 моль · 98 г/моль = 98 г
m(H2SO4) = 20 г · 0,49 = 9,8 г
9,8 г H2SO4---- х г NaОН
98 г H2SO4 ---- 80 г NaОН
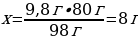
10 % ------ 8 гNaОН
100% ----- х г NaОН
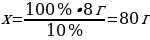
{дұрыс жауабы}=D