Использование технологии ТИСО на уроках химии.
Основные цели технологии:
Формирование твердой мотивации обучения
Развитие умений учебной деятельности
Развитие культуры речи, обогащение запаса слов за счет понятий, развитие химического языка
Развитие мышления, особенно за счет заданий творческого уровня
Развитие сенсорной и двигательной сферы учащихся
Воспитание товарищества, честности, гуманности, аккуратности друг к другу и к себе
Воспитание бережного отношения к природе, рациональному использованию природных богатств
Компоненты ТИСО:
- дидактический модуль
- стандарт содержания темы
- учебный лист темы
- рейтинговый лист ученика по теме
- комплект проверочных работ по усвоению содержания темы
- тетрадь домашних индивидуальных заданий
Учебный лист темы «Первоначальные химические понятия»
Система уроков:
Предмет химии.
Вещества. Свойства веществ
Чистые вещества и смеси
Разделение смесей и методы очистки веществ
Физические и химические явления. Химические реакции.
Молекулы и атомы. Атомно-молекулярное учение.
Простые и сложные вещества. Л/о 1 «Ознакомление с образцами простых и сложных веществ».
Химические элементы. Символы химических элементов. Относительная атомная масса.
Химические формулы. Относительная молекулярная масса.
Расчет массовой доли химического элемента в соединении
Закон постоянства состава вещества.
Валентность. Определение валентности элементов по формуле. Составление формул по валентности.
Количество вещества – моль. Число Авогадро. Молярная масса.
Вычисления с применением количества вещества и массы вещества
Закон сохранения массы. Химические уравнения.
Типы химических реакций. Л/о 2 «Разложение гидрокарбоната меди (малахита)», л/о 3 «Замещение меди в растворе железом»
| Знать | Усвоить понятия | Научиться |
| 1. основные понятия и законы химии
| 1. вещество 2. смесь 3. химический элемент 4. атом 5. молекула 6. относительная атомная масса 7. молекулярная масса 8. закон сохранения массы веществ 9. валентность 10. химическая реакция
| Составлять и записывать химические формулы Составлять и записывать химические уравнения Определять типы химических реакций Проводить вычисления по химическим формулам и уравнениям Вычислять относительную молекулярную массу веществ. Проводить расчеты по уравнениям реакций. Соблюдать правила техники безопасности |
Список литературы по теме:
1. Н.Н. Нурахметов, К.А.Сарманова, К.М.Жексембина. «Химия» учебник для 8 классов общеобразовательных школ. Алматы «Мектеп», 2008.
Помни!
Работать нужно по алгоритму: Все задания выполняются строго в указанном порядке. Это поможет тебе лучше усвоить тему.
Не забывай проходить проверку, делать пометки на полях, заполнять рейтинговый лист темы. Пожалуйста, не оставляй без ответа возникшие у тебя вопросы.
Записывай все свои затруднения на полях тетради.
Будь объективен во время взаимопроверки, это поможет и тебе и тому, кого ты проверяешь.
В режиме ТИСО работаешь 16 занятий
Желаю успеха!
Рейтинговый лист темы:
| Номер задания | Максимальный балл | Балл при проверке | Кто проверил | Кого проверил | Оценка |
| 1 | 2 |
|
|
| Итого: 48 б. «5» 40 - 48 б, «4» 39 - 35б, «3» 24 – 34 б. |
| 2 | 2 |
|
|
|
| 3 | 2 |
|
|
|
| 4 | 2 |
|
|
|
| 5 | 1 |
|
|
|
| 6 | 3 |
|
|
|
| 7 | 3 |
|
|
|
| 8 | 1 |
|
|
|
| 9 | 2 |
|
|
|
| 10 | 2 |
|
|
|
| 11 | 2 |
|
|
|
| 12 | 3 |
|
|
|
| 13 | 1 |
|
|
|
| 14 | 3 |
|
|
|
| 15 | 2 |
|
|
|
| 16 | 2 |
|
|
|
| 17 | 1 |
|
|
|
| 18 п/р 1 | 5 |
|
|
|
| 19 | 2 |
|
|
|
| 20 | 2 |
|
|
|
| 21 | 1 |
|
|
|
| 22 | 1 |
|
|
|
| 23 | 3 |
|
|
|
| 24 п/р 2 | 5 |
|
|
|
Задание 1:
Что изучает химия?
Зачем нужно изучать химию?
Прочитай текст § 1 стр. 5-6 до слов… «Одна из главных задач химии» и дай определение понятиям: Вещество, тело, свойства, химия.
Выпиши из приведенного перечня физических тел (предметов) и веществ названия веществ: кирпич, поваренная соль, мел, железная кнопка, вода, сахар, проволока, свеча, химический стакан, стеклянная воронка.
Пройди проверку 1.
Задание 2:
Прочти текст § 2, абзацы 1 – 3, ответь на вопрос 2 с. 10.
Прочти текст § 2, абзацы 4 – 5, ответь на вопрос 3 с. 10.
Прочти текст § 2, абзацы 7 – 9, ответь на вопрос 4 с. 10.
Для доказательства того, что вещества при смешивании сохраняют свои свойства, прочти текст § 2, абзацы 10 – 11, проведи лабораторный опыт: «Разделение смеси, состоящей из порошков железа и серы».
сделай вывод: ответь на вопрос 5 с. 10.
Пройди проверку 2.
Задание 3:
Прочти текст § 3.
Объясни, что такое смеси, а что мы называем чистым веществом. Чем отличаются чистые вещества от смесей?
Пользуясь приведенной ниже схемой, запиши в тетрадь примеры однородных и неоднородных смесей:
С
 меси
меси
однородные неоднородные
Задание 4:
Физические явления: _______
Химические явления: _______
Вода в озере покрылась коркой льда;
Появление ржавчины на железном гвозде;
Золотую проволоку вытянули в нить;
Сжигание бензина в двигателе внутреннего сгорания (в автомобиле);
Ледяная игрушка весной растаяла;
Высыхание дождевых луж;
Для приготовления теста в ложке смешали соду и уксусную кислоту;
Морской прилив;
Кусочек свинца бросили в азотную кислоту, он «исчез», «растворился», при этом выделился бурый газ;
Лёд уронили, он разбился, и получилось несколько ледышек.
Задание 5:
Прочти текст § 5.
Выпиши в тетрадь признаки химических реакций.
Заштрихуй клетки в таблице с правильными ответами о признаках, сопровождающих химические и физические явления, получишь изображение римской цифры:
| химические и физические явления | Признаки химических и физических явлений |
| Выделение теплоты | Имение цвета | запах | Появление осадка | Появление газа |
| Горение угля |
|
|
|
|
|
| Продувание воздуха через известковую воду |
|
|
|
|
|
| Диффузия паров духов |
|
|
|
|
|
Задание 6:
Прочти текст § 6. Запиши понятия терминов «Молекулы», «Атомы», «Простое вещество», «Сложное вещество», «Химическое соединение».
С помощью рис. 9 - 10 с. 18 – 19 определи схемы простых и сложных веществ. Зарисуй в тетрадь.
Одним цветом закрась схемы простых веществ, разными цветами – сложных веществ




О зон водород соляная кислота фосфор
зон водород соляная кислота фосфор


оксид кальция азот метан оксид натрия.
Задание 7:
Прочти текст § 7, абзацы 1-11. Запиши определение понятия «Химический элемент», данное Дж. Дальтоном.
Допиши приведенные ниже предложения, заменив многоточия подходящими по смыслу понятиями «химический элемент», «атом», «молекула»:
а) ... кислорода состоят из ... одного ... .
б) ... кислорода содержит два ... .
в) В состав ... воды входят ... двух ..., одним из которых является кислород.
г) ... кислорода входят в состав воздуха.
Выучи символы и названия химических элементов, приведенные в таблице 2, с. 21.
Отметь в таблице смесь, химическое соединение или химический элемент против перечисленных названий. Из букв, соответствующих правильным ответам, получите название химического элемента:
| название | смесь | химическое соединение | химический элемент |
| Оксид меди (II) | м | н | п |
| Порошок смеси и железа | о | р | с |
| Водород | в | а | б |
| Песок | е | з | ж |
| Сульфид железа | к | л | м |
| Хлор | ч | х | н |
| Серебро | с | т | й |
Задание 8:
Прочти текст § 7, абзацы 12 -14.
Определи, на какие 2 группы делят все химические элементы.
Запиши общие свойства металлов и неметаллов, и приведи примеры этих веществ.
Пройди проверку 8.
Задание 9:
Прочти текст § 8.
Ответь на вопросы 1, 2 с . 25.
Запиши в тетрадь определение понятия «Относительная атомная масса» и ее обозначение.
Определи с помощью Периодической системы химических элементов Аr следующих элементов: О, Н, Мg, С, Сu, Fe, S, Al, As.
Пройди проверку 9.
Задание 10:
Прочти текст § 9, абзацы 1-5.
Запиши в тетрадь схему на с. 26, определи, что означает коэффициент и индекс в химической формуле.
а) кислорода, если молекула кислорода состоит из двух атомов кислорода;
б) озона, если молекула озона состоит из трех атомов кислорода;
в) сероводорода, если молекула сероводорода состоит из двух атомов водорода и одного атома серы;
г) серной кислоты, если молекула серной кислоты состоит из двух атомов водорода, одного атома серы и четырех атомов кислорода;
д) фторида кальция, если во фториде кальция на каждый атом кальция приходится два атома фтора.
а) 4Н; 7Fe; Н2; 4Н2
б) NaCl; AlBr3; FeS
Задание 11.
Прочти текст § 9, абзацы 6-10.
Запиши в тетрадь определение понятия «Относительная молекулярная масса» и ее обозначение.
Изучи и запиши в тетрадь правило и пример вычисления относительной молекулярной массы вещества по химической формуле:
Для вычисления необходимо относительную атомную массу каждого элемента умножить на число атомов элемента, а затем их произведения сложить
Пример: Рассчитать относительную молекулярную массу углекислого газа CO2:
Мr(CO2)= Ar(С)+ 2Аr(O)=12+2 16= 44
Рассчитай относительные молекулярные массы используемых в пищу веществ: вода Н2О, поваренная соль NaCl, сахар C12H22O11, Уксусная кислота СН3СООН, пищевая сода NaHCO3.
Пройди проверку 11.
Задание 12:
Массовая доля (W) элемента А в соединении АnВm – это отношение суммы масс всех атомов данного элемента к массе соединения (выражается в долях от единицы или процентах.
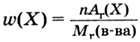
Где w ( А)- массовая доля элемента,
n – число атомов элемента А,
Ar (A)- относительная атомная масса элемента А,
Mr (АnВm ),- относительная молекулярная масса вещества АnВm
Массовая доля показывает, какую часть от относительной молекулярной массы вещества составляет относительная атомная масса элемента, умноженная на индекс при знаке элемента в формуле.
Ответь на вопросы: Как можно определить содержание элемента в веществе? Что такое массовая доля элемента? Что показывает массовая доля элемента?
Изучи и запиши в тетрадь Алгоритм вычисления массовой доли элемента в сложном веществе.
| Задача. Вычислите массовую долю железа в соединении Fe3O4 |
| Порядок действий | Пример |
| 1. Записать дано.
2. Вычислить Mr соединения.
3. Вычислить относительную массу всех атомов данного элемента. Для этого Ar (округленное значение взять из Периодической таблицы) элемента умножить на индекс при данном элементе (n Ar (A)).
4. Вычислить массовую долю (w) по формуле w ( А)= n Ar (A) / Mr (АnВm ). 5. Записать ответ. Проверка решения: Сумма массовых долей всех элементов, входящих в состав сложного соединения, должна быть равна 1 или 100% | Дано: Fe3O4 Найти: w (Fe)-? Mr (Fe3O4)= 3Ar (Fe)+ 4 Ar (О)= 56∙3 + 16∙ 4= 232
n Ar (Fe)= 3Ar (Fe)= 56∙ 3=168
w (Fe )= 168: 232=0,724 ( 72,4 %)
Ответ: w (Fe )= 0,724 ( 72,4 %) |
Выполни упражнение 1 с. 31 учебника.
Пройди проверку 12.
Задание 13:
Изучи текст § 10, стр. 28 «Вычисление массовых отношений элементов в составе сложного вещества».
Рассмотри пример решения задачи и запиши его в тетрадь:
Задача: Рассчитать массовые отношения алюминия, кислорода и водорода в гидроксиде алюминия Al(OH)3.
Решение: Умножив число атомов каждого элемента на его относительную атомную массу, определяют массовые отношения элементов, а затем сокращают
m (Al): m(O): m(H) = Ar (Al): 3Ar(O): 3Ar(H) = 27 : 48 : 3 = 9 : 16 : 1
Ответ: Массовые отношения алюминия, кислорода и водорода равны: m (Al): m(O): m(H) = 9 : 16 : 1
Выполни задание: Вычислить массовые отношения элементов, входящих в состав следующих соединений: H2O, CaO, Ca(OH)2, SO2, SO3, CuSO4 .
Пройди проверку 13.
Задание 14.
Изучи текст § 10, стр. 30-31 «Вывод формулы вещества по массовым долям элементов, входящим в его состав».
Запиши в тетрадь примеры решения задач 1 – 2.
Реши задачи: 1. Элементарный состав вещества следующий: W (Fe)=72?41%, W(О) = 27,59%. Выведите химическую формулу вещества.
2.Массовые доли элементов меди и кислорода в оксиде равны соответственно 88,9% и 11, 2%. Выведите химическую формулу оксида.
3.Выведите химическую формулу оксида хрома, содержащего 68, 4% хрома и 31, 4% кислорода.
Пройди проверку 14.
Задание 15.
Прочти текст абзацев 2 - 3, § 13 с. 36 и ответь на вопрос 3 с. 38.
Прочти текст абзацев 1 - 2, с. 37 и запиши формулировку закона постоянства состава вещества. Запомни: этот закон справедлив только по отношению к веществам, имеющим молекулярное строение.
Рассмотри пример расчетов на основе закона постоянства состава: задача на с. 37 и запиши в тетрадь.
Реши задачу 5 с. 38.
Выполни упражнение 6, с. 38.
Пройди проверку 15.
Задание 16.
Прочти текст абзацев 1 - 8, § 11 с. 31 – 33.
Запиши в тетрадь определение понятий «Валентность», «Биэлементное соединение».
Изучи алгоритм определения валентности: пример: H2S.
1.Отметить валентность известного элемента (чаще всего постоянную) I
H2S
2.Найти общее число валентностей данного элемента 2
I
H2S
3.Вычислить и проставить над химическими знаками валентность второго элемента. Для этого общее число валентностей делят на индекс второго элемента. 2
I II
H2S
4. Сделай проверку, то есть подсчитай число единиц валентностей каждого элемента
I II
H2S
(2=2)
Al2S3 Na2S KCl Cu2O Fe2O3 NO Ca3P2 ZnS CaCl2 Mg3N2 Mn2O7 SO3 CCl4 CS2 PbO
Задание 17:
Определяем валентность известных элементов. Валентность Li – I, O – II.
Находим общее кратное. Общее кратное – 2.
Определяем индексы каждого элемента. Делим его на валентность, получаем индекс – Li2O
IV V II V II
KO CH MgO AlO PO CO ZnO NO CaS AgO
Задание 18:
Проверочная работа 1.
Выполни задания:
Выбери физические и химические явления:
А. Сияние луны
Б. Высыхание лужи
В. Образование глюкозы в зеленом растении
Г. Ржавление железа
Д. Горение древесины
Е. Плавление свинца
Ж. Горение свечи
З. Испарение бензина
И Плавление льда.
Запиши формулы веществ в соответствующие столбцы таблицы: H2, Na2S, Al, CuCl2, Mg, KI, S, Ca(OH)2, O3, FeBr3
| Простые вещества | Сложные вещества |
3. Определи валентность элементов в веществах: SiH4, CrO3, H2S, CO2, CO, SO3, SO2, Fe2O3, FeO, HCl.
3. Составь формулы веществ, зная валентность химических элементов:
1) цинка с углеродом, натрия с серой (валентность серы – II, углерода – IV)
2) алюминия, калия, кальция с азотом (валентность азота III)
3) натрия, фосфора, магния с кислородом.
Задание 19:
Прочти текст § 17
Допиши определения:
а) Количество вещества – это _____________________________________________
б) Моль – это _____________________________________________________________
в) Число Авогадро - _____________________________ и постоянно оно =
г) Молярная масса – это ___________________________________________________
Напиши формулу, выражающую зависимость между молярной массой, массой вещества и его количеством (формула 1): ________________
Преобразуй эту формулу таким образом, чтобы можно было определить:
а) массу вещества (если известны другие данные) (формула 2): _______________
б) количество вещества (если известны другие данные) (формула 3): ______________
Задание 20:
Прочти текст § 14.
Закончи предложения: Исходные вещества, принимающие участие в химических реакциях называются … Новые вещества, образующиеся в результате химической реакции называются… Условная запись химической реакции посредством химических формул - ….
Изучи Алгоритм расстановки коэффициентов в уравнениях химических реакций на примере реакции горения красного фосфора.
| Порядок выполнения операций | Пример |
| 1. В левой части уравнения записать исходные вещества, в правой — продукты реакции (молекулы газов водорода, хлора, кислорода, азота состоят из двух атомов) | 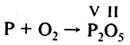
|
| 2. Определить число атомов каждого элемента в левой и правой частях схемы реакции | 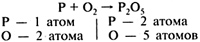
|
| 3. Среди элементов с разным числом атомов до и после реакции выбрать тот, число атомов которого больше | O — 2 атома слева O — 5 атомов справа |
| 4. Найти наименьшее общее кратное (НОК) числа атомов этого элемента в левой части уравнения и числа атомов этого элемента в правой части уравнения | НОК — 10 |
| 5. Разделить НОК на число атомов этого элемента в левой части уравнения, получив коэффициент для левой части уравнения | 10 : 2 = 5 P + 5O2  P2O5 P2O5 |
| 6. Разделить НОК на число атомов этого элемента в правой части уравнения, получив коэффициент для правой части уравнения | 10 : 2 = 5 P + 5O2  2P2O5 2P2O5 |
| 7. Необходимо подсчитать число атомов других элементов в левой и правой частях уравнения и с помощью коэффициентов уравнять их, т. е. число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым |  В левую часть уравнения перед фосфором необходимо поставить коэффициент 4. В левую часть уравнения перед фосфором необходимо поставить коэффициент 4.
4P + 5O2  2P2O5 2P2O5 |
а) N2 + H2 → NH3
б) Al(OH)3 → Al2O3 + H2O
в) Mg + HCl → MgCl2 + H2
г) СaO + HNO3→ Ca(NO3)2 + H2O
Задание 21:
Прочти текст § 16.
Изложи сущность основных положений АМУ.
Объясни, какие явления подтверждают: а) движение молекул; б) наличие между молекулами промежутков.
Объясни суть химической реакции с точки зрения АМУ.
Пройди проверку 21.
Задание 22:
Задание 23:
Прочти текст § 18, часть 1 и заполни 1-й столбец таблицы.
Прочти текст § 18, часть 2 и заполни 2-й столбец таблицы.
Прочти текст § 18, часть 3 и заполни 3-й столбец таблицы.
Прочти текст § 18, часть 4 и заполни 4-й столбец таблицы.
| Название типа реакции |
|
|
|
|
| Буквенная схема | А + В = АВ | АВ =А + В | А+ВС=АС + В | АВ + СД = АД + ВС |
| Пример |
|
|
|
|
| Определение |
|
|
|
|
Задание 24:
Проверь свои знания по теме «Первоначальные химические понятия»:
Какое из нижеприведенных веществ является простым веществом
А) алмаз, б) вода, в) поваренная соль?
2. Сложные вещества состоят из разных:
А) химических элементов, б) простых веществ, в) сложных веществ.
3. В каком из нижеперечисленных случает кислород выступает как химический элемент:
А) поддерживает дыхание и горение, б) является одним из составных компонентов воздуха, в) входит в состав воды и оксида углерода (IV), г) взаимодействует со многими простыми и сложными веществами?
4. Чистое вещество состоит из частиц:
А) одного и того же химического элемента, б) разных химических элементов, в) или одного и того же химического элемента, или разных химических элементов.
5. В каком из ниже перечисленных случаев углерод выступает как простое вещество:
А) образует несколько простых веществ, б) входит в состав многих минералов, в) при взаимодействии с кислородом в зависимости от условий образует или угарный газ, оксид углерода (II), или оксид углерода (IV), углекислый газ?
6. Смесь состоит из:
А) только простых веществ, б) только из сложных веществ, в) разных простых, разных сложных веществ, их комбинаций.
7. Фильтрованием можно разделить смеси, которые состоят из:
А) нерастворимых одна в другой жидкостях, б) жидкости и нерастворимого в ней твердого вещества, в) жидкости и растворимого в ней твердого вещества.
8. Какое из нижеперечисленных явлений относится к химическим:
А) образование инея, б) испарение воды, в) разложения воды при пропускании через нее электрического тока?
9. Отстаивание применяют для разделения смесей веществ с водой в тех случаях, когда нерастворимые в воде вещества отличаются от нее по:
А) температуре кипения, б) плотности, в) массовой доле в смеси.
10. Какая из записей обозначает наибольшее число молекул кислорода:
А) О2, б) О3, в) 2О2, г) 3О?
11. Какая из нижеприведенных формул составлена неправильно:
II II III II II III III II
А) МgO, б) Cr2O3, в) Mg3N2, г) Р2О5?
12. Для проведения реакции соединения необходимо взять как минимум:
А) одно исходное вещество, б) два исходных вещества, в) более двух исходных веществ.
13. В каком из следующих уравнений реакций коэффициенты поставлены не полностью:
А) 2HgО = 2 Hg + O2, б) 2Na + S = Na2S, в) SO2 + 2O2 = 2SO3,
г) 2 Al + 6HCl = 2AlCl3 + 3H2?
14. В ходе реакции разложения может образоваться:
А) одно вещество, б) два вещества, в) два и более веществ.
15. При реакции замещения:
А) число исходных веществ всегда больше числа продуктов реакции,
Б) число продуктов реакции всегда больше числа исходных веществ.
В) число исходных веществ и продуктов реакции одинаково.








 меси
меси



 зон водород соляная кислота фосфор
зон водород соляная кислота фосфор 

 В левую часть уравнения перед фосфором необходимо поставить коэффициент 4.
В левую часть уравнения перед фосфором необходимо поставить коэффициент 4.









