
- 24 апреля 1833 года в США была запатентована газированная содовая вода. Впервые газированный напиток был получен в 1767 году гениальным английским химиком Джозефом Пристли . Он открыл одно из свойств диоксида углерода, с помощью которого и стало возможным производство газированной воды.

Состав газированной воды
- Газированную воду в бутылках обогащают СО 2 , который очищает воду от микробов. Углекислый газ также способствует увеличению сроков хранения воды и играет роль консерванта. Наличие в напитке или воде двуокиси углерода как консерванта отмечается на этикетке кодом Е290.
- При соединении углекислого газа с водой образуется угольная кислота .


Химическая формула
H2CO3
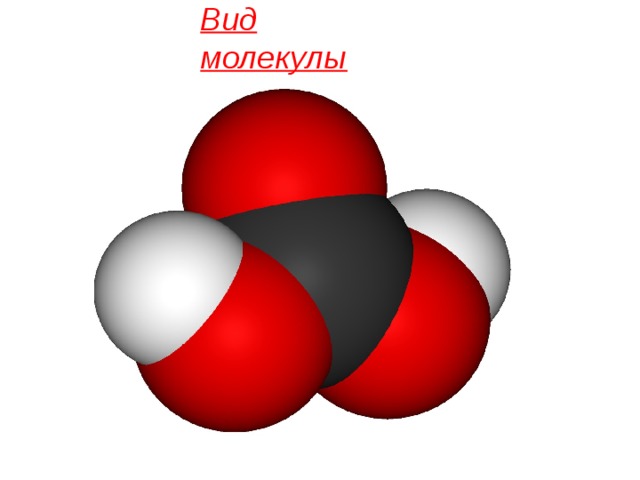
Вид молекулы

Общие сведения
Угольная кислота́ — слабая двухосновная кислота. В чистом виде не выделена. Образуется в малых количествах при растворении углекислого газа в воде, в том числе и углекислого газа из воздуха. Образует ряд устойчивых неорганических и органических производных: соли (карбонаты и гидрокарбонаты), сложные эфиры, амиды и др.

Физические свойства
Молекула угольной кислоты имеет плоское строение. Центральный углеродный атом имеет sp²-гибридизацию. В гидрокарбонат- и карбонат-анионах происходит делокализация π-связи. Длина связи C—O в карбонат-ионе составляет 129 пм.

Химические свойства

Качественная реакция на CO 3 2- карбонат – ион "вскипание" при действии сильной кислоты:
Na 2 CO 3 + 2HCl = 2NaCl + H 2 O + CO 2 ↑

Разложение
При повышении температуры раствора и/или понижении парциального давления диоксида углерода равновесие в системе смещается влево, что приводит к разложению части угольной кислоты на воду и диоксид углерода. При кипении раствора угольная кислота разлагается полностью:

Получение
Угольная кислота образуется при растворении в воде диоксида углерода.
Содержание угольной кислоты в растворе увеличивается при понижении температуры раствора и увеличении давления углекислого газа.
Также угольная кислота образуется при взаимодействии её солей (карбонатов и гидрокарбонатов) с более сильной кислотой. При этом бо́льшая часть образовавшейся угольной кислоты, как правило, разлагается на воду и диоксид углерода

Применение
Угольная кислота всегда присутствует в водных растворах углекислого газа (газированная вода).
В биохимии используется свойство равновесной системы изменять давление газа пропорционально изменению содержания ионов оксония (кислотности) при постоянной температуре. Это позволяет регистрировать в реальном времени ход ферментативных реакций, протекающих с изменением pH раствора

Органические производные
Угольную кислоту формально можно рассматривать как карбоновую кислоту с гидроксильной группой вместо углеводородного остатка. В этом качестве она может образовывать все производные, характерные для карбоновых кислот .
Некоторые представители подобных соединений перечислены в таблице.
Класс соединений
Сложные эфиры
Пример соединения
Хлорангидриды
поликарбонаты
фосген
Амиды
Нитрилы
мочевина
Ангидриды
циановая кислота
пироугольная кислота






































