Государственное автономное профессиональное образовательное учреждение Саратовской области
«Саратовский политехнический колледж»
Разработка урока-исследования
«Гидролиз солей»
Преподаватель:
Васильева Людмила Николаевна
Саратов 2021
Цель: изучить сущность гидролиза солей в водном растворе.
Задачи урока:
образовательные:
Дать понятие о гидролизе вообще и о гидролизе солей в частности;
Научить составлять полные и сокращённые ионные уравнения реакций гидролиза солей;
Сформировать умение предсказывать среду растворов различных солей;
Закрепить у школьников знания теории электролитической диссоциации.
Воспитательные:
Раскрыть перед учениками научный путь познания через доказательство гипотезы, способствовать переходу знаний в убеждения;
Посредством эксперимента привить навыки трудолюбия, бережного отношения к реактивам, к природе, эстетические качества.
Развивающие:
На примере свойств солей, различной природы, их отношение к воде, продолжить развитие умений наблюдать, сравнивать изучаемые явления, выявлять причинно – следственные связи, делать соответствующие выводы.
Перед проведением занятия студентам следует:
Повторить ранее изученный материал по темы «Растворы. Электролитическая диссоциация».
Студенты получают индивидуальные задания - подготовить сообщения по темам «Гидролиз в природе», «Гидролиз в народном хозяйстве и в жизни человека».
Заблаговременно студенты получают несколько полосок универсальной индикаторной бумаги и проверяют действие на неё влажных мыла и соды, хлорида цинка (паяльная кислота), силикатный клей, поваренная соль. Результаты заносят в таблицу
| Исследуемые вещества | Изменение цвета индикаторной бумаги |
| Мыло туалетное |
|
| Сода |
|
| Хлорид цинка (паяльная кислота) |
|
| Канцелярский клей (бумажный) |
|
| Поваренная соль |
|
Оборудование: лабораторное оборудование, вещества, компьютер, мультимедийный проектор, экран.
На столах учащихся: стаканы с дистиллированной водой, растворы соляной кислоты, гидроксида натрия, хлорида натрия, хлорида алюминия, карбоната натрия, лакмус, фенолфталеин, штатив с пробирками, карточки с алгоритмом написания уравнений гидролиза.
Тип урока: изучение нового материала.
Вид урока: проблемно-исследовательский.
Методы обучения: частично-поисковый, словесно-наглядно-практический, объяснение с элементами беседы.
Структура урока
| Этапы
урока | Дидактические
задачи | Формы организации деятельности учащихся | Методы
обучения | Средства
обучения | Время |
| 1. Оргмомент | Психологический настрой учащихся на урок. | Фронтальная | Словесный | | 1 мин. |
| 2. Актуализация знаний. Проверка домашнего задания. | Организовать повторение основных понятий, которые потребуются на данном уроке. | Индивидуальная | Словесно-наглядный | Экран | 3 мин. |
| 3. Целеполагание | Постановка цели урока и доведение её до сознания учащихся. | Групповая (работа в парах) | Словесно-наглядный-практический | Экран, доска, реактивы, лабораторное оборудование, тетрадь | 6 мин. |
| 4. Изучение нового материала | Организовать деятельность учащихся на усвоение новых знаний и способов деятельности. | Коллективная, групповая | Словесно-наглядно- практический | Экран, доска, реактивы, лабораторное оборудование, тетрадь | 20 мин. |
| 5. Закрепление. Самоконтроль и взаимо-контроль. | Выявление качества знаний, установление причин недостатков. | Групповая (работа в парах) | Словесно- практический | Карточки с заданием | 10 мин. |
| 6. Подведение итогов. Домашнее | Проверка степени усвоения знаний, выявление недостатков в их усвоении. | Фронтальная | Словесно-наглядный. | Экран | 3 мин. |
| 7. Домашнее задание | Обеспечение понимания цели, содержания и способов выполнения. | Фронтальная | Словесно-наглядный | Дополнительные источники информации, карточки с заданием. | 2 мин. |
Ход урока.
Организационный момент.
Подготовка к активному восприятию новой темы.
Учитель: На прошлом уроке мы рассматривали химические свойства солей с позиции электролитической диссоциации. Сегодня продолжим - и познакомимся с одним важным и сложным свойством солей.
(С целью воспроизведения в памяти учащихся опорных положений и подготовки их к восприятию нового материала учитель проводит фронтальную беседу- опрос.)
Вопросы учителя (на экране) :
Что определяет свойства растворов кислот?
Чем отличаются сильные кислоты от слабых? Приведите примеры тех и других.
В молекулах каких кислот – сильных или слабых – водород связан прочнее?
Дать определение основаниям. Как обнаруживается наличие гидроксид-ионов в растворе?
Почему одни основания относятся к сильным электролитам, а другие к слабым?
Что представляет вода с точки зрения теории электролитической диссоциации?
Скажите, пожалуйста, какие вещества называются индикаторами?
Какие вам известны индикаторы?
Как изменяется окраска индикаторов в разных средах?
(В ходе обсуждения выявляются уже имеющиеся знания учащихся о кислотах и основаниях с точки зрения теории электролитической диссоциации, о изменении окраски индикаторов в разных средах)
Учитель: д.з. у вас было исследовать действие некоторых веществ на влажную индикаторную бумагу, результаты вас удивили, т.к. индикаторная бумага показывала присутствие кислоты или щёлочи в растворах солей. Сегодня мы разрешим все противоречия.
Учитель: Давайте подтвердим изменение окраски индикаторов опытом.
Приготовьте 6 пробирок и налейте в 2-е кислоты, во 2-е щелочи, в 2- е воды из стакана. Добавьте несколько капель лакмуса в пробирку с кислотой, со щелочью, и с водой.
Учитель: Что вы наблюдаете? (Изменение окраски).
А в следующие пробирки соответственно добавьте – метилоранжа.
Учитель: Ваши наблюдения? (Изменение окраски).
Учитель: Какую среду имеют данные растворы?
Присутствием, каких ионов обусловлена окраска индикаторов?
Учащиеся сообщают о концентрации ионов в различных средах и причинах изменения окраски индикаторов.
Учитель: Давайте проведём ещё один опыт.
1). Нальём в 2 пробирки раствор хлорид алюминия.
Вопрос учителя: Как вы думаете, какую окраску будут иметь лакмус и фенолфталеин в растворе этой соли? Учащиеся высказывают свои предположения.
Учитель: Ваши предположения проверим с помощью эксперимента. Прильем к раствору соли в первую пробирку раствор лакмуса, во вторую раствор фенолфталеина.
Вы видите, что в первой пробирке лакмус изменил окраску на красную, а во второй -фенолфталеин не меняет свой цвет.
Учитель: Какая среда данного раствора? (У школьников возникло противоречие с имеющимися знаниями – учителем создана проблемная ситуация).
Следовательно, раствор хлорида алюминия имеет кислую среду.
2.Возьмите раствор соли карбоната натрия, налейте также в 2 пробирки и добавьте индикаторы лакмус в одну и фенолфталеин в другую.
Учитель: Что наблюдаете? Какая среда данного раствора?
Нальем в две пробирки раствор хлорида натрия.
Учитель: Как вы думаете, будет ли изменяться окраска индикаторов в растворе этой соли? Проделаем эксперимент.
Учитель: Что вы наблюдаете?
Действительно среда в обеих пробирках среда нейтральная.
Учитель: Мы видим, что в разных водных растворах солей разная среда. Можем ли мы, основываясь на имеющихся знаниях, объяснить результаты данного опыта?
4. Изучение нового материала.
Учитель. Действительно, вы столкнулись с неизвестным пока для вас явлением, которое не можете грамотно истолковать на основании имеющегося у вас опыта и знаний. Это явление – гидролиз солей в водных растворах, и ему мы посвятим сегодняшний урок. Тема урока «Гидролиз солей». Запишем её в тетрадь. «Гидролиз» -данный термин состоит из двух составных частей от греческого “гидро” – вода, “лизис” – разложение. Дословно, гидролиз – разложение водой. К концу занятия вы должны сформулировать полное определение понятия “гидролиз”.
Давайте вспомним, из чего состоит раствор? (Школьники отвечают, из чего состоит раствор.) Вернёмся к нашему опыту.
Что в данном случае является растворителем и растворенным веществом? Давайте выясним состав данных солей.

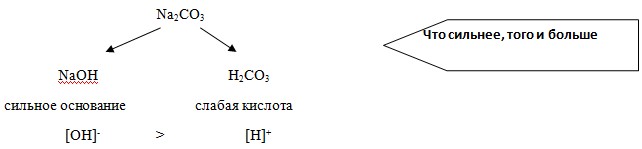
Что сильнее, того и больше
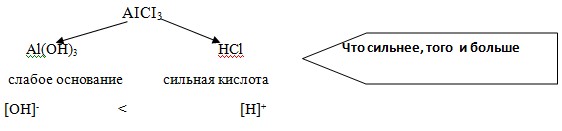
Кислая реакция среды
Попробуем разобраться, что же произошло. Вода, как вы знаете, является слабым электролитом и диссоциирует на положительные ионы водорода и гидроксид-ионы.
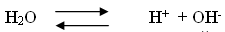
Хлорид алюминия – соль, образованная слабым основанием и сильной кислотой, диссоциирует следующим образом
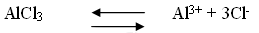
При растворении соли в воде слабые ионы соединяются т.е. гидролизуются.
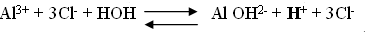 Среда кислая
Среда кислая
Учитель. Какой тип данной реакции? (реакция обмена)
Давайте сделаем вывод, используя данную схему.
Раствор соли, образованный_______________ имеет____________ реакцию, так как в растворе избыток _____________.
 (Соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, т.к. в растворе избыток ионов водорода.)
(Соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, т.к. в растворе избыток ионов водорода.)
Данная соль подвергается гидролизу. Это 1-й случай, когда реакция гидролиза идёт.
1.Аналогично составляются схемы по другим солям и делаются соответствующие выводы. (Один школьник выполняет задание на доске, остальные на местах, пользуясь алгоритмом)
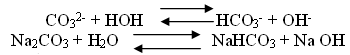
Щелочная реакция
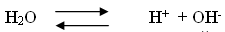

2Na+ +CO3 2- +H +OH- = HCO3- +2Na+ + OH- Среда щелочная.
Учитель: Какой тип реакции?
Сформулируем вывод:
(Раствор соли, образованной сильным основанием и слабой кислотой, имеет щелочную реакцию, так как в растворе избыток гидроксид-ионов.)
Данная соль подвергается гидролизу. Это 2-й случай когда реакция гидролиза идёт.
Составьте аналогичную схему для хлорида натрия
. 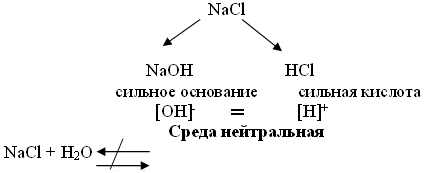
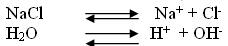
Учитель: Хлорид натрия гидролизу не подвергается, так как в составе соли нет иона, который мог бы при взаимодействии с водой образовывать слабый электролит.
Сформулируем вывод:
(Раствор соли, образованной сильным основанием и сильной кислотой, имеет нейтральную реакцию, так как в растворе равное количество катионов водорода и гидроксид-ионов.)
Учитель: Итак, на какие группы можно разделить соли по составу?
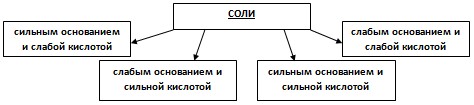
Учитель: Зачастую гидролиз идет необратимо, соль полностью разлагается водой. В этом случае в таблице растворимости в ячейке соответствующей соли стоит прочерк. В зависимости от природы соли, среда может быть нейтральная, щелочная или кислая. Сегодня мы с вами познакомились с особыми свойствами солей, которое называется гидролизом.
Проанализируйте записи молекулярных уравнений рассмотренных процессов. Ответьте на вопросы и дайте определение понятия «гидролиз».
К какому типу мы отнесем данные реакции?
Какие вещества в них участвуют?
В чем заключается сущность гидролиза? Какие продукты данных взаимодействий с точки зрения теории электролитической диссоциации мы получили?
Итак, гидролиз – это реакция обмена между некоторыми солями и водой приводящая к образованию слабого электролита.
Учитель: Это явление характерно не только для солей, но и для других соединений. Оно распространено в природе, и используется в промышленности и в быту.
5. Закрепление.
Студенты самостоятельно выполняют задания на карточках, работают в группах по 2 человека.
1. Установите соответствие между формулой соли и типом гидролиза.
| Формула соли | Тип гидролиза |
| а) (NH4)2CO3 | 1) по катиону; |
| б) NH4CL | 2) по аниону; |
| в) Na2CO3 | 3) по катиону и по аниону. |
| г) NaNO2 | |
2. Установите соответствие между названием соли и средой ее водного раствора.
| Название соли | Способность к гидролизу |
| а) Нитрат свинца (II); | 1) Кислая; |
| б) Карбонат калия; | 2) Щелочная; |
| в) Нитрат натрия; | 3) Нейтральная; |
| г) Сульфид лития. | |
3. Установите соответствие между формулой соли и молекулярно-ионным уравнением гидролиза.
| Формула соли | Молекулярно-ионное уравнение |
| а) Na3PO4; | 1) S2−+H2O↔HS−+OH−; |
| б) Al2(SO4)3; | 2) CH3COO−+NH4++H2O↔CH3COOH+NH3∙H2O; |
| в) K2S; | 3) PO43−+H2O↔HPO42−+OH−; |
| г) CH3COONH4. | 4) PO43−+3H2O↔H3PO4+3OH−; |
| | 5) Al3++H2O↔AlOH2++H+; |
| | 6) SO42−+2H2O↔H2SO4+2OH−. |
Через 10 мин ответы на экране, проводиться самопроверка.
6. Подведём итог урока:
С каким свойством солей вы познакомились на уроке?
Какие группы солей по составу вы знаете?
В каких случаях идёт реакция гидролиза?
В каком случае не идёт?
Какой ион определяет реакцию среды?
Какие ионы гидролизуются?
7. Домашнее задание
1) Подготовить сообщения по темам « Гидролиз в природе», «Гидролиз в народном хозяйстве и в жизни человека».
2) Заполнение таблицы
| Название соли. Вещества из домашнего эксперимента. | Уравнение гидролиза | Среда раствора | Окраска лакмуса |
| Гидрокарбонат натрия (сода пищевая) | | | |
| Хлорид цинка (паяльная кислота) | | | |
| Хлорид натрия (поваренная соль) | | | |
| Стеарат натрия (мыло) |
|
|
|
| Силикат натрия (канцелярский клей) |
|
|
|
Приложение 1
Гидролиз в природе
Обменные реакции между солями и водой широко распространены в природе.
Явление гидролиза играет огромную роль в химическом преобразовании земной коры. Многие минералы земной коры - это сульфиды металлов, которые хотя и плохо растворимы в воде, постепенно взаимодействуют с ней. Такие процессы идут и на поверхности Земли, и особенно интенсивно в ее глубинах при повышенной температуре. В результате образуется огромное количество сероводорода, который выбрасывается на поверхность при вулканической деятельности. А силикатные породы постепенно переходят в гидроксиды, а затем в оксиды металлов. В результате гидролиза минералов – алюмосиликатов – происходит разрушение горных пород.
Известный нам малахит (Cu(OH)CO3) – не что иное, как продукт гидролиза природных карбонатов.
В Мировом океане соли также интенсивно взаимодействуют с водой. Выносимые речной водой гидрокарбонаты кальция и магния придают морской воде слабощелочную реакцию. Именно в такой слабощелочной среде прибрежных вод рН приблизительно равно 9 наиболее интенсивно протекает фотосинтез в морских растениях и наиболее быстро развиваются морские животные. А если вспомнить о составе рН крови млекопитающих, в том числе и человека, то вы сможете не только сделать вывод о единстве животного мира на Земле но и сформулировать и некоторые гипотезы происхождении жизни на планете.
урок химия гидролиз соль
Приложение 2
Гидролиз в народном хозяйстве
Гидролиз доставляет немало хлопот нефтяникам. Как известно, в нефти имеются примеси воды и многих солей, особенно хлоридов кальция и магния. При нагревании нефти в процессе ее переработки до 250 град. С и выше происходит интенсивное взаимодействие указанных хлоридов с водяным паром. Образующийся при этом газообразный хлороводород вступает в реакцию с металлом, из которого сделано оборудование, разрушает его, что резко увеличивает стоимость нефтепродуктов.
Впрочем, на счету гидролиза немало и добрых дел. Например, образующийся при взаимодействии сульфата алюминия с водой мелкодисперсный осадок гидроксида алюминия уже несколько веков используется в качестве протравы при крашении. Оседая на ткань и прочно соединяясь с ней, гидроксид алюминия затем легко адсорбирует красители и образует весьма устойчивые красящие слои, которые выдерживают многократную стирку ткани. Без протравы качественной окраски тканей не получится.
Этот же процесс используют для очистки питьевой воды и промышленных стоков: рыхлый аморфный осадок гидроксида алюминия обволакивает частички грязи и адсорбирует вредные примеси, увлекая все это на дно. Примерно таков же механизм очистки природной воды глинами, которые представляют собой соединения алюминия.
Гидролиз солей Na2CO3 Na3PO4 применяется для очистки воды и уменьшения ее жесткости.
Известкование почв с целью понижения их кислотности также основано на реакции гидролиза.
Посредством гидролиза в промышленности из непищевого сырья (древесины, хлопковой шелухи, подсолнечной лузги, соломы вырабатывается ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкоза, сухой лед.
Гидролиз в жизни человека
В повседневной жизни мы постоянно сталкиваемся с явлением гидролиза – при стирке белья, мытье посуды, умывании мылом. Даже процессы пищеварения, в частности, расщепление жиров, протекают благодаря гидролизу.
Приложение 3
Алгоритм составления уравнений реакций гидролиза
1.Записать уравнение диссоциации воды.
2.Записать уравнение диссоциации соли.
3.Выбрать слабый ион.
4. Записать его взаимодействие с водой.
5.Опеделить среду раствора.









 (Соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, т.к. в растворе избыток ионов водорода.)
(Соль, образованная слабым основанием и сильной кислотой, имеет кислую реакцию, т.к. в растворе избыток ионов водорода.)












