Тема урока: «Молярный объем газов»
Тип урока: комбинированный.
Цель урока: сформировать понятие о молярном объеме и единицах его измерения.
Задачи урока:
Образовательные:
Проверить качество усвоения знания формул и понятий: количество вещества, моль, молярная масса, число Авогадро молярный объем, закон Авогадро;
Активизировать ранее сформированные навыки решения задач по данной теме.
Развивающие:
развитие навыков, необходимых при решении расчетных задач: умение выводить производные от формул; умение грамотно оформить задачу.
развитие познавательного интереса к предмету и навыков самооценки знаний.
Воспитательные:
организация самостоятельной деятельности обучающихся на уроке,
воспитание взаимовыручки и взаимодействия через игровые и групповые формы работы.
Продолжить формирования навыков заботы о своем здоровье.
Средства обучения:
Оборудование: весы с разновесами, мерный цилиндр, химический стакан, столовая ложка, фильтровальная бумага, чашка Петри, одноразовые стаканчики, салфетки, формулы на магнитной доске, презентация, раздаточный материал
Вещества: сахар-рафинад, вода минеральная.
Методы и формы обучения: объяснительно-иллюстративный с элементами проблемно-поискового изложения; групповая работа по решению задач.
Используемые педагогические технологии: игровые, групповые, ИКТ, проблемно-поисковый, (дифференцированный, работа по схеме-алгоритму)
ХОД УРОКА
Оргмомент. Постановка задач урока.
Опрос. Актуализация знаний.
Приветствие классу и предъявление черного ящика, в который спрятано задание (игра)
К доске приглашаются два ученика.
Один достает содержимое черного ящика, объясняет значение записей и прикрепляет магнитом на доске. Второй записывает обозначение соответствующих размерность величин – единицы измерения.
В черном ящике:
Работа 1 ученика Работа 2 ученика
| Что означает эта запись? | Что является единицей измерения? |
| n | Моль, кмоль, ммоль |
| М | г/моль; кг/кмоль; мг/ммоль |
| N |
|
| Na | 6*1023; 6*1026; 6*1020 |
| m | Г; кг; мг |
(Слайд № 3)
Работа 3 ученика
Используя данные обозначения, запиши формулы для вычисления:
А) массы вещества –
Б) числа молекул –
Что связывает эти 2 формулы? (количество вещества)
В)выведи из записанных ранее формул формулы для нахождения количества вещества –
Чему численно равна молярная масса (относительной молекулярной)
Проблемная ситуация (Слайд № 4 - № 5) (Приложение № 1)
Все читали или смотрели фильм «Дети капитана Гранта». Записка со стертыми записями пришла к нам. Попробуем восстановить. (помочь решить детям из будущего, приславшим записку при помощи машины времени:) Работа в группах по рядам – взаимопроверка.
| Вещество | Число молекул
N=Nan | Молярная масса
(рассчитывается по ПСХЭ) | Число молей
n =  | Масса вещества
m = M n |
| H2 | 30 * 1020 | 2 мг/ммоль | 5ммоль | 10 мг |
| Н2SO4 | 60 * 1023 | 98 г/моль | 10 моль | 980г |
| FeCl2 | 12 * 1026 | 127 кг/кмоль | 2 кмоль | 254 кг |
III. Закрепление знаний
Решение практических задач. Демонстрационный эксперимент.
Задача 1. (Слайд № 6)
Какое количество вещества сахара (С12Н22О11) содержится в кусочке рафинада?
Чтобы ответить на этот вопрос мы должны провести соответствующие измерения и расчёты
Для определения n мы должны знать массу, т.е. взвесить кусочек сахара.
Ученик взвешивает кусочек сахара.
Учащиеся предлагают решение задачи
Проверка решения задачи. Достают из конверта № 1 образец решения, сверяют записи, корректируют ошибки. Оценивают выполнение.
Физкультминутка. (Слайд № 7)
Точечный массаж для профилактики простудных заболеваний
Зная средство от простуды,
Мы здоровыми все будем.
Есть волшебные точки у нас –
Нажимай их каждый раз.
Точку красную найдем,
Пальчик кругом поведем.
Отдохнули, поворот –
Пальчик движется вперед.
Точку красную оставим,
Пальчик к синенькой приставим.
Чтобы носик наш дышал,
Насморк деткам не мешал.
Покрутили точку эту,
Передали эстафету.
Точки желтые находим
И опять по кругу водим.
Стоп, пойдем теперь вперед.
Кто быстрей новую точку найдет?
Точка зеленая на груди у нас,
Находим все дружно ее мы сейчас.
Пальчиком водим по кругу мы снова –
Из школы домой пойдут детки здоровы.
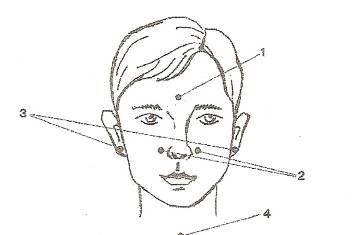
Точки:
1 – красная точка;
2 – две синие точки;
3 – две желтые точки;
4 – зеленая точка.
Задача 2. (Слайд № 8)
У каждого ученика в стакане 50 мл минеральной воды. Вы можете выпить её и ответить на вопрос: Сколько молекул этого напитка вы сейчас проглотили? Что нужно для этого знать?
Учащиеся предлагают решение задачи
Проверка решения задачи. Достают из конверта № 2 образец решения, сверяют записи, корректируют ошибки. Оценивают выполнение
IV Изучение нового материала: Молярный объем газов
Как называют массу 1 моль вещества (молярной) М
А как называют объем 1 моль вещества? (молярным)
Чему равен молярный объем воды?
Решим задачу. Определите объем воды, масса которой при нормальных условиях 180 г.
V – объем ( л; м3; мл)
Дано:
| m (H2O) = 180г | V(H2O) =  = 180 мл = 180 мл |
|  (H2O) = 1 г/мл (H2O) = 1 г/мл
V(H2O) =?
Вывод: объем жидких и твердых тел считаем через плотность | |
| Проблема: 1) По рис 49 стр. 83 учебника поясните почему объемы жидкости различны? |
|
2)А объемы газов одинаковы?
Вывод: объем жидких и твердых тел считаем через плотность, а при расчёте объёма газов не обязательно знать плотность. Почему?
Первым эту закономерность установил итальянский ученый Авогадро. Он определил, что
в равных объемах различных газов при одинаковых условиях (давлении, температуре) содержится одинаковое число молекул (- это утверждение называется законом Авогадро.)
1 моль газа – 6 * 10 23 (Слайд № 9
Т.е. если при равных условиях V(H2) =V(O2) , то n(H2) =n(O2), и наоборот если при равных условиях n(H2) =n(O2) то и объемы этих газов будут одинаковы. А моль вещества всегда содержит одно и тоже число молекул 6,02 *1023 .
Делаем вывод – при одинаковых условиях моли газов должны занимать один и тот же объем.
При нормальных условиях (t=0, P=101,3 кПа. или 760 мм рт. ст.) моли любых газов занимают одинаковый объем. Этот объем называется молярным - Vm. (Слайд № 10)
1 моль газа = 6 * 10 23 = Vm=22,4 л/моль
1кмоль занимает объём -22,4 м3/кмоль,
1ммоль занимает объем -22,4 мл/ммоль.
V=Vm n n = 
V Закрепление:
предлагается алгоритм вычисления объёма вещества по известной массе вещества
самостоятельное решение задач по задачнику О.С.Габриеляна стр.103 № 12,13,16 (Слайд №11)
VI Домашняя работа: Предложить сильным учащимся помочь решить детям из будущего, приславшим записку при помощи машины времени заполнить таблицу. (Слайд № 12) (Приложение № 2)
| Вещество | Число молекул
N = n Na | Масса вещества
m = M n | Число молей
n =  | Молярная масса
M= 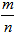
(можно определить по ПСХЭ) | Объем
V=Vm n |
| CO2 | | 264г | | | |
| N2 | 120,4*1023 | | | | |
| Cu | | 192г | | | |
| Сl2 | | | | | 112м3 |
Д/З . &16 (учить формулы, разобрать решение задач), № 1, 2,4 (п) (Слайд № 13)

















