Сабақ жоспары / План урока
Пән / Предмет ХИМИЯ
Сынып/Класс ДЕВЯТЫЙ Сабақ / Урок № 53 Күні / Дата 04.04.2013 год
Тақырыбы / Тема: : Этилен – представитель ненасыщенных углеводородов. Двойная связь. Получение из насыщенных углеводородов ненасыщенных на примере получения этилена из этана. Физические и химические свойства этилена, горение. Характерные реакции для ненасыщенных углеводородов: присоединение водорода, брома, воды. Получение полиэтилена полимеризацией этилена.
Сабақтың мақсаты / Цель урока: формирование знаний учащихся о непредельных углеводородах на примере этилена.
Білімділік / 0бразоватепъная:\ рассмотреть особенности строения молекулы этилена; установить взаимосвязь между строением молекулы этилена и его свойствами; ознакомить с способами получения этилена; его практическим применением.
Дамытушылық / Развивающая:_ развивать умения классифицировать углеводороды по строению их молекулы; составлять уравнения химических реакций, характеризующих свойства алкенов.
Тәрбиелік / Воспитательная: способствовать воспитанию самостоятельности; всесторонне развивать личность школьников.
Көрнекілігі / Оборудование: Доска, интерактивная доска, компьютер, флипчарт
Пәнаралық байланыс Межпредметныe связи:
.
география
Сабақ барысы / Ход урока:
1.Ұйымдастыру кезені
Организационный момент
Приветствие учителя.
Ознакомление с целью и задачами урока.
2.Үй тапсырмасы тексеру
Проверка домашнего задания.
Задание 9 стр. 151
По термохимическому уравнению горения метана СН4 + 2О2 СО2 + 2Н2О+ 890кДж рассчитать количество теплоты, которое выделится при сгорании 64 грамм метана.
СО2 + 2Н2О+ 890кДж рассчитать количество теплоты, которое выделится при сгорании 64 грамм метана.
3.Білімін тексеру
Проверка знаний:
Даны структурные формулы углеводородов:
СН3-СН2-СН3, СН2=СН-СН3, СН≡С-СН3, Н2С=СН2, СН3-СН2-СН2-СН3, СН≡СН,
СН3-СН2-СН2-СН2-СН3. Выписать формулы гомологов метана и дать им название.
Решение: СН3-СН2-СН3- пропан, СН3-СН2-СН2-СН3- бутан, СН3-СН2-СН2-СН2-СН3 – пентан.
4.Жана тақырыптың мазмұны
Изложение нового материал:
УЧИТЕЛЬ: Что особенного в строении оставшихся веществ?
-Они имеют двойные и тройные связи.
УЧИТЕЛЬ: Углеводороды, молекулы которых имеют кратные связи называют непредельными.
Сегодня на уроке вы познакомитесь с углеводородами, в молекуле которых имеется одна двойная связь.
Такие углеводороды называют алкеными.
Алкены –углеводороды, с общей формулой CnH2n ,в молекуле которых имеется одна двойная связь.
Чем отличаются молекулы алкенов от молекул алаканов?
- Молекулы алкенов имеют на два атома водорода меньше.
Простейший представитель алкенов- этилен С2Н4 . Структурная формула этилена Н2С=СН2.
В алкенах атомы углерода находятся в состоянии sp2-гибридизации.Следовательно одна р-орбиталь является негибридной.

В результате образования молекулы этилена образуетяс 5σ-связей и одна π-связь, которая в пространстве располагается перпендикулярно σ-связям.
Как образована двойная связь?
-Двойная связь образована одной σ-связью и одной π-связью.
Какая связь более прочная?
-Более прочная σ-связь.
Сравнение свойств σ- и π-связей
.
| σ-связь | π-связь |
| 1.Электронные облака перекрываются в одной плоскости ( по прямой), соединяя центры взаимодействующих атомов 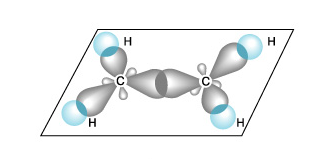  | 1.Электронные облака перекрываются в двух областях пространства, плоскость проходит через центры взаимодействующих атомов 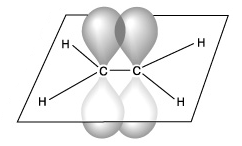  |
| 2. Атомы, соединенные σ-связью могут вращаться относительно оси связи без её разрыва. | 2.Атомы, соединенные π-связью не могут отдельно друг от друга вращаться вокруг оси связи. (Почему?) - π-связь слабая произойдёт её разрыв. |
| 3. σ-связь образуется между электронами с орбиталью: s-s s-p p-p | 3. π-связь образуется между электронами с орбиталью: p-p p-d d-d |
Длина двойной связи в алкенах -0,134 нм, угол между гибридными орбиталями 1200.
УЧИТЕЛЬ: Какая связь определяет непредельный характер алкенов.?
- π-связь, так как она легко разрывается.
Алкены –производные алканов, в их названиях суффикс –ан заменяется на суффикс –ен.
Этан – этен, пропан –пропен, бутан –бутен и т.д.
Получение этилена.
Алкены в промышленности получают путём отщепления водорода в молекулах соответствующих алканов.
С2Н6 С2Н4+ Н2↑
С2Н4+ Н2↑
Реакции разложения углеводородов, протекающие с выделением водорода, называют реакцией дегидрирования.
Физические свойства.
Первые три представителя гомологического ряда этиленовых углеводородов – газы, начиная с С5Н10 – жидкости, а С18Н36 и высшие алкены – твердые вещества. С увеличением молекулярной массы алкена повышается их температуры плавления и кипения. Алкены с углеродной цепью нормального строения кипят при более высокой температуре, чем их изомеры, которые имеют разветвленную структуру. Перемещение двойной связи в центр молекулы вызывает повышение температур кипения и плавления алкена.
Химические свойства.
Химические свойства алкенов обусловлены в первую очередь присутствием в их молекулах двойной углерод-углеродной связи С=С. Так как двойная связь легко разрывается, алкены способны присоединять атомы других элементов. В связи с этим алкены вступают в реакции:
1.ПРИСОЕДИНЕНИЯ:
- реакция гидрирования
Ni
Н2С=СН2 +Н2 Н3С-СН3 +137кДж
этилен этан
- реакция галогенирования
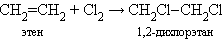
-реакция гидротации
Н2С=СН2 +Н2О С Н3-СН2-ОН
Этилен этиловый спирт
2.ПОЛИМЕРИЗАЦИИ (Процесс соединения одинаковых молекул в более крупную молекулу):
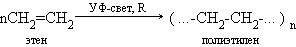
В результате реакции образуются полимеры .Поли- много (греч.)
Алкены так же горят в кислороде коптящим пламенем, что объясняется их непредельным характером.
С2Н4 + 3О2 2СО2↑+ 2Н2О
2СО2↑+ 2Н2О
Применение:
1.Этилен используют в медицине для общего наркоза при операциях.
2.Сырьё для производства полимеров.
3.Производство этилового спирта (В Казахстане заводы по производству этанола находятся в Шымкенте и Атырау).
4.Производство уксусной кислоты, антифризов.
5.Этилен используют в теплицах и на складах хранения овощей и фруктов для ускорения созревания плодов.
5.Өгілген тықырыпты бекіту
Первичное закрепление изученного материала:
Выполнить задание 7 стр.157.
Составить уравнения реакций при помощи которых можно осуществить следующие превращения:
С2Н6→С2Н4→С2Н5ОН
Итог урока:
Дописать предложения:
1.В молекуле этилена есть... (одна двойная связь).
2.В отличие от этана этилен вступает в реакцию ... (присоединения).
3.Полиэтилен –это полимер, который содержит... ( большое количество молекул этилена).
4.Этилен получают из... (этана). Эту реакцию называют реакцией... (дигидрирования).
5. На заводах Шимкента и Атырау из этилена получают... (этиловый спирт).
|6. Үйге тапсырма беру
Задание на дом: §48, задание 9, стр. 157




















