| Химия – наука о веществах. Как измерить вещество? В каких единицах? Для измерения вещества была выбрана особая единица, в которой как бы соединились число молекул и масса вещества. Эта единица была названа моль. Чтобы отмерить 1 моль вещества, нужно взять столько граммов его, какова относительная атомная масса (Аr) или относительная молекулярная масса (Мr). Например, 1 моль воды имеет массу, равную 18 г, т.к. Мr (Н2О) = 18 1 моль кислорода имеет массу, равную _____ г, т.к. Мr (О2) = _____ 1 моль железа имеет массу, равную _____ г, т.к. Мr (Fe) = _____ А если нужно отмерить 2 моль воды, то, сколько грамм ее нужно взять? _____________________________ А можно отмерить 0,5 моль кислорода? _________________________________________________________ А сколько молей воды взяли, если, например, отмерили 45 г воды?__________________________________ П одтвердите ответ формулой: одтвердите ответ формулой:
А как связано с количеством вещества число его молекул? Установлено, что 1 моль любого вещества всегда содержит одинаковое число молекул. Это число равно _______________________ и называется _____________________________________________, в честь итальянского ученого А. Авогадро, обозначают его ______. Таким образом, 1 моль воды имеет массу 18 г и содержит 6,02·10²³ молекул Н2О. 1 моль кислорода имеет массу, равную _____ г, и содержит _______молекул О2 1 моль железа имеет массу, равную _____ г, и содержит _______молекул Fе. Очевидно, что в 2-х моль воды и любого вещества содержится 12,04 1023 молекул, а в 0,5 моль _____ молекул. З начит, чтобы узнать число молекул N, содержащихся в определенном количестве вещества, можно воспользоваться формулой: начит, чтобы узнать число молекул N, содержащихся в определенном количестве вещества, можно воспользоваться формулой:
Где - __________________________________, т.е. число _____________. О  тсюда верны и следующие равенства: тсюда верны и следующие равенства: = NA = Моль – это _________________________________________________________________________________ ___________________________________________________________________________________________ В молях измеряется и число других частиц - _____________________________________________________ М ассу 1 моль вещества называют его ________________________ массой и обозначают буквой ______. ассу 1 моль вещества называют его ________________________ массой и обозначают буквой ______. Чтобы найти количество вещества , нужно его массу m разделить на молярную массу  
Следовательно, верны и обратные формулы m = и М =
Таким образом, молярная масса – это физическая величина, которая равна отношению __________ вещества к _________________ вещества. Отсюда можно определить единицы измерения молярной массы - _________________. М (Н2О) = _______________; М (О2) = ________________; М (Fe) = ________________; Объясните, почему 1 моль С2Н6 тяжелее чем 1 мoль СН4. Дoкажите расчетами. 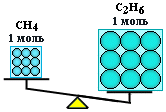
| 






 одтвердите ответ формулой:
одтвердите ответ формулой:  начит, чтобы узнать число молекул N, содержащихся в определенном количестве вещества, можно воспользоваться формулой:
начит, чтобы узнать число молекул N, содержащихся в определенном количестве вещества, можно воспользоваться формулой:
 ассу 1 моль вещества называют его ________________________ массой и обозначают буквой ______.
ассу 1 моль вещества называют его ________________________ массой и обозначают буквой ______.




















