Состав атомного ядра. Зарядовое и массовое число. Ядерные силы. Энергия связи ядра
Цели:
Учебные: Изучить состав атомного ядра. Рассмотреть зарядовое и массовое число, силы взаимодействия в ядре, энергию связи ядра. Закрепить понимание решения задач у учащихся.
Развивающие: развитие логического мышления учащихся, а так же творческого подхода в решении задач.
Воспитательные: формировать познавательный интерес, положительную мотивацию к обучению.
Организационные методы:
Традиционные – беседа на вводном этапе урока, проверка и закрепление знаний прошлой темы.
Инновационные – закрепление учебного материала с помощью компьютера, визуализация законов и сил.
План урока
Перекличка.
Состав атомного ядра
Ядерные силы
Энергия связи ядер
Решение задач.
Подведение итогов.
Ход урока:
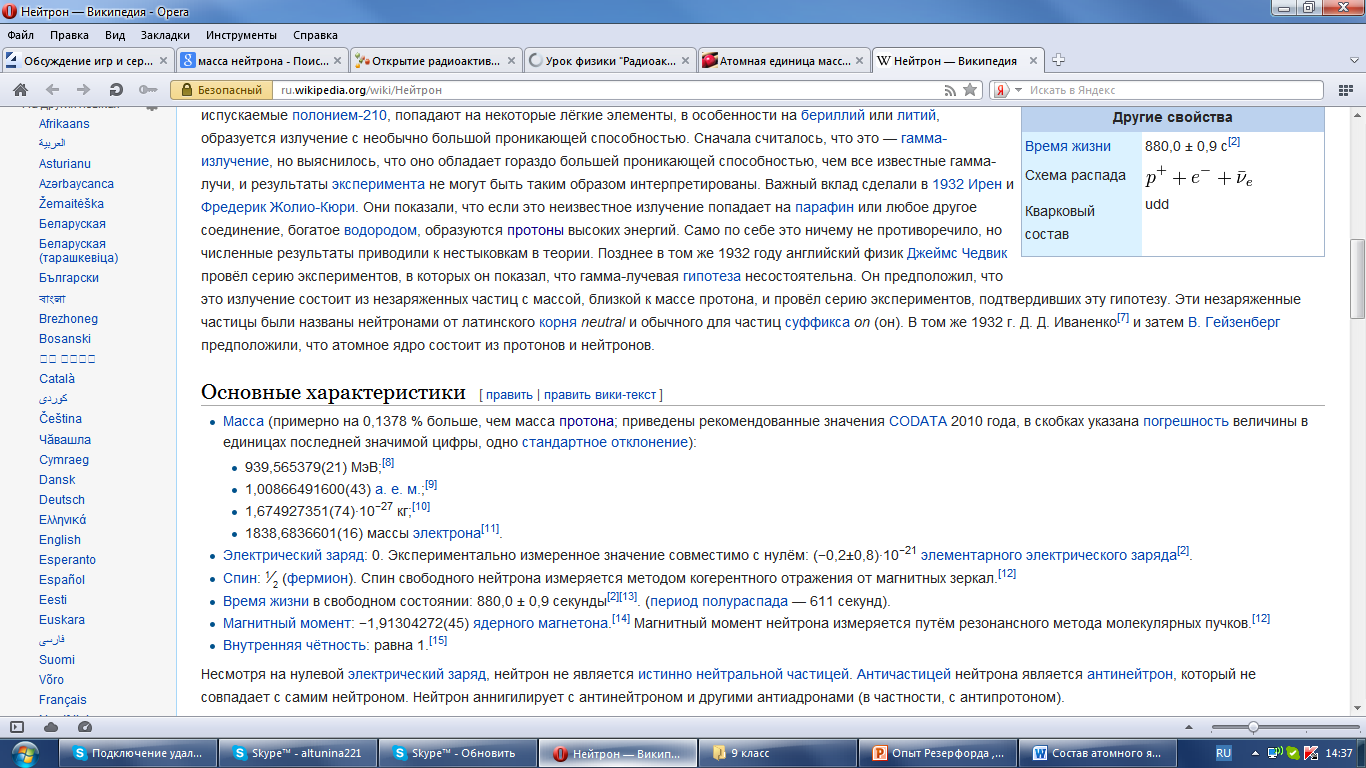
Независимо друг от друга два человека, русский ученый Иваненко и немецкий ученый Гейзенберг, предложили протонно-нейтронную модель строения ядра атома. По этой теории Иваненко – Гейзенберга, ядро любого атома содержит протоны и нейтроны. Эти протоны и нейтроны вместе, те, которые находятся в ядре атома, было решено называть нуклонами. Таким образом, «нуклон» (от лат. «ядро») – общее название для протонов и нейтронов.
Уравнение Иваненко - Гейзенберга
А = Z + N
Число нуклонов в ядре обозначается буквой A (массовое число, сверху)
Z – порядковый номер элемента (число протонов, снизу)
N – число нейтронов в ядре
Выяснено было, что существуют химические элементы с абсолютно одинаковыми химическими свойствами, но разным массовым числом. Их стали называть изотопами. Изотопы – это химические элементы с одинаковыми химическими свойствами, но с различной массой атомных ядер.

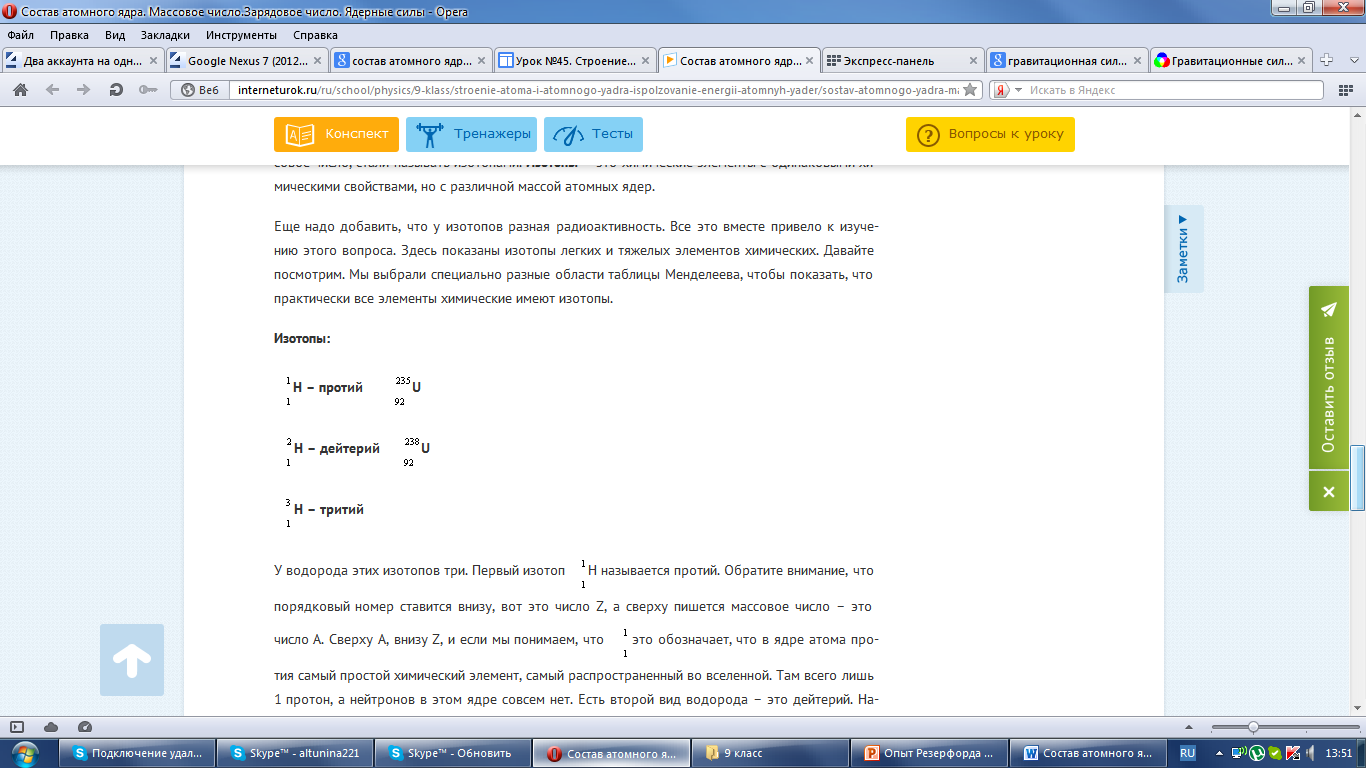
Итак, давайте рассмотрим благодаря каким силам протоны и нейтроны удерживаются в атоме.
Такие силы называются ядерными
Ядерные силы – это силы притяжения, действующие между нуклонами. Можно сказать, что у этих сил существуют свои особые свойства:
Действуют на малом расстоянии.( до 10^-15 м)
Они не центральны, т.е. они не действуют вдоль прямой, соединяющей эти частицы.
Не зависят от того, обладает частица зарядом или не обладает
Энергия связи атомных ядер
Для полного расщепления ядра на составные части и удаление их на большие расстояния друг от друга необходимо затратить определенную работу А.
Энергией связи называют энергию, равную работе, которую надо совершить, чтобы расщепить ядро на свободные нуклоны.
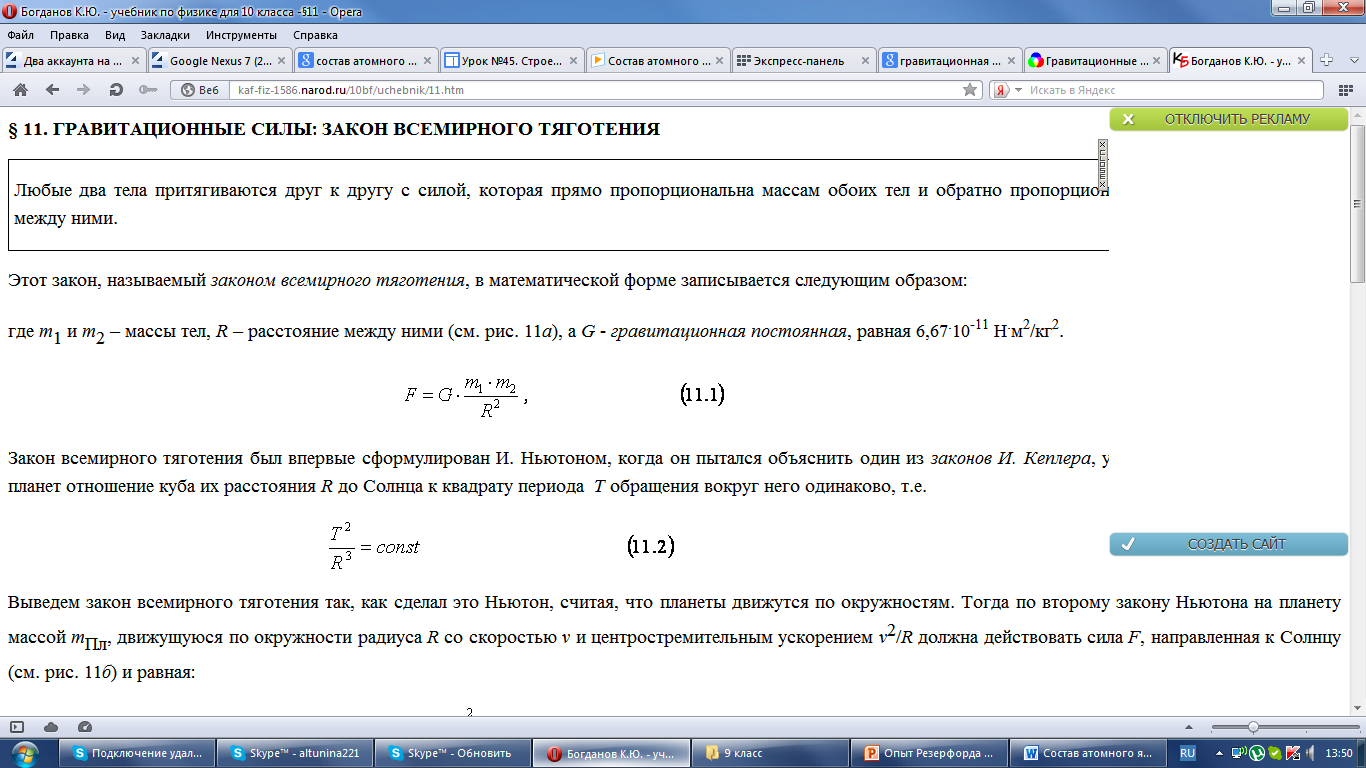
Чтобы понимать, как рассчитать энергию связи, нужно отметить, что в начале ХХ века А. Эйнштейн показал, что существует прямая зависимость энергии и массы тела:
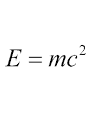
Е – это энергия, измеряется в джоулях.
m – это масса тела,
с – это скорость света.
Когда стали выяснять, как определить энергию связи, ту саму ядерную энергию, заключенную внутри ядра, выяснилось, что это можно сделать, используя это уравнение Эйнштейна.
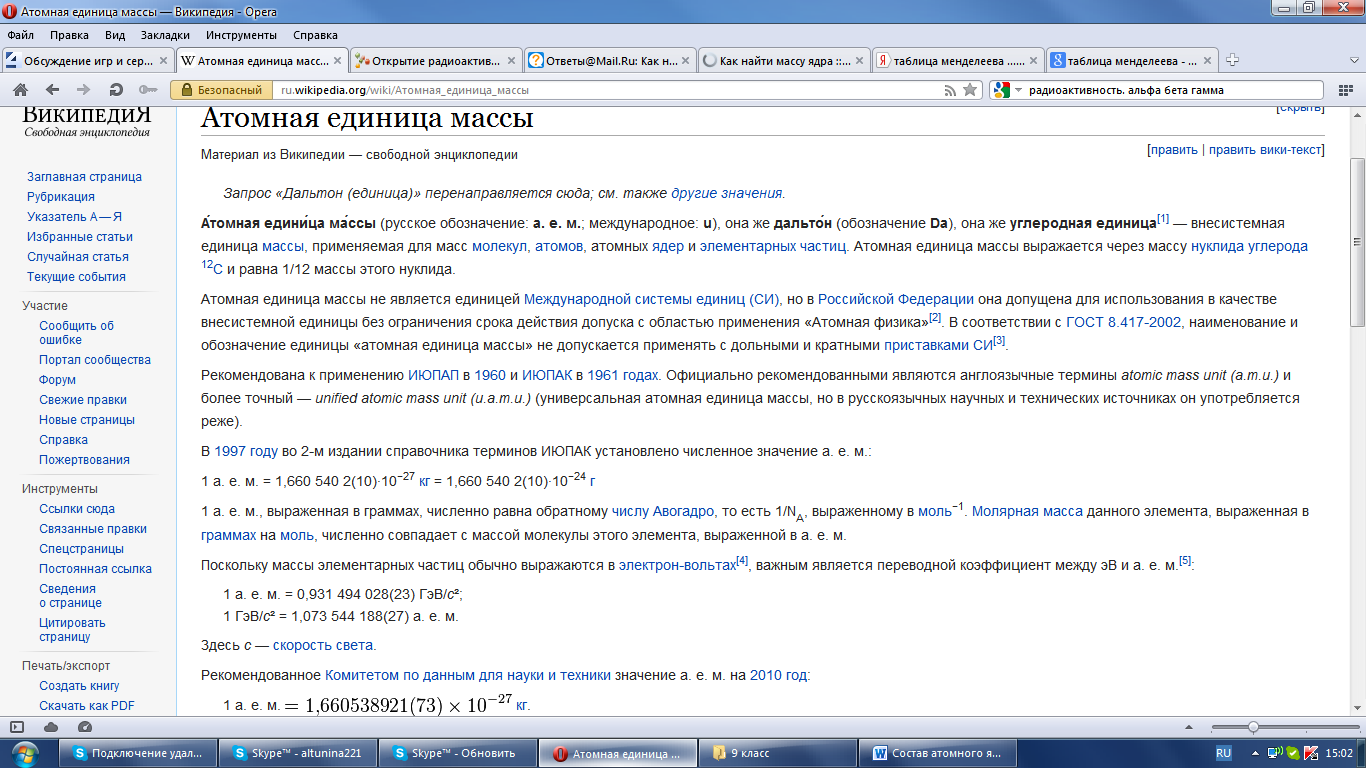
Дефект масс
Какую же массу следует подставить в формулу Эйнштейна? Здесь следует заметить, что когда стали определять массы ядер и сравнивать их с суммарной массой нуклонов, выяснилось, что масса ядра всегда получается меньше суммарной массы отдельно взятых нуклонов. Получается удивительная вещь: если мы соберем нуклоны, входящие в ядро атома, посчитаем их массу отдельно, то эта масса окажется больше, чем масса самого ядра, того элемента, которое из этих нуклонов получается. Куда девается эта часть массы? Эту «потерянную» часть назвали дефектом массы.

Масса протона для всех элементов одинакова и равна:
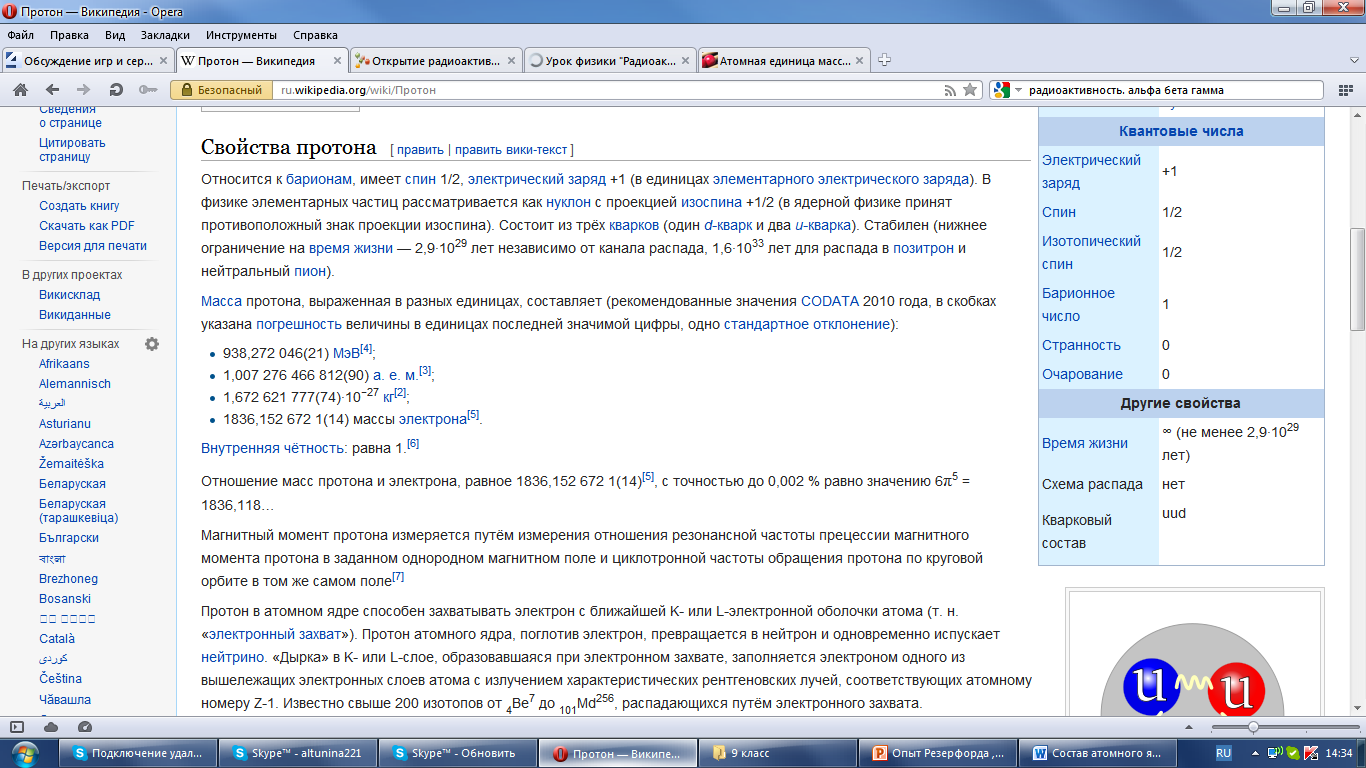
1,007 276 466 812(90) а. е. м(дальтон)
Масса нейтрона:
1,00866491600(43) а. е. м
а.е.м. – атомная единица массы, дальтон
Масса ядра находится по таблице Менделеева, например масса ядра гелия Mя = 4,00260 а. е. м.
Энергия связи с использованием уравнения Эйнштейна определяется очень просто: 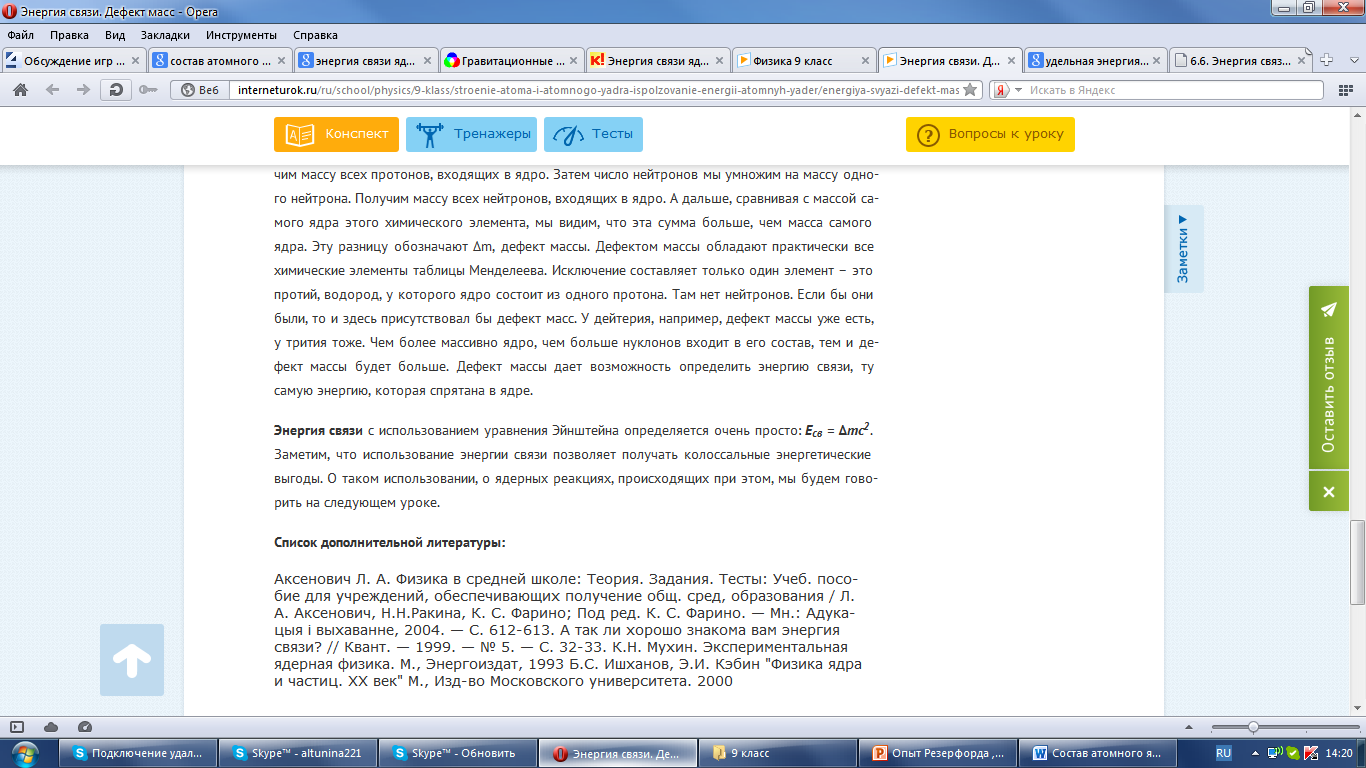 .
.
Δm = ZМп + (A − Z)Мн – Мя (Ма – масса атома, дефект которого определяется)
Если подставлять массу в а.е.м., то энергия связи находится в МэВ, если в киллограмах, то в Дж
Крупинка радия массой 0,1 г выделяет энергию, которой бы хватило чтобы поднять 3 слонов на Эверест
Задачи:
Определите нуклонный состав ядер железа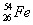 (количество нуклонов, протонов, нейтронов).
(количество нуклонов, протонов, нейтронов).
2. В ядре атома химического элемента 22 протона и 26 нейтронов. Назовите этот химический элемент.
3. Оцените силу гравитационного взаимодействия между двумя нейтронами в ядре. Масса нейтрона примерно равна 1,7*10^-27 кг, расстояние между нейтронами примите равным 10^-15 м, значение гравитационной постоянной 6,67*10^-11 (Н*м2)/кг2.
Найти энергию связи и удельную энергию связи Есв/А для:
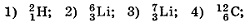
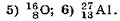
Какая минимальная энергия необходима для расщепления ядра азота  на протоны и нейтроны?
на протоны и нейтроны?




















