Урок-обобщение по теме
"Расчеты с использованием понятий «количество вещества», «молярная масса» «молярный объем газов», «постоянная Авогадро»"
Цель урока: Обобщить и повторить понятия: количество вещества, моль, молярная масса, число Авогадро, молярный объем, закон Авогадро.
Задачи:
воспитывающие: воспитывать взаимовыручку и взаимодействие через групповую и парную форму работы;
развивающие: развивать познавательный интерес к предмету и навыки самооценки знаний, умение логически мыслить, выдвигать гипотезы, делать аргументированные выводы;
обучающие: формировать понятия о молярной массе и единицах ее измерения, показать взаимосвязь понятий: масса, количество вещества, молярная масса, молярный объем газа.
Планируемые результаты:
личностные: формировать умения понимать значимость естественнонаучных и математических знаний для решения практических задач; устанавливать связь между целью деятельности и ее результатом, оценивать
собственный вклад в работу группы;
метапредметные: формировать умения планировать, контролировать и оценивать учебные действия в соответствии с поставленной задачей,самообразование, самоорганизация, саморазвитие и самоопределение,
предметные: установить взаимосвязь понятий: масса, количество вещества, молярная масса, молярный объем газа.
Ожидаемые результаты.
Ученики знают понятия:
«количество вещества», «молярная масса», «молярный объем», «моль», «число Авогадро»;
Ученики умеют:
на базовом уровне: называть количество вещества и молярную массу по обозначениям, указывать единицы измерения, видоизменять расчетную формулу при решении прямых задач;
для повышенного уровня: видоизменять расчетную формулу при решении прямых и обратных задач,
Оборудование и реактивы: ПК, проектор, индивидуальные маршрутные листы, многовариантные карточки,
Форма проведения: используются индивидуальная, парная, групповая форма работы, которые повышают мотивацию, позволяют выбирать индивидуальный темп, решать творческие задачи, формируют навыки самоорганизации и самообразования, обеспечивают деятельностный и личностно-ориентированный характер образования.
Продолжительность: (по 40 мин)
Ход урока
I. Организационный момент - Приветствуют
Девиз урока. Повторение - мать учения. Арабская пословица
II. Обобщение и повторение 1. Актуализация знаний.
Расскажу сегодня, что ли, о зловредной роли моли.
Моль съедает шерсть и мех – просто паника всех…
Ну а в химии – изволь! Есть другое слово «моль».
Прост, как небо и трава, моль любого вещества.
Но трудна его дорога: в моле так молекул много!
Какое отношение имеет моль к теме нашего урока? С какими новыми величинами мы познакомились на предыдущих уроках?
Давайте их вспомни
2.Разминка Дальше, дальше, дальше…. Фронтальный опрос.
1) Что такое моль?
2) Что называют молярной массой вещества?
3) Чему численно равна эта молярная масса?
4) Как рассчитать молярную массу? хлора
5) Какова молярная масса озона?
6) Сколько литров газообразного вещества содержится в 1 моль вещества?
7) Сколько молекул газа в 1 моль вещества?
8) Как называют объем 1 моль газообразного вещества?
9) По каким величинам можно рассчитать количество вещества?
10. Железо --………
11.Вода- это……….вещество.
12.Молярная масса меди равна……
13.1 моль брома иода водорода калия
Количество вещества – физическая величина, которая:
означает определенное число структурных элементов (атомов, молекул, ионов);
измеряется в международной системе единиц (СИ) - моль.
Молярная масса – физическая величина, которая:
показывает массу в 1 моль вещества;
обозначается М;
измеряется) - г\моль;
формула для расчёта - М = m \ υ.
Молярный объем – физическая величина, которая:
показывает объем, который занимает любой газ количеством вещества 1 моль;
обозначается V m;
измеряется в международной системе единиц (СИ) - л \ моль;
формула для расчёта - V = υ ∙ Vm;
при н.у. V m = 22,4л\моль.
Число Авогадро
показывает число структурных частиц в 1 моль вещества;
обозначается NА ;
в моль -1;
числовое значение 6,02 · 1023
3. Две команды по 4-5 человек. Один у доски. Возможна помощь
1 задание Все жители нашего города – физические величины, их формулы и единицы измерения перемешались. Они просят восстановить между ними прежний порядок» (слайд 8).
Задание 1 в маршрутном листе, парная работа.
| Величина | Вычисление или значение | Единица измерения |
| М | 6,02 ∙ 1023 | моль |
| N | m / M | г/моль |
| m | сумма Аr (Э) | моль-1 |
| n | n ∙ NA | молекулы (атомы) |
| NA | n∙М | г |
Проверка: правильные ответы (заготовки формул, единиц измерений) крепятся на доску. 1 ученик - восстановить сообщение между величиной и формулой, 2 - восстановить сообщение между величинами и единицами их измерения.
Задание 2 (Слайд № 7-8)
Задания 3(Слайд № 9 )
Задания 4(Слайд № 10-12 )
Алгоритм решения задач.
1. Прочитайте внимательно условия задачи.
2. Запишите: «Дано» и «Найти».
3.Определите и запишите формулу для решения.
4.Определите неизвестные величины в формуле и найдите их.
5. Подставьте в формулу и найдите неизвестное и запишите ответ

для группы №1-2
1.Какой объем займут 2 моль кислорода (О2)
Ответ: V (O2)=44.8 л.
2. Какое количество вещества составляет 11,2 литров углекислого газа (СО2)
Ответ: n(CO2) = 0.5 моль
3.Сколько молекул в в 5 моль азота (N2)
Ответ: N (N2)=30.1*1023 молекул.
4.Какую массу составляет 5,6 литров хлора (Cl2 )
Ответ: m(Cl2) = 17.75 г.
5.Найдите массу 3 моль оксида меди (CuO)
Ответ : m(CuO) = 240 г.
Физминутка 
Конкурс «Отгадываю задуманные элементы»
Атрибуты игры: ПСХЭ Д.И.Менделеева и калькулятор.
Загадайте химический элемент.
Номер элемента удвоить (×2).
К произведению прибавить пять (+5).
Сумму умножить на пять (×5).
Отбрасываем последнюю цифру, -2
Результат сообщается ведущему, который тотчас объявляет задуманный элемент.
Задания 5(Слайд № 14-15 )
| вариант | формула | М
(г/моль) | n (моль) | m (г) | N (молекул) | V (л) |
| 1 | HF | | 0,5 | | | |
| 2 | SiH4 | | | 8 | | |
| 3 | O3 | | | | 3∙1023 | |
| 4 | C2H6 | | 1,5 | | | |
| 5 | HBr | | | 121,5 | | |
| 6 | SO2 | | | | | 2,24 |
| 7 | NH3 | | 2 | | | |
| 8 | CH4 | | | | 2∙1023 | |
| 9 | CO2 | | | 4,4 | | |
| 10 | H2S | | | | | 67,2 |
- III. Заключительная часть. Подведение итогов
Просуммируйте полученные баллы и поставьте себе отметку (слайд 17).
Обобщающая фронтальная беседа:
- С какими величинами мы сегодня работали?
- Какая величина в химии самая главная? Почему?
- Сделайте вывод о взаимосвязи физических величин (слайд 18).
- Оценки за урок получают самые активные члены экипажа, остальные - после проверки бортовых журналов.
IV. Рефлексия (слайд 19) Учитель читает стихотворение (“Занимательная химия” Аликберова Л.):
Маша маме говорит,
Что из шкафа моль летит
“Как спасти нам вещи наши?”
Отвечает мама Маше:
“Есть такой аэрозоль,
Убивает моли моль!”
Маша химию учила,
Так что маме возразила:
“Что-то это многовато –
Целый моль врагов крылатых!”
Учитель: Целью сегодняшнего урока было не только изучить физическую величину количество вещества, но и научиться применять её при решении расчетных задач, пользуясь производными расчётными формулами. Цель урока достигнута.
После этого учащиеся выражают своё эмоциональное отношение к уроку и оценивают свою активность по пятибалльной системе (на столах имеются карточки).
Слайд рефлексия -
V. Домашнее задание (слайд 20)
Придумать и решить задачу, используя понятия «количество вещества», «молярная масса», «молярный объем газов», «постоянная Авогадро.
| Физическая величина | Дать название Физической величине | Что является единицей измерения? |
|
|
| Моль |
| М |
|
|
| N |
| |
|
|
| 6*1023 1/моль |
|
|
| г |
| Vm |
|
|
|
|
| л |
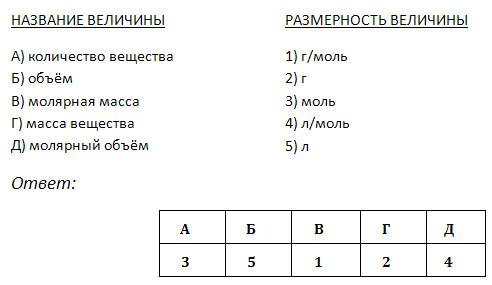
1 Задание «На планете знаний все жители – физические величины, их формулы и единицы измерения перемешались. Они просят восстановить между ними прежний порядок»
| Величина | Вычисление или значение | Единица измерения |
| М | 6,02 ∙ 1023 | моль |
| N | m / M | г/моль |
| m | сумма Аr (Э) | моль-1 |
| n | n ∙ NA | молекулы (атомы) |
| NA | n∙М | г |
1 Задание «На планете знаний все жители – физические величины, их формулы и единицы измерения перемешались. Они просят восстановить между ними прежний порядок»
| Величина | Вычисление или значение | Единица измерения |
| М | 6,02 ∙ 1023 | моль |
| N | m / M | г/моль |
| m | сумма Аr (Э) | моль-1 |
| n | n ∙ NA | молекулы (атомы) |
| NA | n∙М | г |
2 Задание Что показывают эти обозначения.


3 3адание. Какие величины постоянные, назвать их и написать их значения.
m (H2O)
M (H2O)
n (H2O)
N (H2O)
NА
Vm (H2)
V (H2O)
N (H)
3 3адание Какие величины постоянные, назвать их и написать их значения
m (H2O)
M (H2O)
n (H2O)
N (H2O)
NА
Vm (H2)
V (H2O)
N (H)
4 Задание. ЗадачиЗадания для группы №1
1.Какой объем займут 2 моль кислорода (О2)
2. Какое количество вещества составляет
11,2 литров углекислого газа (СО2)
3.Сколько молекул в 112 литрах азота (N2)
4.Какую массу составляет 5,6 литров
хлора (Cl2 )
5.Найдите массу 3 моль оксида меди
(CuO)
4 Задание. ЗадачиЗадания для группы №1
1.Какой объем займут 2 моль кислорода -
(О2)
2. Какое количество вещества составляет
11,2 литров углекислого газа (СО2)
3.Сколько молекул в 112 литрах азота (N2)
4.Какую массу составляет 5,6 литров
хлора (Cl2 )
5.Найдите массу 3 моль оксида меди -
(CuO)
| вариант | формула | М
(г/моль) | n (моль) | m (г) | N (молекул) | V (л) |
| 1 | HF | | 0,5 | | | |
| 2 | SiH4 | | | 8 | | |
| вариант | формула | М
(г/моль) | n (моль) | m (г) | N (молекул) | V (л) |
| 3 | O3 | | | | 3∙1023 | |
| 4 | C2H6 | | 1,5 | | | |
| вариант | формула | М
(г/моль) | n (моль) | m (г) | N (молекул) | V (л) |
| 5 | HBr | | | 121,5 | | |
| 6 | SO2 | | | | | 2,24 |
| вариант | формула | М
(г/моль) | n (моль) | m (г) | N (молекул) | V (л) |
| 7 | NH3 | | 2 | | | |
| 8 | CH4 | | | | 2∙1023 | |
| вариант | формула | М
(г/моль) | n (моль) | m (г) | N (молекул) | V (л) |
| 9 | CO2 | | | 4,4 | | |
| 10 | H2S | | | | | 67,2 |
| Вычисление или значение | Единица измерения |
| 6,02∙1023 | моль |
| m / M | г/моль |
| сумма Аr (ХЭ) | моль-1 |
| n ∙ NA | молекулы (атомы) |
| N / NA | моль |
| V /Vm | моль |
| n∙М | г |
| 22,4 | л/моль |
| n Vm | л. |





























